「PAX遺伝子群」の版間の差分
細編集の要約なし |
|||
| (3人の利用者による、間の34版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | |||
<font size="+1">櫻井 勝康、[http://researchmap.jp/t-kikkawa 吉川 貴子]、[http://researchmap.jp/noriko1128 大隅 典子]</font><br> | |||
''東北大学 大学院医学系研究科''<br> | |||
DOI:<selfdoi /> 原稿受付日:2012年10月31日 原稿完成日:2014年3月24日<br> | |||
担当編集委員:[http://researchmap.jp/fujiomurakami 村上 富士夫](大阪大学 大学院生命機能研究科)<br> | |||
</div> | |||
{{Infobox protein family | |||
| Symbol = Pax | |||
| Name = Paired domain | |||
| image = 1mdm Pax5 paired domain.png | |||
| width = 250 | |||
| caption = Inhibited fragment of ETS-1 (orange) and Paired domain of Pax5 (green) bound to DNA | |||
| Pfam = PF00292 | |||
| Pfam_clan = CL0123 | |||
| InterPro = | |||
| SMART = | |||
| PROSITE = PDOC00034 | |||
| MEROPS = | |||
| SCOP = 1pdn | |||
| TCDB = | |||
| OPM family = | |||
| OPM protein = | |||
| CAZy = | |||
| CDD = | |||
}} | |||
英:''Paired box'' genes | |||
英略:''Pax'' genes | |||
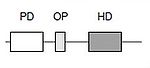
{{box|text= ''Pax''遺伝子群は動物の胎生期に、組織や器官の発生において中心的な役割を果たす遺伝子ファミリーである。脊椎動物ではPax1〜Pax9の9種類が同定されている。''Pax''遺伝子群はDNA結合ドメインであるペアードドメイン(PD)と呼ばれる領域を共通に持っている。またオクタペプチドモチーフ を持つものや、DNA結合ドメインであるホメオドメイン(HD)、もしくはホメオドメインの一部を持つものがある。このようなドメイン構造の差異から、 4つのサブファミリーに分類される。''Pax''遺伝子群はヒトやマウスに於いて、病気の原因遺伝子として同定されたものが多い。例えば、眼の発生のマスター制御遺伝子である/PAX6/は、無虹彩症の原因遺伝子である。Pax6はBAFやREST等、他の因子とともにクロマチンリモデリングにも関わることが最近知られるようになってきた。}} | |||
==構造== | |||
''[[PAX|Pax]]''遺伝子群は [[DNA]]結合ドメインであるペアードドメイン(PD)と呼ばれる領域を共通に持っている。また、''[[Pax]]''遺伝子にはオクタペプチドモチーフ(OP)を持つものや、DNA結合ドメインである[[ホメオドメイン]]、もしくはホメオドメインの一部を持つものがある。 | |||
==ファミリー== | |||
ドメイン構造の違いから、''Pax''遺伝子群は4つのサブファミリーに分類される。 | |||
{| cellspacing="1" cellpadding="1" border="1" | |||
|+'''表 ''Pax''遺伝子の構造と発現組織''' | |||
|- | |- | ||
| style="text-align:center" | Pax遺伝子 | | style="text-align:center" | Pax遺伝子 | ||
| 15行目: | 45行目: | ||
| style="text-align:center" | 発生期における発現組織/器官 | | style="text-align:center" | 発生期における発現組織/器官 | ||
|- | |- | ||
| Pax3<br>Pax7 | | [http://mouse.brain-map.org/experiment/show/2465 Pax3]<br>[http://mouse.brain-map.org/experiment/show/767 Pax7] | ||
| [[Image: | | [[Image:Pax表1.jpg|center|150px]] | ||
| | | [[中枢神経系]]、[[wj:頭蓋|頭蓋]]顔面の組織、[[神経堤]]細胞、[[wj:体節|体節]]/[[wj:骨格筋|骨格筋]]<br>中枢神経系、頭蓋顔面の組織、体節/骨格筋 | ||
|- | |- | ||
| Pax4<br>Pax6 | | [http://mouse.brain-map.org/experiment/show/69289667 Pax4]<br>[http://mouse.brain-map.org/experiment/show/79677341 Pax6] | ||
| | | [[Image:Pax表2.jpg|center|150px]] | ||
| | | [[wj:膵臓|膵臓]]、[[wj:腸|腸]]<br>中枢神経系、膵臓、腸、鼻、目 | ||
|- | |- | ||
| Pax2<br>Pax8<br>Pax5 | | [http://mouse.brain-map.org/experiment/show/69816667 Pax2]<br>[http://mouse.brain-map.org/experiment/show/74990504 Pax8]<br>[http://mouse.brain-map.org/experiment/show/69289677 Pax5] | ||
| | | [[Image:Pax表3.jpg|center|150px]] | ||
| | | 中枢神経系、[[wj:腎臓|腎臓]]、耳<br>中枢神経系、腎臓、[[wj:甲状腺|甲状腺]]<br>中枢神経系、腎臓、[[wj:Bリンパ球|Bリンパ球]] | ||
|- | |- | ||
| Pax1<br>Pax9 | | [http://mouse.brain-map.org/experiment/show/69289661 Pax1]<br>[http://mouse.brain-map.org/experiment/show/2467 Pax9] | ||
| | | [[Image:Pax表4.jpg|center|150px]] | ||
| | | 骨格、[[wj:胸腺|胸腺]]、[[wj:副甲状腺|副甲状腺]]<br>骨格、胸腺、頭蓋顔面の組織、歯 | ||
|} | |} | ||
PD: ペアードドメイン、OP: オクタペプチドモチーフ、HD: ホメオドメイン<br> | |||
遺伝子名は[http://www.brain-map.org Allen Brain Atlas]へリンクしている。 | |||
< | ==発現 == | ||
''Pax''遺伝子群の発現は、[[神経板]]の形成などの神経発生初期から始まる。[[胎生期]]だけではなく、生後および成体脳においても認められる<ref name=ref2 /><ref name=ref10 /><ref name=ref11 /><ref name=ref14><pubmed> 15951811 </pubmed></ref><ref name=ref15><pubmed> 10328940 </pubmed></ref><ref name=ref16><pubmed> 16035109 </pubmed></ref><ref name=ref17><pubmed> 12202033 </pubmed></ref><ref name=ref18><pubmed> 14651488 </pubmed></ref><ref name=ref19><pubmed> 17301672 </pubmed></ref><ref name=ref20><pubmed> 17091300 </pubmed></ref>。 | |||
特に[[PAX6|Pax6]]は、[[神経板期]](数体節期:[[マウス]]E8.5)に、前脳区画および[[前耳溝]]以後の[[菱脳]]・[[脊髄]]で発現が開始する。[[神経管]]閉鎖後、[[脳胞期]](約30体節期: マウスE10.5)には、[[終脳]]背側(将来の[[大脳皮質]]領域)、[[間脳]]背側(将来の腹側・背側[[視床]])、菱脳・[[脊髄]]の腹外側で発現する。生後も[[脳室層]]、[[扁桃体]]、視床、[[海馬]]、[[小脳]]、[[下垂体]]などで発現が見られる。[[wj:中枢神経系|中枢神経系]]以外では、[[wj:水晶体|水晶体]]、[[wj:角膜上皮|角膜上皮]]、[[網膜神経上皮]]、[[嗅上皮]]、[[wj: 膵臓|膵臓]]に発現している。 | |||
== | ==機能 == | ||
''Pax'' | ''Pax''遺伝子群は他の[[転写因子]]と協調し、[[wj: 神経系|神経系]]の発生初期では細胞の運命決定や脳の[[領域化]] <ref name=ref1><pubmed> 9230312 </pubmed></ref><ref name=ref2><pubmed> 9376315 </pubmed></ref><ref name=ref3><pubmed> 10804178 </pubmed></ref><ref name=ref4><pubmed> 9783474 </pubmed></ref><ref name=ref5><pubmed> 11003833 </pubmed></ref><ref name=ref6><pubmed> 8126546 </pubmed></ref>、発生後期では[[細胞増殖]]、[[細胞移動]]、[[細胞分化]]に関わっている<ref name=ref7><pubmed> 9409667 </pubmed></ref><ref name=ref8><pubmed> 18661555 </pubmed></ref><ref name=ref9><pubmed> 10946068 </pubmed></ref><ref name=ref10><pubmed> 16049175 </pubmed></ref><ref name=ref11><pubmed> 16164600 </pubmed></ref><ref name=ref12><pubmed> 11301001 </pubmed></ref><ref name=ref13><pubmed> 12618140 </pubmed></ref>。 | ||
== | ===脳の領域化、細胞の運命決定=== | ||
神経発生の初期では、[[シグナルセンター]]からの情報によって、[[前後軸]]、[[背腹軸]]が決定され、脳の領域化が起こる<ref name=ref21><pubmed> 8895453 </pubmed></ref><ref name=ref22><pubmed> 11746229 </pubmed></ref>。''Pax''遺伝子群はシグナルセンターから放出されるシグナル分子に反応し<ref name=ref1 /><ref name=ref23><pubmed> 8598907 </pubmed></ref><ref name=ref24><pubmed> 8929535 </pubmed></ref><ref name=ref25><pubmed> 18280463 </pubmed></ref><ref name=ref26><pubmed> 18429041 </pubmed></ref><ref name=ref27><pubmed> 8741855 </pubmed></ref><ref name=ref28><pubmed> 7553857 </pubmed></ref><ref name=ref29><pubmed> 8951076 </pubmed></ref>、脳の[[領域化]]や細胞の運命決定に寄与することがわかっている<ref name=ref2 /><ref name=ref4 /><ref name=ref7 /><ref name=ref30><pubmed> 10354469 </pubmed></ref><ref name=ref31><pubmed> 17173889 </pubmed></ref>。 | |||
== | [[Pax6]]は、菱脳・[[脊髄]]における[[運動ニューロン]]・[[介在ニューロン]][[分化]]に関して、[[classI ホメオドメインタンパク質]]と[[classII ホメオドメインタンパク質]]との間に正確な境界形成を行うことを通じて菱脳腹側の区画化を制御する<ref name=ref32><pubmed> 11880342 </pubmed></ref>。大脳では、Pax6の下流で働く遺伝子として同定された[[double-sex and mab-3 related transcription factor-like family A1|''double-sex'' and ''mab-3'' related transcription factor-like family A1]](''[[Dmrta1]]''; ''[[Dmrt4]]'')が、[[大脳皮質]]興奮性神経細胞の分化に関与することが分かった<ref name=ref33><pubmed> 23679989 </pubmed></ref>。その他Pax6には、[[前脳]]のコンパートメント形成、神経路形成([[後交連]]、tract of postoptic commissure (TPOC, 将来の視索のガイドとなる)、[[嗅索]]、[[視床皮質路]])、終脳背側ニューロン分化、小脳[[顆粒細胞]]の形成など多岐にわたる役割がある。 | ||
複雑な神経回路を構築する過程である神経発生において、細胞移動は時空間的に正確でなければならない。''Pax''遺伝子群はこの細胞移動に関しても重要な役割を果たす。例えば、Pax3は[[神経堤]]細胞の移動に関わっている<ref name= | |||
視蓋の領域化には[[PAX3|Pax3]]/Pax7が必須であり、ニワトリ胚を用いた実験によりPax3/Pax7が[[Meis homeobox 2]] ([[Meis2]]) を制御することが明らかになっている<ref name=ref34><pubmed> 19736326 </pubmed></ref><ref name=ref35><pubmed> 22390724 </pubmed></ref>。 | |||
=== 神経前駆細胞の増殖および維持=== | |||
[[脳の領域化]]の後、''Pax''遺伝子群は[[神経前駆細胞]]の増殖、維持および分化において重要な役割をはたすことがわかっている。例えば、Pax6は胎生期の脳<ref name=ref36><pubmed> 17329367 </pubmed></ref><ref name=ref37><pubmed> 11807037 </pubmed></ref><ref name=ref38><pubmed> 19521500 </pubmed></ref><ref name=ref39><pubmed> 19571125 </pubmed></ref>および成体脳<ref name=ref11 /><ref name=ref16 />において、その発現量依存的に[[神経前駆細胞]]の増殖、維持、さらには分化に関わっている。Pax6は胎生期の[[大脳皮質]]および[[脊髄]]において、神経細胞分化を担うプロニューラル遺伝子の[[Neurogenin2]] ([[Neurog2]]) の転写を活性化する<ref name=ref40><pubmed> 11502253 </pubmed></ref><ref name=ref41><pubmed> 12783797 </pubmed></ref>。一方で、Pax6は[[神経幹細胞]]マーカーとして知られている[[Fatty acid binding protein 7]] ([[FABP7|Fabp7]]; [[BLBP]]) の発現を誘導し、[[神経前駆細胞]]の増殖にも働くため<ref name=ref42><pubmed> 16237179 </pubmed></ref>、Pax6自身も神経幹細胞/前駆細胞のマーカーとして用いられることが多い。最近では、[[大脳皮質]]におけるPax6の下流遺伝子が網羅的に探索され、多数の遺伝子がPax6に制御を受けることで、[[神経前駆細胞]]の増殖および分化のバランスが保たれていることが明らかになった<ref name=ref43><pubmed> 19521500 </pubmed></ref>。また、Pax6は[[グリア細胞]]の一種である[[アストロサイト]]の増殖・分化にも関与している<ref name=ref44><pubmed> 18448636 </pubmed></ref>。 | |||
=== 細胞移動=== | |||
複雑な神経回路を構築する過程である神経発生において、細胞移動は時空間的に正確でなければならない。''Pax''遺伝子群はこの細胞移動に関しても重要な役割を果たす。例えば、Pax3は[[神経堤]]細胞の移動に関わっている<ref name=ref45><pubmed> 11231058 </pubmed></ref><ref name=ref46><pubmed> 18308300 </pubmed></ref>。Pax6は[[大脳皮質]] <ref name=ref13 /><ref name=ref47><pubmed> 14501209 </pubmed></ref>や[[小脳]] <ref name=ref48><pubmed> 12534968 </pubmed></ref>において細胞移動に関わっている。''Pax6''変異体の発生初期菱脳(後脳)を用いたゲノムワイド解析により、''Pax6''変異体において発現が変動する遺伝子のうち、細胞移動に関与する遺伝子が多数同定されている<ref name=ref49><pubmed> 20082710 </pubmed></ref>。 | |||
==疾患との関わり== | |||
''Pax''遺伝子群は[[ヒト]]やマウスに於いて、病気の原因遺伝子として同定されたものが多い。例えば、眼の発生のマスター制御遺伝子である''PAX6''は、[[無虹彩症]]の原因遺伝子である。[[自閉症]]患者の遺伝子解析から''PAX6''遺伝子に有為な[[一塩基変異多型]]([[SNP]])が同定されている<ref name=ref50><pubmed> 19607881 </pubmed></ref>。[[神経堤]]細胞の分化・移動に重要である''PAX3''は[[ワールデンブルグ症候群]]の責任遺伝子である<ref name=ref51><pubmed> 8490648 </pubmed></ref>。 | |||
==関連項目== | |||
*[[ホメオドメイン]] | |||
*[[転写制御因子]] | |||
*[[領域化]] | |||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
2021年7月21日 (水) 11:39時点における最新版
櫻井 勝康、吉川 貴子、大隅 典子
東北大学 大学院医学系研究科
DOI:10.14931/bsd.2703 原稿受付日:2012年10月31日 原稿完成日:2014年3月24日
担当編集委員:村上 富士夫(大阪大学 大学院生命機能研究科)
| Paired domain | |||||||||
|---|---|---|---|---|---|---|---|---|---|
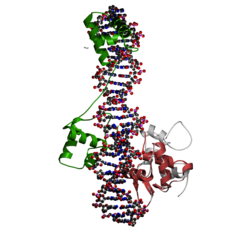 Inhibited fragment of ETS-1 (orange) and Paired domain of Pax5 (green) bound to DNA | |||||||||
| Identifiers | |||||||||
| Symbol | Pax | ||||||||
| Pfam | PF00292 | ||||||||
| Pfam clan | CL0123 | ||||||||
| PROSITE | PDOC00034 | ||||||||
| SCOP | 1pdn | ||||||||
| SUPERFAMILY | 1pdn | ||||||||
| |||||||||
英:Paired box genes
英略:Pax genes
Pax遺伝子群は動物の胎生期に、組織や器官の発生において中心的な役割を果たす遺伝子ファミリーである。脊椎動物ではPax1〜Pax9の9種類が同定されている。Pax遺伝子群はDNA結合ドメインであるペアードドメイン(PD)と呼ばれる領域を共通に持っている。またオクタペプチドモチーフ を持つものや、DNA結合ドメインであるホメオドメイン(HD)、もしくはホメオドメインの一部を持つものがある。このようなドメイン構造の差異から、 4つのサブファミリーに分類される。Pax遺伝子群はヒトやマウスに於いて、病気の原因遺伝子として同定されたものが多い。例えば、眼の発生のマスター制御遺伝子である/PAX6/は、無虹彩症の原因遺伝子である。Pax6はBAFやREST等、他の因子とともにクロマチンリモデリングにも関わることが最近知られるようになってきた。
構造
Pax遺伝子群は DNA結合ドメインであるペアードドメイン(PD)と呼ばれる領域を共通に持っている。また、Pax遺伝子にはオクタペプチドモチーフ(OP)を持つものや、DNA結合ドメインであるホメオドメイン、もしくはホメオドメインの一部を持つものがある。
ファミリー
ドメイン構造の違いから、Pax遺伝子群は4つのサブファミリーに分類される。
| Pax遺伝子 | 構造 | 発生期における発現組織/器官 |
| Pax3 Pax7 |
 |
中枢神経系、頭蓋顔面の組織、神経堤細胞、体節/骨格筋 中枢神経系、頭蓋顔面の組織、体節/骨格筋 |
| Pax4 Pax6 |
膵臓、腸 中枢神経系、膵臓、腸、鼻、目 | |
| Pax2 Pax8 Pax5 |
 |
中枢神経系、腎臓、耳 中枢神経系、腎臓、甲状腺 中枢神経系、腎臓、Bリンパ球 |
| Pax1 Pax9 |
骨格、胸腺、副甲状腺 骨格、胸腺、頭蓋顔面の組織、歯 |
PD: ペアードドメイン、OP: オクタペプチドモチーフ、HD: ホメオドメイン
遺伝子名はAllen Brain Atlasへリンクしている。
発現
Pax遺伝子群の発現は、神経板の形成などの神経発生初期から始まる。胎生期だけではなく、生後および成体脳においても認められる[1][2][3][4][5][6][7][8][9][10]。
特にPax6は、神経板期(数体節期:マウスE8.5)に、前脳区画および前耳溝以後の菱脳・脊髄で発現が開始する。神経管閉鎖後、脳胞期(約30体節期: マウスE10.5)には、終脳背側(将来の大脳皮質領域)、間脳背側(将来の腹側・背側視床)、菱脳・脊髄の腹外側で発現する。生後も脳室層、扁桃体、視床、海馬、小脳、下垂体などで発現が見られる。中枢神経系以外では、水晶体、角膜上皮、網膜神経上皮、嗅上皮、膵臓に発現している。
機能
Pax遺伝子群は他の転写因子と協調し、神経系の発生初期では細胞の運命決定や脳の領域化 [11][1][12][13][14][15]、発生後期では細胞増殖、細胞移動、細胞分化に関わっている[16][17][18][2][3][19][20]。
脳の領域化、細胞の運命決定
神経発生の初期では、シグナルセンターからの情報によって、前後軸、背腹軸が決定され、脳の領域化が起こる[21][22]。Pax遺伝子群はシグナルセンターから放出されるシグナル分子に反応し[11][23][24][25][26][27][28][29]、脳の領域化や細胞の運命決定に寄与することがわかっている[1][13][16][30][31]。
Pax6は、菱脳・脊髄における運動ニューロン・介在ニューロン分化に関して、classI ホメオドメインタンパク質とclassII ホメオドメインタンパク質との間に正確な境界形成を行うことを通じて菱脳腹側の区画化を制御する[32]。大脳では、Pax6の下流で働く遺伝子として同定されたdouble-sex and mab-3 related transcription factor-like family A1(Dmrta1; Dmrt4)が、大脳皮質興奮性神経細胞の分化に関与することが分かった[33]。その他Pax6には、前脳のコンパートメント形成、神経路形成(後交連、tract of postoptic commissure (TPOC, 将来の視索のガイドとなる)、嗅索、視床皮質路)、終脳背側ニューロン分化、小脳顆粒細胞の形成など多岐にわたる役割がある。
視蓋の領域化にはPax3/Pax7が必須であり、ニワトリ胚を用いた実験によりPax3/Pax7がMeis homeobox 2 (Meis2) を制御することが明らかになっている[34][35]。
神経前駆細胞の増殖および維持
脳の領域化の後、Pax遺伝子群は神経前駆細胞の増殖、維持および分化において重要な役割をはたすことがわかっている。例えば、Pax6は胎生期の脳[36][37][38][39]および成体脳[3][6]において、その発現量依存的に神経前駆細胞の増殖、維持、さらには分化に関わっている。Pax6は胎生期の大脳皮質および脊髄において、神経細胞分化を担うプロニューラル遺伝子のNeurogenin2 (Neurog2) の転写を活性化する[40][41]。一方で、Pax6は神経幹細胞マーカーとして知られているFatty acid binding protein 7 (Fabp7; BLBP) の発現を誘導し、神経前駆細胞の増殖にも働くため[42]、Pax6自身も神経幹細胞/前駆細胞のマーカーとして用いられることが多い。最近では、大脳皮質におけるPax6の下流遺伝子が網羅的に探索され、多数の遺伝子がPax6に制御を受けることで、神経前駆細胞の増殖および分化のバランスが保たれていることが明らかになった[43]。また、Pax6はグリア細胞の一種であるアストロサイトの増殖・分化にも関与している[44]。
細胞移動
複雑な神経回路を構築する過程である神経発生において、細胞移動は時空間的に正確でなければならない。Pax遺伝子群はこの細胞移動に関しても重要な役割を果たす。例えば、Pax3は神経堤細胞の移動に関わっている[45][46]。Pax6は大脳皮質 [20][47]や小脳 [48]において細胞移動に関わっている。Pax6変異体の発生初期菱脳(後脳)を用いたゲノムワイド解析により、Pax6変異体において発現が変動する遺伝子のうち、細胞移動に関与する遺伝子が多数同定されている[49]。
疾患との関わり
Pax遺伝子群はヒトやマウスに於いて、病気の原因遺伝子として同定されたものが多い。例えば、眼の発生のマスター制御遺伝子であるPAX6は、無虹彩症の原因遺伝子である。自閉症患者の遺伝子解析からPAX6遺伝子に有為な一塩基変異多型(SNP)が同定されている[50]。神経堤細胞の分化・移動に重要であるPAX3はワールデンブルグ症候群の責任遺伝子である[51]。
関連項目
参考文献
- ↑ 1.0 1.1 1.2
Kawakami, A., Kimura-Kawakami, M., Nomura, T., & Fujisawa, H. (1997).
Distributions of PAX6 and PAX7 proteins suggest their involvement in both early and late phases of chick brain development. Mechanisms of development, 66(1-2), 119-30. [PubMed:9376315] [WorldCat] [DOI] - ↑ 2.0 2.1
Kohwi, M., Osumi, N., Rubenstein, J.L., & Alvarez-Buylla, A. (2005).
Pax6 is required for making specific subpopulations of granule and periglomerular neurons in the olfactory bulb. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(30), 6997-7003. [PubMed:16049175] [PMC] [WorldCat] [DOI] - ↑ 3.0 3.1 3.2
Maekawa, M., Takashima, N., Arai, Y., Nomura, T., Inokuchi, K., Yuasa, S., & Osumi, N. (2005).
Pax6 is required for production and maintenance of progenitor cells in postnatal hippocampal neurogenesis. Genes to cells : devoted to molecular & cellular mechanisms, 10(10), 1001-14. [PubMed:16164600] [WorldCat] [DOI] - ↑
Hack, M.A., Saghatelyan, A., de Chevigny, A., Pfeifer, A., Ashery-Padan, R., Lledo, P.M., & Götz, M. (2005).
Neuronal fate determinants of adult olfactory bulb neurogenesis. Nature neuroscience, 8(7), 865-72. [PubMed:15951811] [WorldCat] [DOI] - ↑
Kukekov, V.G., Laywell, E.D., Suslov, O., Davies, K., Scheffler, B., Thomas, L.B., ..., & Steindler, D.A. (1999).
Multipotent stem/progenitor cells with similar properties arise from two neurogenic regions of adult human brain. Experimental neurology, 156(2), 333-44. [PubMed:10328940] [WorldCat] [DOI] - ↑ 6.0 6.1
Nacher, J., Varea, E., Blasco-Ibañez, J.M., Castillo-Gomez, E., Crespo, C., Martinez-Guijarro, F.J., & McEwen, B.S. (2005).
Expression of the transcription factor Pax 6 in the adult rat dentate gyrus. Journal of neuroscience research, 81(6), 753-61. [PubMed:16035109] [WorldCat] [DOI] - ↑
Nakatomi, H., Kuriu, T., Okabe, S., Yamamoto, S., Hatano, O., Kawahara, N., ..., & Nakafuku, M. (2002).
Regeneration of hippocampal pyramidal neurons after ischemic brain injury by recruitment of endogenous neural progenitors. Cell, 110(4), 429-41. [PubMed:12202033] [WorldCat] [DOI] - ↑
Shin, D.H., Lee, K.S., Lee, E., Chang, Y.P., Kim, J.W., Choi, Y.S., ..., & Cho, S.S. (2003).
Pax-7 immunoreactivity in the post-natal chicken central nervous system. Anatomia, histologia, embryologia, 32(6), 378-83. [PubMed:14651488] [WorldCat] - ↑
Thomas, M.G., Barker, R.A., Beazley, L.D., & Ziman, M.R. (2007).
Pax7 expression in the adult rat superior colliculus following optic nerve injury. Neuroreport, 18(2), 105-9. [PubMed:17301672] [WorldCat] [DOI] - ↑
Thompson, J.A., Lovicu, F.J., & Ziman, M. (2007).
Pax7 and superior collicular polarity: insights from Pax6 (Sey) mutant mice. Experimental brain research, 178(3), 316-25. [PubMed:17091300] [WorldCat] [DOI] - ↑ 11.0 11.1
Ericson, J., Rashbass, P., Schedl, A., Brenner-Morton, S., Kawakami, A., van Heyningen, V., ..., & Briscoe, J. (1997).
Pax6 controls progenitor cell identity and neuronal fate in response to graded Shh signaling. Cell, 90(1), 169-80. [PubMed:9230312] [WorldCat] [DOI] - ↑
Matsunaga, E., Araki, I., & Nakamura, H. (2000).
Pax6 defines the di-mesencephalic boundary by repressing En1 and Pax2. Development (Cambridge, England), 127(11), 2357-65. [PubMed:10804178] [WorldCat] - ↑ 13.0 13.1
Nomura, T., Kawakami, A., & Fujisawa, H. (1998).
Correlation between tectum formation and expression of two PAX family genes, PAX7 and PAX6, in avian brains. Development, growth & differentiation, 40(5), 485-95. [PubMed:9783474] [WorldCat] - ↑
Schwarz, M., Cecconi, F., Bernier, G., Andrejewski, N., Kammandel, B., Wagner, M., & Gruss, P. (2000).
Spatial specification of mammalian eye territories by reciprocal transcriptional repression of Pax2 and Pax6. Development (Cambridge, England), 127(20), 4325-34. [PubMed:11003833] [WorldCat] - ↑
Stoykova, A., & Gruss, P. (1994).
Roles of Pax-genes in developing and adult brain as suggested by expression patterns. The Journal of neuroscience : the official journal of the Society for Neuroscience, 14(3 Pt 2), 1395-412. [PubMed:8126546] [WorldCat] - ↑ 16.0 16.1
Burrill, J.D., Moran, L., Goulding, M.D., & Saueressig, H. (1997).
PAX2 is expressed in multiple spinal cord interneurons, including a population of EN1+ interneurons that require PAX6 for their development. Development (Cambridge, England), 124(22), 4493-503. [PubMed:9409667] [WorldCat] - ↑
Chan-Ling, T., Chu, Y., Baxter, L., Weible Ii, M., & Hughes, S. (2009).
In vivo characterization of astrocyte precursor cells (APCs) and astrocytes in developing rat retinae: differentiation, proliferation, and apoptosis. Glia, 57(1), 39-53. [PubMed:18661555] [WorldCat] [DOI] - ↑
Conway, S.J., Bundy, J., Chen, J., Dickman, E., Rogers, R., & Will, B.M. (2000).
Decreased neural crest stem cell expansion is responsible for the conotruncal heart defects within the splotch (Sp(2H))/Pax3 mouse mutant. Cardiovascular research, 47(2), 314-28. [PubMed:10946068] [WorldCat] [DOI] - ↑
Marquardt, T., Ashery-Padan, R., Andrejewski, N., Scardigli, R., Guillemot, F., & Gruss, P. (2001).
Pax6 is required for the multipotent state of retinal progenitor cells. Cell, 105(1), 43-55. [PubMed:11301001] [WorldCat] [DOI] - ↑ 20.0 20.1
Talamillo, A., Quinn, J.C., Collinson, J.M., Caric, D., Price, D.J., West, J.D., & Hill, R.E. (2003).
Pax6 regulates regional development and neuronal migration in the cerebral cortex. Developmental biology, 255(1), 151-63. [PubMed:12618140] [WorldCat] [DOI] - ↑
Lumsden, A., & Krumlauf, R. (1996).
Patterning the vertebrate neuraxis. Science (New York, N.Y.), 274(5290), 1109-15. [PubMed:8895453] [WorldCat] [DOI] - ↑
Redies, C., & Puelles, L. (2001).
Modularity in vertebrate brain development and evolution. BioEssays : news and reviews in molecular, cellular and developmental biology, 23(12), 1100-11. [PubMed:11746229] [WorldCat] [DOI] - ↑
Crossley, P.H., Martinez, S., & Martin, G.R. (1996).
Midbrain development induced by FGF8 in the chick embryo. Nature, 380(6569), 66-8. [PubMed:8598907] [WorldCat] [DOI] - ↑
Ericson, J., Morton, S., Kawakami, A., Roelink, H., & Jessell, T.M. (1996).
Two critical periods of Sonic Hedgehog signaling required for the specification of motor neuron identity. Cell, 87(4), 661-73. [PubMed:8929535] [WorldCat] [DOI] - ↑
Fedtsova, N., Quina, L.A., Wang, S., & Turner, E.E. (2008).
Regulation of the development of tectal neurons and their projections by transcription factors Brn3a and Pax7. Developmental biology, 316(1), 6-20. [PubMed:18280463] [PMC] [WorldCat] [DOI] - ↑
Fogel, J.L., Chiang, C., Huang, X., & Agarwala, S. (2008).
Ventral specification and perturbed boundary formation in the mouse midbrain in the absence of Hedgehog signaling. Developmental dynamics : an official publication of the American Association of Anatomists, 237(5), 1359-72. [PubMed:18429041] [PMC] [WorldCat] [DOI] - ↑
Joyner, A.L. (1996).
Engrailed, Wnt and Pax genes regulate midbrain--hindbrain development. Trends in genetics : TIG, 12(1), 15-20. [PubMed:8741855] [WorldCat] [DOI] - ↑
Liem, K.F., Tremml, G., Roelink, H., & Jessell, T.M. (1995).
Dorsal differentiation of neural plate cells induced by BMP-mediated signals from epidermal ectoderm. Cell, 82(6), 969-79. [PubMed:7553857] [WorldCat] [DOI] - ↑
Monsoro-Burq, A.H., Duprez, D., Watanabe, Y., Bontoux, M., Vincent, C., Brickell, P., & Le Douarin, N. (1996).
The role of bone morphogenetic proteins in vertebral development. Development (Cambridge, England), 122(11), 3607-16. [PubMed:8951076] [WorldCat] - ↑
Schwarz, M., Alvarez-Bolado, G., Dressler, G., Urbánek, P., Busslinger, M., & Gruss, P. (1999).
Pax2/5 and Pax6 subdivide the early neural tube into three domains. Mechanisms of development, 82(1-2), 29-39. [PubMed:10354469] [WorldCat] [DOI] - ↑
Soukkarieh, C., Agius, E., Soula, C., & Cochard, P. (2007).
Pax2 regulates neuronal-glial cell fate choice in the embryonic optic nerve. Developmental biology, 303(2), 800-13. [PubMed:17173889] [WorldCat] [DOI] - ↑
Takahashi, M., & Osumi, N. (2002).
Pax6 regulates specification of ventral neurone subtypes in the hindbrain by establishing progenitor domains. Development (Cambridge, England), 129(6), 1327-38. [PubMed:11880342] [WorldCat] - ↑
Kikkawa, T., Obayashi, T., Takahashi, M., Fukuzaki-Dohi, U., Numayama-Tsuruta, K., & Osumi, N. (2013).
Dmrta1 regulates proneural gene expression downstream of Pax6 in the mammalian telencephalon. Genes to cells : devoted to molecular & cellular mechanisms, 18(8), 636-49. [PubMed:23679989] [WorldCat] [DOI] - ↑
Agoston, Z., & Schulte, D. (2009).
Meis2 competes with the Groucho co-repressor Tle4 for binding to Otx2 and specifies tectal fate without induction of a secondary midbrain-hindbrain boundary organizer. Development (Cambridge, England), 136(19), 3311-22. [PubMed:19736326] [WorldCat] [DOI] - ↑
Agoston, Z., Li, N., Haslinger, A., Wizenmann, A., & Schulte, D. (2012).
Genetic and physical interaction of Meis2, Pax3 and Pax7 during dorsal midbrain development. BMC developmental biology, 12, 10. [PubMed:22390724] [PMC] [WorldCat] [DOI] - ↑
Berger, J., Berger, S., Tuoc, T.C., D'Amelio, M., Cecconi, F., Gorski, J.A., ..., & Stoykova, A. (2007).
Conditional activation of Pax6 in the developing cortex of transgenic mice causes progenitor apoptosis. Development (Cambridge, England), 134(7), 1311-22. [PubMed:17329367] [WorldCat] [DOI] - ↑
Estivill-Torrus, G., Pearson, H., van Heyningen, V., Price, D.J., & Rashbass, P. (2002).
Pax6 is required to regulate the cell cycle and the rate of progression from symmetrical to asymmetrical division in mammalian cortical progenitors. Development (Cambridge, England), 129(2), 455-66. [PubMed:11807037] [WorldCat] - ↑
Sansom, S.N., Griffiths, D.S., Faedo, A., Kleinjan, D.J., Ruan, Y., Smith, J., ..., & Livesey, F.J. (2009).
The level of the transcription factor Pax6 is essential for controlling the balance between neural stem cell self-renewal and neurogenesis. PLoS genetics, 5(6), e1000511. [PubMed:19521500] [PMC] [WorldCat] [DOI] - ↑
Tuoc, T.C., Radyushkin, K., Tonchev, A.B., Piñon, M.C., Ashery-Padan, R., Molnár, Z., ..., & Stoykova, A. (2009).
Selective cortical layering abnormalities and behavioral deficits in cortex-specific Pax6 knock-out mice. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(26), 8335-49. [PubMed:19571125] [PMC] [WorldCat] [DOI] - ↑
Scardigli, R., Schuurmans, C., Gradwohl, G., & Guillemot, F. (2001).
Crossregulation between Neurogenin2 and pathways specifying neuronal identity in the spinal cord. Neuron, 31(2), 203-17. [PubMed:11502253] [WorldCat] [DOI] - ↑
Scardigli, R., Bäumer, N., Gruss, P., Guillemot, F., & Le Roux, I. (2003).
Direct and concentration-dependent regulation of the proneural gene Neurogenin2 by Pax6. Development (Cambridge, England), 130(14), 3269-81. [PubMed:12783797] [WorldCat] [DOI] - ↑
Arai, Y., Funatsu, N., Numayama-Tsuruta, K., Nomura, T., Nakamura, S., & Osumi, N. (2005).
Role of Fabp7, a downstream gene of Pax6, in the maintenance of neuroepithelial cells during early embryonic development of the rat cortex. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(42), 9752-61. [PubMed:16237179] [PMC] [WorldCat] [DOI] - ↑
Sansom, S.N., Griffiths, D.S., Faedo, A., Kleinjan, D.J., Ruan, Y., Smith, J., ..., & Livesey, F.J. (2009).
The level of the transcription factor Pax6 is essential for controlling the balance between neural stem cell self-renewal and neurogenesis. PLoS genetics, 5(6), e1000511. [PubMed:19521500] [PMC] [WorldCat] [DOI] - ↑
Sakurai, K., & Osumi, N. (2008).
The neurogenesis-controlling factor, Pax6, inhibits proliferation and promotes maturation in murine astrocytes. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(18), 4604-12. [PubMed:18448636] [PMC] [WorldCat] [DOI] - ↑
Hornyak, T.J., Hayes, D.J., Chiu, L.Y., & Ziff, E.B. (2001).
Transcription factors in melanocyte development: distinct roles for Pax-3 and Mitf. Mechanisms of development, 101(1-2), 47-59. [PubMed:11231058] [WorldCat] [DOI] - ↑
Nakazaki, H., Reddy, A.C., Mania-Farnell, B.L., Shen, Y.W., Ichi, S., McCabe, C., ..., & Mayanil, C.S. (2008).
Key basic helix-loop-helix transcription factor genes Hes1 and Ngn2 are regulated by Pax3 during mouse embryonic development. Developmental biology, 316(2), 510-23. [PubMed:18308300] [WorldCat] [DOI] - ↑
Jiménez, D., López-Mascaraque, L., de Carlos, J.A., & Valverde, F. (2003).
Further studies on cortical tangential migration in wild type and Pax-6 mutant mice. Journal of neurocytology, 31(8-9), 719-28. [PubMed:14501209] [WorldCat] [DOI] - ↑
Horie, M., Sango, K., Takeuchi, K., Honma, S., Osumi, N., Kawamura, K., & Kawano, H. (2003).
Subpial neuronal migration in the medulla oblongata of Pax-6-deficient rats. The European journal of neuroscience, 17(1), 49-57. [PubMed:12534968] [WorldCat] [DOI] - ↑
Numayama-Tsuruta, K., Arai, Y., Takahashi, M., Sasaki-Hoshino, M., Funatsu, N., Nakamura, S., & Osumi, N. (2010).
Downstream genes of Pax6 revealed by comprehensive transcriptome profiling in the developing rat hindbrain. BMC developmental biology, 10, 6. [PubMed:20082710] [PMC] [WorldCat] [DOI] - ↑
Maekawa, M., Iwayama, Y., Nakamura, K., Sato, M., Toyota, T., Ohnishi, T., ..., & Yoshikawa, T. (2009).
A novel missense mutation (Leu46Val) of PAX6 found in an autistic patient. Neuroscience letters, 462(3), 267-71. [PubMed:19607881] [WorldCat] [DOI] - ↑
Tassabehji, M., Read, A.P., Newton, V.E., Patton, M., Gruss, P., Harris, R., & Strachan, T. (1993).
Mutations in the PAX3 gene causing Waardenburg syndrome type 1 and type 2. Nature genetics, 3(1), 26-30. [PubMed:8490648] [WorldCat] [DOI]