「オリゴデンドロサイト前駆細胞」の版間の差分
細編集の要約なし |
細 →細胞表面分子 |
||
| (同じ利用者による、間の3版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/katsuhikoono 小野 勝彦]</font><br> | <font size="+1">[http://researchmap.jp/katsuhikoono 小野 勝彦]</font><br> | ||
''京都府立医科大学''<br> | ''京都府立医科大学''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2012年3月30日 原稿完成日:2012年5月6日<br> | ||
担当編集委員:[http://researchmap.jp/fujiomurakami 村上 富士夫](大阪大学 大学院生命機能研究科)<br> | 担当編集委員:[http://researchmap.jp/fujiomurakami 村上 富士夫](大阪大学 大学院生命機能研究科)<br> | ||
</div> | </div> | ||
| 8行目: | 8行目: | ||
英語名:oligodendrocyte precursor cell 英略称:OPC、OLP 独:Vorläuferzellen der Oligodendrozyten 仏:précurseur de oligodendrocyte | 英語名:oligodendrocyte precursor cell 英略称:OPC、OLP 独:Vorläuferzellen der Oligodendrozyten 仏:précurseur de oligodendrocyte | ||
{{box|text= | {{box|text= | ||
[[中枢神経系]]で[[ミエリン]]を形成する細胞が[[オリゴデンドロサイト]]である。そのオリゴデンドロサイトとなるよう運命づけられた細胞で、なんらオリゴデンドロサイトの形態的・分子的特徴を持たないものをオリゴデンドロサイト前駆細胞と呼ぶ。移動能と増殖活性は高い。 | |||
}} | |||
== | ==その発見の歴史 == | ||
[[image:オリゴデンドロサイト前駆細胞.png|thumb|400px|''' | [[image:オリゴデンドロサイト前駆細胞.png|thumb|400px|'''図 マウス脊髄におけるOPCの出現'''<br>転写因子Olig1のmRMAの発現を指標としたもの。胎齢12.5日目に脊髄腹側部の脳室層に最初の陽性細胞が出現する。スケールは200μm。]] | ||
=== O-2A前駆細胞 === | === O-2A前駆細胞 === | ||
[[ラット]]胎児[[視神経]]を培養すると[[ | [[wikipedia:JA:ラット|ラット]]胎児[[視神経]]を培養すると[[wikipedia:JA:モノクローナル抗体|モノクローナル抗体]]A2B5に陽性を示す細胞がみられ、この細胞は培養液に[[wikipedia:JA:ウシ胎児血清|ウシ胎児血清]]を[[wikipedia:JA:培養液|培養液]]に加えるとGFAP+/A2B5+[[アストロサイト]]に[[細胞分化|分化]]し、[[wikipedia:Chemically defined medium|無血清培地]]で培養するとミエリン脂質である[[ガラクトセレブロシド]](galactocerebroside; GalC)陽性オリゴデンドロサイトに分化する。A2B5抗体は、[[wikipedia:JA:ガングリオシド|ガングリオシド]]や[[wikipedia:Sulfatide|スルファチド]]などの糖脂質を抗原とし、当初はニューロン特異的抗体として報告されたが、視神経にはニューロンやその前駆細胞は存在しないことから、A2B5陽性[[グリア前駆細胞]]が見いだされた。視神経細胞の培養中にはA2B5-/ GFAP+アストロサイトも存在することから、A2B5に陽性を示すアストログリアをtype 2アストロサイト、A2B5陰性のものをtype 1アストログリアと命名した。そして、A2B5陽性でGFAPにもGalCにも陽性を示さない段階のものを、O2A前駆細胞と呼んだ<ref name=ref1><pubmed>6304520</pubmed></ref>。培養系では、type 2アストロサイトはオリゴデンドロサイトの増殖が終了した後に増殖することが一つの特徴である。しかし、生体内ではこのような増殖パターンを示すアストロサイトはみられないことから、その存在は否定的である<ref name=ref2><pubmed>2328833</pubmed></ref>。 | ||
=== O-2A前駆細胞の単離方法 === | === O-2A前駆細胞の単離方法 === | ||
O2A前駆細胞は、新生児ラットの視神経や[[大脳皮質]]をフラスコで2週間程度培養し、その後フラスコを激しく水平方面に激しく1晩振盪(200rpm以上)することにより浮遊してくる。Type 1アストロサイトやニューロンは、この条件では浮遊しない。この浮遊細胞を集め、ミクログリアを何もコートしていないプラスチックペトリ皿に付着させることで除いて[[継代培養]]すると、O-2A細胞が80~90%程度含まれるenriched cultureとなる。A2B5抗体を培養基質に塗布して、これに接着する細胞を集めることにより95%以上の純度でO-2A細胞を集めることができる<ref name=ref3>'''Bottenstein JE and Hunter SF''' <br>''Culture method for oligodendrocyte cell line and oligodendrocyte-type2 astrocyte lineage cells.''<br>In Cell culture, Conn PM ed, pp. 56-75, Methods in Neurosciences Vol. 2, Academic Press Inc., San Diego.(1990)</ref><ref name=ref4><pubmed>12379434</pubmed></ref>。培養条件により、アストログリア、またはオリゴデンドロサイトに分化させるようコントロールできることから、細胞分化調節機構解析のモデル細胞として扱われてきた。しかし、[[wikipedia:JA:マウス|マウス]]胎仔および新生仔の脳の培養細胞では、同じような手順で行ってもO-2A細胞のenriched cultureは難しい。 | |||
=== | === OPCとしてのO-2A前駆細胞 === | ||
生体内でのO-2A細胞に相当する細胞については、様々な議論があったが、移植実験により一応の決着がついた。O-2A細胞を蛍光色素で標識し、新生児ラットの脳内に移植するとほとんどの細胞がオリゴデンドロサイトに分化した。このことから、O-2A細胞はアストロサイトへの分化能をもってはいるものの、生体内の環境ではオリゴデンドロサイトに分化する細胞であることから、オリゴデンドロサイト前駆細胞と見なされるようになった<ref name=ref5><pubmed>8419944</pubmed></ref>。 | 生体内でのO-2A細胞に相当する細胞については、様々な議論があったが、移植実験により一応の決着がついた。O-2A細胞を蛍光色素で標識し、新生児ラットの脳内に移植するとほとんどの細胞がオリゴデンドロサイトに分化した。このことから、O-2A細胞はアストロサイトへの分化能をもってはいるものの、生体内の環境ではオリゴデンドロサイトに分化する細胞であることから、オリゴデンドロサイト前駆細胞と見なされるようになった<ref name=ref5><pubmed>8419944</pubmed></ref>。 | ||
| 28行目: | 30行目: | ||
===細胞系譜とPDGFα受容体(PDGFRα) === | ===細胞系譜とPDGFα受容体(PDGFRα) === | ||
培養下でのO-2A細胞は、type 1-アストロサイトの培養上清により増殖が高まることが示され、この中に含まれるO-2A細胞に対する増殖因子が[[血小板由来成長因子]](platelet derived growth factor; PDGF)であることが明らかにされた<ref name=ref6><pubmed>2834067</pubmed></ref>。そして、O-2A前駆細胞がその[[受容体]]としてαサブユニット([[血小板由来成長因子受容体|PDGFR]]α)を発現していることも明らかにされた<ref name=ref7><pubmed>2558873</pubmed></ref>。これをもとに、発生段階の神経組織内でPDGFRαを発現している細胞の探索が行われた。その結果、[[脊髄]]では、ラットでは胎齢14.5日目(E14.5)、マウスではE12.5日目、ニワトリ胚ではHHstage32(孵卵7日目)の[[脳室層]]腹側部に限局して、PDGFRα陽性細胞が出現することから、これが脊髄のオリゴデンドロサイト前駆細胞の起源であると考えられるようになった<ref name=ref8><pubmed>8330523</pubmed></ref>。その後、PDGFRα陽性細胞を単離して培養を行ったり<ref name=ref9><pubmed>9012528</pubmed></ref>、PDGF欠損マウスや過剰発現させた[[トランスジェニックマウス]] | 培養下でのO-2A細胞は、type 1-アストロサイトの培養上清により増殖が高まることが示され、この中に含まれるO-2A細胞に対する増殖因子が[[血小板由来成長因子]](platelet derived growth factor; PDGF)であることが明らかにされた<ref name=ref6><pubmed>2834067</pubmed></ref>。そして、O-2A前駆細胞がその[[受容体]]としてαサブユニット([[血小板由来成長因子受容体|PDGFR]]α)を発現していることも明らかにされた<ref name=ref7><pubmed>2558873</pubmed></ref>。これをもとに、発生段階の神経組織内でPDGFRαを発現している細胞の探索が行われた。その結果、[[脊髄]]では、ラットでは胎齢14.5日目(E14.5)、マウスではE12.5日目、ニワトリ胚ではHHstage32(孵卵7日目)の[[脳室層]]腹側部に限局して、PDGFRα陽性細胞が出現することから、これが脊髄のオリゴデンドロサイト前駆細胞の起源であると考えられるようになった<ref name=ref8><pubmed>8330523</pubmed></ref>。その後、PDGFRα陽性細胞を単離して培養を行ったり<ref name=ref9><pubmed>9012528</pubmed></ref>、PDGF欠損マウスや過剰発現させた[[wikipedia:JA:トランスジェニックマウス|トランスジェニックマウス]]でのOPCの発生を解析したりすること<ref name=ref10><pubmed>9620692</pubmed></ref><ref name=ref11><pubmed>9876175</pubmed></ref>により、PDGFRα陽性細胞がOPCであることが明らかにされた。このような早い時期の脳室層で、特定の細胞サブセットを特異的に標識することができた最初の例であり、その後の[[神経管]]の背腹軸ドメイン形成の顕幽へと発展していくことになる<ref name=ref12><pubmed>10625331</pubmed></ref>。さらにPDGFRαを指標として、同じような発現パターンを示す分子が報告されそれらの多くがOPCのマーカーであることが明らかにされた。 | ||
=== 細胞系譜マーカーと系譜解析 === | === 細胞系譜マーカーと系譜解析 === | ||
上述のPDGFRαやニワトリ胚ではO4がOPCの系譜マーカーであることが明らかにされ、発現パターンの類似性や遺伝子欠損マウスの解析などからさらに[[細胞系譜]]マーカーが見いだされた。 | |||
==== 転写因子 ==== | ==== 転写因子 ==== | ||
[[転写因子]]の[[Olig2]]は、[[Olig1]]とともに、[[ソニックヘッジホッグ]] | [[転写因子]]の[[Olig2]]は、[[Olig1]]とともに、[[ソニックヘッジホッグ]](Shh)に誘導されるオリゴデンドロサイト系譜に特異的な転写因子として報告された<ref name=ref13><pubmed>10719888</pubmed></ref><ref name=ref14><pubmed>11091082</pubmed></ref><ref name=ref15><pubmed>10719889</pubmed></ref>。Olig2とOlig1はともにPDGFRαと同様に、[[脊髄]]腹側部から出現し次第に脊髄背側部に広がるが、発現そのものはOPCの出現以前からみられる。 | ||
[[Nkx2.2]]は、マウスではOlig2より腹側部で発現し、ニワトリ胚ではOlig2と一部重なり、O4陽性細胞で発現がみられる<ref name=ref16><pubmed>11526078</pubmed></ref>。またマウスでも発生の後期になるとOlig2とNkx2.2は同一の細胞で発現するようになる。Nkx2.2はミエリン[[プロテオリピドタンパク質]](PLP)の[[プロモーター]]に結合してその発現を調節する。 | [[Nkx2.2]]は、マウスではOlig2より腹側部で発現し、ニワトリ胚ではOlig2と一部重なり、O4陽性細胞で発現がみられる<ref name=ref16><pubmed>11526078</pubmed></ref>。またマウスでも発生の後期になるとOlig2とNkx2.2は同一の細胞で発現するようになる。Nkx2.2はミエリン[[プロテオリピドタンパク質]](PLP)の[[プロモーター]]に結合してその発現を調節する。 | ||
[[Sox10]] | [[Sox10]]はOlig2と同様の領域から発現が始まるが、Olig2よりも遅くに脊髄脳室層腹側部から発現が始まり、Olig2よりOPCの系譜に特異的であると考えられている<ref name=ref17><pubmed>11799060</pubmed></ref>。 | ||
==== 細胞表面分子 ==== | ==== 細胞表面分子 ==== | ||
PDGFRαは上述の通り、最初にOPCの系譜マーカーとして見出されたものである。NG2は、[[コンドロイチン硫酸プロテオグリカン]](cspg4)を抗原とする抗体を用いて標識される細胞である。NG2抗体は、培養系ではO-2A前駆細胞を標識し、生体内でもPDGFRα陽性細胞を標識することから、OPCで発現していることが明らかにされた<ref name=ref18><pubmed>8714519</pubmed></ref><ref name=ref19><pubmed>3305800</pubmed></ref>。NG2は、OPCのみならず周皮細胞でも発現している。OPCでのNG2の発言を調節するエンハンサーがイントロン内に含まれることが明らかにされ、周皮細胞とは異なった発現調節を受けていることが示された<ref name=Gotoh2018><pubmed> 30306660 </pubmed></ref>。 | |||
==== 糖脂質 ==== | ==== 糖脂質 ==== | ||
牛の[[脳梁]]を抗原として作製されたモノクローナル抗体O4とO1は、しばしばオリゴデンドロサイト系譜細胞の解析に用いられている。このうちO1は、ガラクトセレブロシドと[[モノガラクトシルジグリセリド]]を認識し、分化したオリゴデンドロサイトのマーカーとして用いられている<ref name=ref20><pubmed>6786942</pubmed></ref>。O4はスルファチド、[[セミノリピド]]、[[ステロイド#.E3.82.B3.E3.83.AC.E3.82.B9.E3.83.86.E3.83.AD.E3.83.BC.E3.83.AB|コレステロール]] | 牛の[[脳梁]]を抗原として作製されたモノクローナル抗体O4とO1は、しばしばオリゴデンドロサイト系譜細胞の解析に用いられている。このうちO1は、ガラクトセレブロシドと[[モノガラクトシルジグリセリド]]を認識し、分化したオリゴデンドロサイトのマーカーとして用いられている<ref name=ref20><pubmed>6786942</pubmed></ref>。O4はスルファチド、[[セミノリピド]]、[[ステロイド#.E3.82.B3.E3.83.AC.E3.82.B9.E3.83.86.E3.83.AD.E3.83.BC.E3.83.AB|コレステロール]]が抗原として同定されており、これらは比較的分化の進んだオリゴデンドロサイトで発現している。一方。O4はOPCもしくはこれよりやや分化の進んだpro-oligodendroblastも認識するが、OPCで発現しているO4に認識される脂質は同定されていない<ref name=ref21><pubmed>1573402</pubmed></ref>。 | ||
最近では、これらのマーカー分子を用いたgenetic fate mappingにより、それぞれの細胞系譜が詳細に明らかにされるようになってきた。すなわち、系譜マーカーを発現する細胞に[[Creリコンビナーゼ]]を発現させたマウスを作製し、これをレポーターマウスと交配することにより、生体内で細胞系譜を追跡できるようになった。Sox10-Creマウス、PDGFRα-Creマウス、Olig2-CreER マウス、NG2-CreERT2マウスなどが主に使われている。 | 最近では、これらのマーカー分子を用いたgenetic fate mappingにより、それぞれの細胞系譜が詳細に明らかにされるようになってきた。すなわち、系譜マーカーを発現する細胞に[[Creリコンビナーゼ]]を発現させたマウスを作製し、これをレポーターマウスと交配することにより、生体内で細胞系譜を追跡できるようになった。Sox10-Creマウス、PDGFRα-Creマウス、Olig2-CreER マウス、NG2-CreERT2マウスなどが主に使われている。 | ||
| 54行目: | 56行目: | ||
==発生・分化様式とその調節機構 == | ==発生・分化様式とその調節機構 == | ||
=== | === 未分化な神経上皮細胞からOPCへの分化とShh, FGF2 === | ||
OPCは脊髄では、培養実験<ref name=ref22><pubmed>1869925</pubmed></ref>やPDGFRαやモノクローナル抗体O4をマーカーとした形態学的な解析<ref name=ref23><pubmed>7600990</pubmed></ref><ref name=ref8><pubmed>8330523</pubmed></ref>から、その腹側部に由来することが示されていた。Shhが[[脊索]]や[[底板]]で発現するmorphogenとして見出され、これが[[運動ニューロン]]の[[分化誘導因子]]であることが明らかにされた。これらの成果をもとに、ニワトリ胚の神経管背側部近傍への脊索移植実験が行われ、運動ニューロンと同じようにOPCも異所性の脊索により誘導されることが示され、さらに培養実験を用いて、OPCもShhにより誘導されることが明らかにされた<ref name=ref24><pubmed>8660875</pubmed></ref><ref name=ref25><pubmed>10226001</pubmed></ref><ref name=ref26><pubmed>7473887</pubmed></ref>。 | |||
脊髄腹側部でOPCの分化誘導が起きている時期には、脊髄背側部からはOPC分化抑制因子が発現しており、これが[[Wnt]]と[[BMP4]]であることが実験的に示されている。これらの発現が終了する脊髄の発生後期になると、脊髄背側部からのOPCが出現することが、Shh欠損マウスやNkx6欠損マウスを用いて示された。これらは、Shh非依存性で[[線維芽細胞成長因子]](FGF)2依存的に誘導される<ref name=ref27><pubmed>14660548</pubmed></ref>。 | |||
===移動と軸索ガイダンス分子 === | ===移動と軸索ガイダンス分子 === | ||
OPCが移動することは、ミエリン欠損マウスへの胎仔脳組織の移植で最初に示された。ミエリン欠損マウスに胎児脳組織を大脳皮質に移植すると、脳内の[[脳幹]]を含む広い領域でミエリン形成がみられるようになることから、移植組織に由来する細胞が活発に移動することが明らかにされた<ref name=ref28><pubmed>6085571</pubmed></ref>。また、視神経のOPCが前脳から移動してきた「移民細胞(immigrant cells)」であることは、培養実験で最初に示唆されていた<ref name=ref29><pubmed>3600791</pubmed></ref>。さらに、[[wikipedia:JA:ニワトリ|ニワトリ]]胚の第3脳室に[[wikipedia:JA:蛍光|蛍光]]色素[[DiI]]を注入して脳室層細胞を標識すると、これを取り込んだ細胞が視神経に出現しO4に陽性を示すことから、生体内でも「移民細胞」であることが明らかとなった<ref name=ref30><pubmed>9292719</pubmed></ref>。最近になって、[[wikipedia:JA:レトロウイルス|レトロウイルス]]ベクターを用いたクローン解析でも、ニワトリ胚では前脳に由来する細胞が視神経に入ることが示されている<ref name=ref31><pubmed>20371817</pubmed></ref>。また、PLP-GFPトランスジェニックマウス、[[wikipedia:JA:ゼブラフィッシュ|ゼブラフィッシュ]]を用いて、脊髄でのOPCの移動がリアルタイムで可視化されている<ref name=ref32><pubmed>17099706</pubmed></ref><ref name=ref33><pubmed>11826117</pubmed></ref>。 | |||
OPCの移動は、[[軸索ガイダンス]]分子によって制御されている。これは、視神経の組織片培養でOPCが[[Netrin-1]]や[[Sema3A]]に反発するように移動し、またOPCのサブセットにそれぞれの受容体である[[UNC5a]]や[[neuropilin-1]]の発現がみられることから明らかにされた<ref name=ref34><pubmed>11546748</pubmed></ref>。これをもとに、netrin-1を欠損させたPLP-GFPトランスジェニックマウスを解析し''in vivo''でもnetrin-1によるOPCの移動制御が明らかにされた<ref name=ref35><pubmed>12668624</pubmed></ref>。 | |||
===増殖 === | ===増殖 === | ||
PDGF-Aは、培養系のみならず''in vivo'' | PDGF-Aは、培養系のみならず''in vivo''でもOPCに対して強力な増殖因子として働く。これを欠損するマウスではOPCの数が非常に少なくなり、成熟したオリゴデンドロサイトわずかしか見られない<ref name=ref11><pubmed>9876175</pubmed></ref>。逆に、PDGF-Aを過剰発現させたマウスでは、胎生期のOPCの数が5倍になる。しかし、新生児期に過剰なOPCはアポトーシスにより脱落し、野生型と同程度のオリゴデンドロサイトがみられるようになる<ref name=ref10><pubmed>9620692</pubmed></ref>。 | ||
一方、OPCの増殖を停止させる細胞内因子として[[p27]]/Kip1が報告されている。p27/Kip1を欠損するマウスから単離されたOPCはオリゴデンドロサイトに分化するものの、増殖が持続する。レトロウイルスベクターを用いてOPCにp27/Kip1を過剰発現させると[[wikipedia:JA:細胞周期#G1.E6.9C.9F|G1期]]と[[wikipedia:JA:細胞周期#S.E6.9C.9F|S期]]の間で[[wikipedia:JA:細胞周期|細胞周期]]がとどまり、オリゴデンドロサイトに分化できなくなることが報告されている<ref name=ref36><pubmed>9029151</pubmed></ref><ref name=ref37><pubmed>9733077</pubmed></ref>。 | |||
===オリゴデンドロサイトへの分化とその調節機構 === | ===オリゴデンドロサイトへの分化とその調節機構 === | ||
オリゴデンドロサイトの最終分化やミエリン形成は一般的に、神経回路形成が終わった後に始まる。この発生の最終段階には、神経活動が大きな影響を与えている。[[後根神経節]]のニューロンをモデルとした実験では、ニューロンの活動により軸索から[[ | オリゴデンドロサイトの最終分化やミエリン形成は一般的に、神経回路形成が終わった後に始まる。この発生の最終段階には、神経活動が大きな影響を与えている。[[後根神経節]]のニューロンをモデルとした実験では、ニューロンの活動により軸索から[[wikipedia:JA:アデノシン三リン酸|ATP]]が分泌され、これがアストロサイトに作用する。ATPで刺激を受けたアストロサイトから[[leukemia inhibitory factor]](LIF)が分泌され、これがOPCを刺激して成熟オリゴデンドロサイトとなりミエリン形成が始まる<ref name=ref38><pubmed>16543131</pubmed></ref>。また、軸索からはその活動依存的に[[グルタミン酸]]も放出される。オリゴデンドロサイトの[[細胞膜]]の局所に作用し、[[チロシンリン酸化#.E9.9D.9E.E5.8F.97.E5.AE.B9.E4.BD.93.E5.9E.8B.E3.83.81.E3.83.AD.E3.82.B7.E3.83.B3.E3.82.AD.E3.83.8A.E3.83.BC.E3.82.BC|Fyn]]依存性に[[ミエリン塩基性タンパク質]]の[[wikipedia:JA:翻訳_(生物学)|翻訳]]を上昇させ、ミエリン形成を促進する<ref name=ref39><pubmed>21817014</pubmed></ref>。 | ||
細胞内因子として注目されている分子として[[MAPキナーゼ]]の一つである[[extracellular-signal regulated kinase]] | 細胞内因子として注目されている分子として[[MAPキナーゼ]]の一つである[[extracellular-signal regulated kinase]](ERK)がある。脊髄背側部のOPCはFGFにより分化することから<ref name=ref27><pubmed>14660548</pubmed></ref>、[[受容体型チロシンキナーゼ]]の下流分子として注目されている面もある。このうちERK2を神経幹細胞特異的に欠損させると、OPCの増殖や生存には影響がない一方でGalC陽性オリゴデンドロサイトの出現が遅れることから、オリゴデンドロサイトの最終分化のタイミングを調節していると考えられている<ref name=ref40><pubmed>21248107</pubmed></ref>。 | ||
== 脳の各領域におけるOPCの出現様式 == | |||
上記と重複するが、脳の各領域におけるOPCの起源と移動についてまとめる | |||
=== 脊髄 === | === 脊髄 === | ||
ラット胎仔ではE14.5から、マウスではE12. | ラット胎仔ではE14.5から、マウスではE12.5からPDGFRα陽性細胞が、脊髄脳室層の腹側部に出現するようになり、これが脊髄における初期のOPCの出現と考えられている。ニワトリ胚ではHHstage29~32にPDGFRα陽性細胞およびO4陽性細胞が出現する。脳室層のこのような領域は、体性運動ニューロンを生み出したのちにオリゴデンドロサイトを生み出すことから、pMNドメインとかpMNOLドメインと呼ばれている[12]。また、少し遅れて脊髄背側部の脳室層からもOPCが生み出されることも明らかにされている。脊髄全体では、腹側部(pMNOL)に由来するオリゴデンドロサイトは80%前後で、背側部に由来するものは20%程度であることが示されている<ref name=ref41><pubmed>21543611</pubmed></ref>。脊髄背側部脳室層からのオリゴデンドロサイト前駆細胞の出現については、長い間激しい議論が続いたが<ref name=ref42><pubmed>8845154</pubmed></ref><ref name=ref43><pubmed>9620693</pubmed></ref>、脊髄腹側部の形成不全マウス<ref name=ref44><pubmed>15629701</pubmed></ref><ref name=ref45><pubmed>15629702</pubmed></ref>やCre/loxPを使ったgenetic fate mapping<ref name=ref41><pubmed>21543611</pubmed></ref>により決着がついた。 | ||
=== 小脳を含む後脳 === | === 小脳を含む後脳 === | ||
| 89行目: | 94行目: | ||
=== 視神経 === | === 視神経 === | ||
O-2A前駆細胞は、新生児ラットの培養視神経細胞から見出されたものである。上述の通り、視神経のO- | O-2A前駆細胞は、新生児ラットの培養視神経細胞から見出されたものである。上述の通り、視神経のO-2A細胞もしくはOPCは当初から前脳からの移民細胞であると予想されており、ニワトリではその起源や移動様式が明らかにされている。[[wikipedia:ja:齧歯類|齧歯類]]の視神経におけるPDGFRαをマーカーとした解析では、これを発現する細胞が出生直後に(P0からP2にかけて)視神経の[[視交叉]]側から[[網膜]]側に向かって急速に分布が拡がる。これは、OPCの移動を反映しているものと考えられている<ref name=ref49><pubmed>1425339</pubmed></ref>。しかし、マウスやラットの視神経でgenetic fate mappingなどを用いたOPCの移動や系譜解析は、前脳や脊髄に比較して少なく、直接的に示した報告はほとんどないのが現状である。 | ||
=== 終脳 === | === 終脳 === | ||
終脳のオリゴデンドロサイトは、ニワトリ-[[ウズラ]][[ | 終脳のオリゴデンドロサイトは、ニワトリ-[[wikipedia:JA:ウズラ|ウズラ]][[wikipedia:JA:キメラ|キメラ]]の解析から、[[anterior entopeduncular area]] (AEP)に由来することが示唆されていた<ref name=ref50><pubmed>11311157</pubmed></ref>。一方、Cre/loxPシステムを用いたマウスの解析では、胎生期ではAEPを含むNkx2.1発現領域([[内側線条体原基]]、medial ganglionic eminence)、次いでGsh2陽性領域(ganglionic eminence; GE)からOPCが生み出され、これが正接方向に移動して大脳皮質に入る。一方で、新生児期になると大脳皮質からもオリゴデンドロサイト前駆細胞が生み出され、腹側部から移動していたものと置き換わり<ref name=ref51><pubmed>16388308</pubmed></ref>、大脳皮質の[[灰白質]]のオリゴでンドロサイトに分化する。GEに由来するオリゴデンドロサイトは、[[終脳]]腹側部と脳梁に残る<ref name=ref41><pubmed>21543611</pubmed></ref>。 | ||
=== 成体脳におけるオリゴデンドロサイト前駆細胞 === | === 成体脳におけるオリゴデンドロサイト前駆細胞 === | ||
上述のPDGFRαやNG2を発現する細胞は成体脳でもみられ、グリア細胞の数%をしめている<ref name=ref52><pubmed>10964946</pubmed></ref> | 上述のPDGFRαやNG2を発現する細胞は成体脳でもみられ、グリア細胞の数%をしめている<ref name=ref52><pubmed>10964946</pubmed></ref>。NG2細胞は、多くの突起を伸ばして複雑な形態をしている。しかし、GFAPなどのアストログリアのマーカーを発現しておらず、また成熟したオリゴデンドロサイトが発現するミエリンタンパクやミエリン脂質も発現していない。このようなことからNG2細胞は、第四のグリア細胞と見なされるようになってきた。成体脳でのOPCは胎生期のそれらと同じ細胞系譜にあり、前駆細胞としてそのまま維持されている物と考えられる<ref name=ref53><pubmed>18582453</pubmed></ref>。 | ||
[[バクテリア人工染色体]](bacterial artificial chromosome, BAC)を用いたトランスジェニックマウスや[[タモキシフェン]]誘導型Cre/ | [[wikipedia:JA:bacterial artificial chromosome|バクテリア人工染色体]](bacterial artificial chromosome, BAC)を用いたトランスジェニックマウスや[[タモキシフェン]]誘導型Cre/loxPを用いた系譜解析から、新生児期以降のNG2陽性細胞はオリゴデンドロサイトに分化することが明らかにされ、NG2細胞が成体脳でのOPCであることが明らかにされた<ref name=ref54><pubmed>18045844</pubmed></ref><ref name=ref55><pubmed>21266410</pubmed></ref>。NG2細胞は、脳のほとんどすべての領域でニューロンの[[軸索終末]]により[[シナプス]]が一過性に形成されており、またグルタミン酸や[[GABA]]に対する受容体も発現してその働きにより[[膜電位]]が変化する。このシナプスは、オリゴデンドロサイトへの分化とともに消失する。OPCの分化はグルタミン酸により抑制されることが報告されており、NG2細胞へのシナプスは前駆細胞プールの維持に働いていると考えられている<ref name=ref56><pubmed>21395579</pubmed></ref>。 | ||
2021年10月7日 (木) 08:50時点における版
英語名:oligodendrocyte precursor cell 英略称:OPC、OLP 独:Vorläuferzellen der Oligodendrozyten 仏:précurseur de oligodendrocyte
中枢神経系でミエリンを形成する細胞がオリゴデンドロサイトである。そのオリゴデンドロサイトとなるよう運命づけられた細胞で、なんらオリゴデンドロサイトの形態的・分子的特徴を持たないものをオリゴデンドロサイト前駆細胞と呼ぶ。移動能と増殖活性は高い。
その発見の歴史
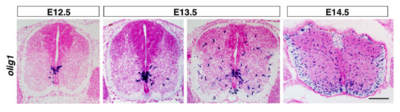
転写因子Olig1のmRMAの発現を指標としたもの。胎齢12.5日目に脊髄腹側部の脳室層に最初の陽性細胞が出現する。スケールは200μm。
O-2A前駆細胞
ラット胎児視神経を培養するとモノクローナル抗体A2B5に陽性を示す細胞がみられ、この細胞は培養液にウシ胎児血清を培養液に加えるとGFAP+/A2B5+アストロサイトに分化し、無血清培地で培養するとミエリン脂質であるガラクトセレブロシド(galactocerebroside; GalC)陽性オリゴデンドロサイトに分化する。A2B5抗体は、ガングリオシドやスルファチドなどの糖脂質を抗原とし、当初はニューロン特異的抗体として報告されたが、視神経にはニューロンやその前駆細胞は存在しないことから、A2B5陽性グリア前駆細胞が見いだされた。視神経細胞の培養中にはA2B5-/ GFAP+アストロサイトも存在することから、A2B5に陽性を示すアストログリアをtype 2アストロサイト、A2B5陰性のものをtype 1アストログリアと命名した。そして、A2B5陽性でGFAPにもGalCにも陽性を示さない段階のものを、O2A前駆細胞と呼んだ[1]。培養系では、type 2アストロサイトはオリゴデンドロサイトの増殖が終了した後に増殖することが一つの特徴である。しかし、生体内ではこのような増殖パターンを示すアストロサイトはみられないことから、その存在は否定的である[2]。
O-2A前駆細胞の単離方法
O2A前駆細胞は、新生児ラットの視神経や大脳皮質をフラスコで2週間程度培養し、その後フラスコを激しく水平方面に激しく1晩振盪(200rpm以上)することにより浮遊してくる。Type 1アストロサイトやニューロンは、この条件では浮遊しない。この浮遊細胞を集め、ミクログリアを何もコートしていないプラスチックペトリ皿に付着させることで除いて継代培養すると、O-2A細胞が80~90%程度含まれるenriched cultureとなる。A2B5抗体を培養基質に塗布して、これに接着する細胞を集めることにより95%以上の純度でO-2A細胞を集めることができる[3][4]。培養条件により、アストログリア、またはオリゴデンドロサイトに分化させるようコントロールできることから、細胞分化調節機構解析のモデル細胞として扱われてきた。しかし、マウス胎仔および新生仔の脳の培養細胞では、同じような手順で行ってもO-2A細胞のenriched cultureは難しい。
OPCとしてのO-2A前駆細胞
生体内でのO-2A細胞に相当する細胞については、様々な議論があったが、移植実験により一応の決着がついた。O-2A細胞を蛍光色素で標識し、新生児ラットの脳内に移植するとほとんどの細胞がオリゴデンドロサイトに分化した。このことから、O-2A細胞はアストロサイトへの分化能をもってはいるものの、生体内の環境ではオリゴデンドロサイトに分化する細胞であることから、オリゴデンドロサイト前駆細胞と見なされるようになった[5]。
細胞系譜とPDGFα受容体(PDGFRα)
培養下でのO-2A細胞は、type 1-アストロサイトの培養上清により増殖が高まることが示され、この中に含まれるO-2A細胞に対する増殖因子が血小板由来成長因子(platelet derived growth factor; PDGF)であることが明らかにされた[6]。そして、O-2A前駆細胞がその受容体としてαサブユニット(PDGFRα)を発現していることも明らかにされた[7]。これをもとに、発生段階の神経組織内でPDGFRαを発現している細胞の探索が行われた。その結果、脊髄では、ラットでは胎齢14.5日目(E14.5)、マウスではE12.5日目、ニワトリ胚ではHHstage32(孵卵7日目)の脳室層腹側部に限局して、PDGFRα陽性細胞が出現することから、これが脊髄のオリゴデンドロサイト前駆細胞の起源であると考えられるようになった[8]。その後、PDGFRα陽性細胞を単離して培養を行ったり[9]、PDGF欠損マウスや過剰発現させたトランスジェニックマウスでのOPCの発生を解析したりすること[10][11]により、PDGFRα陽性細胞がOPCであることが明らかにされた。このような早い時期の脳室層で、特定の細胞サブセットを特異的に標識することができた最初の例であり、その後の神経管の背腹軸ドメイン形成の顕幽へと発展していくことになる[12]。さらにPDGFRαを指標として、同じような発現パターンを示す分子が報告されそれらの多くがOPCのマーカーであることが明らかにされた。
細胞系譜マーカーと系譜解析
上述のPDGFRαやニワトリ胚ではO4がOPCの系譜マーカーであることが明らかにされ、発現パターンの類似性や遺伝子欠損マウスの解析などからさらに細胞系譜マーカーが見いだされた。
転写因子
転写因子のOlig2は、Olig1とともに、ソニックヘッジホッグ(Shh)に誘導されるオリゴデンドロサイト系譜に特異的な転写因子として報告された[13][14][15]。Olig2とOlig1はともにPDGFRαと同様に、脊髄腹側部から出現し次第に脊髄背側部に広がるが、発現そのものはOPCの出現以前からみられる。
Nkx2.2は、マウスではOlig2より腹側部で発現し、ニワトリ胚ではOlig2と一部重なり、O4陽性細胞で発現がみられる[16]。またマウスでも発生の後期になるとOlig2とNkx2.2は同一の細胞で発現するようになる。Nkx2.2はミエリンプロテオリピドタンパク質(PLP)のプロモーターに結合してその発現を調節する。
Sox10はOlig2と同様の領域から発現が始まるが、Olig2よりも遅くに脊髄脳室層腹側部から発現が始まり、Olig2よりOPCの系譜に特異的であると考えられている[17]。
細胞表面分子
PDGFRαは上述の通り、最初にOPCの系譜マーカーとして見出されたものである。NG2は、コンドロイチン硫酸プロテオグリカン(cspg4)を抗原とする抗体を用いて標識される細胞である。NG2抗体は、培養系ではO-2A前駆細胞を標識し、生体内でもPDGFRα陽性細胞を標識することから、OPCで発現していることが明らかにされた[18][19]。NG2は、OPCのみならず周皮細胞でも発現している。OPCでのNG2の発言を調節するエンハンサーがイントロン内に含まれることが明らかにされ、周皮細胞とは異なった発現調節を受けていることが示された[20]。
糖脂質
牛の脳梁を抗原として作製されたモノクローナル抗体O4とO1は、しばしばオリゴデンドロサイト系譜細胞の解析に用いられている。このうちO1は、ガラクトセレブロシドとモノガラクトシルジグリセリドを認識し、分化したオリゴデンドロサイトのマーカーとして用いられている[21]。O4はスルファチド、セミノリピド、コレステロールが抗原として同定されており、これらは比較的分化の進んだオリゴデンドロサイトで発現している。一方。O4はOPCもしくはこれよりやや分化の進んだpro-oligodendroblastも認識するが、OPCで発現しているO4に認識される脂質は同定されていない[22]。
最近では、これらのマーカー分子を用いたgenetic fate mappingにより、それぞれの細胞系譜が詳細に明らかにされるようになってきた。すなわち、系譜マーカーを発現する細胞にCreリコンビナーゼを発現させたマウスを作製し、これをレポーターマウスと交配することにより、生体内で細胞系譜を追跡できるようになった。Sox10-Creマウス、PDGFRα-Creマウス、Olig2-CreER マウス、NG2-CreERT2マウスなどが主に使われている。
発生・分化様式とその調節機構
未分化な神経上皮細胞からOPCへの分化とShh, FGF2
OPCは脊髄では、培養実験[23]やPDGFRαやモノクローナル抗体O4をマーカーとした形態学的な解析[24][8]から、その腹側部に由来することが示されていた。Shhが脊索や底板で発現するmorphogenとして見出され、これが運動ニューロンの分化誘導因子であることが明らかにされた。これらの成果をもとに、ニワトリ胚の神経管背側部近傍への脊索移植実験が行われ、運動ニューロンと同じようにOPCも異所性の脊索により誘導されることが示され、さらに培養実験を用いて、OPCもShhにより誘導されることが明らかにされた[25][26][27]。
脊髄腹側部でOPCの分化誘導が起きている時期には、脊髄背側部からはOPC分化抑制因子が発現しており、これがWntとBMP4であることが実験的に示されている。これらの発現が終了する脊髄の発生後期になると、脊髄背側部からのOPCが出現することが、Shh欠損マウスやNkx6欠損マウスを用いて示された。これらは、Shh非依存性で線維芽細胞成長因子(FGF)2依存的に誘導される[28]。
移動と軸索ガイダンス分子
OPCが移動することは、ミエリン欠損マウスへの胎仔脳組織の移植で最初に示された。ミエリン欠損マウスに胎児脳組織を大脳皮質に移植すると、脳内の脳幹を含む広い領域でミエリン形成がみられるようになることから、移植組織に由来する細胞が活発に移動することが明らかにされた[29]。また、視神経のOPCが前脳から移動してきた「移民細胞(immigrant cells)」であることは、培養実験で最初に示唆されていた[30]。さらに、ニワトリ胚の第3脳室に蛍光色素DiIを注入して脳室層細胞を標識すると、これを取り込んだ細胞が視神経に出現しO4に陽性を示すことから、生体内でも「移民細胞」であることが明らかとなった[31]。最近になって、レトロウイルスベクターを用いたクローン解析でも、ニワトリ胚では前脳に由来する細胞が視神経に入ることが示されている[32]。また、PLP-GFPトランスジェニックマウス、ゼブラフィッシュを用いて、脊髄でのOPCの移動がリアルタイムで可視化されている[33][34]。
OPCの移動は、軸索ガイダンス分子によって制御されている。これは、視神経の組織片培養でOPCがNetrin-1やSema3Aに反発するように移動し、またOPCのサブセットにそれぞれの受容体であるUNC5aやneuropilin-1の発現がみられることから明らかにされた[35]。これをもとに、netrin-1を欠損させたPLP-GFPトランスジェニックマウスを解析しin vivoでもnetrin-1によるOPCの移動制御が明らかにされた[36]。
増殖
PDGF-Aは、培養系のみならずin vivoでもOPCに対して強力な増殖因子として働く。これを欠損するマウスではOPCの数が非常に少なくなり、成熟したオリゴデンドロサイトわずかしか見られない[11]。逆に、PDGF-Aを過剰発現させたマウスでは、胎生期のOPCの数が5倍になる。しかし、新生児期に過剰なOPCはアポトーシスにより脱落し、野生型と同程度のオリゴデンドロサイトがみられるようになる[10]。
一方、OPCの増殖を停止させる細胞内因子としてp27/Kip1が報告されている。p27/Kip1を欠損するマウスから単離されたOPCはオリゴデンドロサイトに分化するものの、増殖が持続する。レトロウイルスベクターを用いてOPCにp27/Kip1を過剰発現させるとG1期とS期の間で細胞周期がとどまり、オリゴデンドロサイトに分化できなくなることが報告されている[37][38]。
オリゴデンドロサイトへの分化とその調節機構
オリゴデンドロサイトの最終分化やミエリン形成は一般的に、神経回路形成が終わった後に始まる。この発生の最終段階には、神経活動が大きな影響を与えている。後根神経節のニューロンをモデルとした実験では、ニューロンの活動により軸索からATPが分泌され、これがアストロサイトに作用する。ATPで刺激を受けたアストロサイトからleukemia inhibitory factor(LIF)が分泌され、これがOPCを刺激して成熟オリゴデンドロサイトとなりミエリン形成が始まる[39]。また、軸索からはその活動依存的にグルタミン酸も放出される。オリゴデンドロサイトの細胞膜の局所に作用し、Fyn依存性にミエリン塩基性タンパク質の翻訳を上昇させ、ミエリン形成を促進する[40]。
細胞内因子として注目されている分子としてMAPキナーゼの一つであるextracellular-signal regulated kinase(ERK)がある。脊髄背側部のOPCはFGFにより分化することから[28]、受容体型チロシンキナーゼの下流分子として注目されている面もある。このうちERK2を神経幹細胞特異的に欠損させると、OPCの増殖や生存には影響がない一方でGalC陽性オリゴデンドロサイトの出現が遅れることから、オリゴデンドロサイトの最終分化のタイミングを調節していると考えられている[41]。
脳の各領域におけるOPCの出現様式
上記と重複するが、脳の各領域におけるOPCの起源と移動についてまとめる
脊髄
ラット胎仔ではE14.5から、マウスではE12.5からPDGFRα陽性細胞が、脊髄脳室層の腹側部に出現するようになり、これが脊髄における初期のOPCの出現と考えられている。ニワトリ胚ではHHstage29~32にPDGFRα陽性細胞およびO4陽性細胞が出現する。脳室層のこのような領域は、体性運動ニューロンを生み出したのちにオリゴデンドロサイトを生み出すことから、pMNドメインとかpMNOLドメインと呼ばれている[12]。また、少し遅れて脊髄背側部の脳室層からもOPCが生み出されることも明らかにされている。脊髄全体では、腹側部(pMNOL)に由来するオリゴデンドロサイトは80%前後で、背側部に由来するものは20%程度であることが示されている[42]。脊髄背側部脳室層からのオリゴデンドロサイト前駆細胞の出現については、長い間激しい議論が続いたが[43][44]、脊髄腹側部の形成不全マウス[45][46]やCre/loxPを使ったgenetic fate mapping[42]により決着がついた。
小脳を含む後脳
小脳のオリゴデンドロサイトは、小脳の脳室層[47]、後脳腹側部[48]に由来するものと、脳の領域境界を越えて中脳から小脳に入ってくるもの[49]とが報告されている。これらはいずれもニワトリ胚を用いた実験で示されている。
視神経
O-2A前駆細胞は、新生児ラットの培養視神経細胞から見出されたものである。上述の通り、視神経のO-2A細胞もしくはOPCは当初から前脳からの移民細胞であると予想されており、ニワトリではその起源や移動様式が明らかにされている。齧歯類の視神経におけるPDGFRαをマーカーとした解析では、これを発現する細胞が出生直後に(P0からP2にかけて)視神経の視交叉側から網膜側に向かって急速に分布が拡がる。これは、OPCの移動を反映しているものと考えられている[50]。しかし、マウスやラットの視神経でgenetic fate mappingなどを用いたOPCの移動や系譜解析は、前脳や脊髄に比較して少なく、直接的に示した報告はほとんどないのが現状である。
終脳
終脳のオリゴデンドロサイトは、ニワトリ-ウズラキメラの解析から、anterior entopeduncular area (AEP)に由来することが示唆されていた[51]。一方、Cre/loxPシステムを用いたマウスの解析では、胎生期ではAEPを含むNkx2.1発現領域(内側線条体原基、medial ganglionic eminence)、次いでGsh2陽性領域(ganglionic eminence; GE)からOPCが生み出され、これが正接方向に移動して大脳皮質に入る。一方で、新生児期になると大脳皮質からもオリゴデンドロサイト前駆細胞が生み出され、腹側部から移動していたものと置き換わり[52]、大脳皮質の灰白質のオリゴでンドロサイトに分化する。GEに由来するオリゴデンドロサイトは、終脳腹側部と脳梁に残る[42]。
成体脳におけるオリゴデンドロサイト前駆細胞
上述のPDGFRαやNG2を発現する細胞は成体脳でもみられ、グリア細胞の数%をしめている[53]。NG2細胞は、多くの突起を伸ばして複雑な形態をしている。しかし、GFAPなどのアストログリアのマーカーを発現しておらず、また成熟したオリゴデンドロサイトが発現するミエリンタンパクやミエリン脂質も発現していない。このようなことからNG2細胞は、第四のグリア細胞と見なされるようになってきた。成体脳でのOPCは胎生期のそれらと同じ細胞系譜にあり、前駆細胞としてそのまま維持されている物と考えられる[54]。
バクテリア人工染色体(bacterial artificial chromosome, BAC)を用いたトランスジェニックマウスやタモキシフェン誘導型Cre/loxPを用いた系譜解析から、新生児期以降のNG2陽性細胞はオリゴデンドロサイトに分化することが明らかにされ、NG2細胞が成体脳でのOPCであることが明らかにされた[55][56]。NG2細胞は、脳のほとんどすべての領域でニューロンの軸索終末によりシナプスが一過性に形成されており、またグルタミン酸やGABAに対する受容体も発現してその働きにより膜電位が変化する。このシナプスは、オリゴデンドロサイトへの分化とともに消失する。OPCの分化はグルタミン酸により抑制されることが報告されており、NG2細胞へのシナプスは前駆細胞プールの維持に働いていると考えられている[57]。
関連項目
参考文献
- ↑
Raff, M.C., Miller, R.H., & Noble, M. (1983).
A glial progenitor cell that develops in vitro into an astrocyte or an oligodendrocyte depending on culture medium. Nature, 303(5916), 390-6. [PubMed:6304520] [WorldCat] [DOI] - ↑
Skoff, R.P. (1990).
Gliogenesis in rat optic nerve: astrocytes are generated in a single wave before oligodendrocytes. Developmental biology, 139(1), 149-68. [PubMed:2328833] [WorldCat] [DOI] - ↑ Bottenstein JE and Hunter SF
Culture method for oligodendrocyte cell line and oligodendrocyte-type2 astrocyte lineage cells.
In Cell culture, Conn PM ed, pp. 56-75, Methods in Neurosciences Vol. 2, Academic Press Inc., San Diego.(1990) - ↑
Itoh, K. (2002).
Culture of oligodendrocyte precursor cells (NG2(+)/O1(-)) and oligodendrocytes (NG2(-)/O1(+)) from embryonic rat cerebrum. Brain research. Brain research protocols, 10(1), 23-30. [PubMed:12379434] [WorldCat] - ↑
Espinosa de los Monteros, A., Zhang, M., & De Vellis, J. (1993).
O2A progenitor cells transplanted into the neonatal rat brain develop into oligodendrocytes but not astrocytes. Proceedings of the National Academy of Sciences of the United States of America, 90(1), 50-4. [PubMed:8419944] [PMC] [WorldCat] [DOI] - ↑
Richardson, W.D., Pringle, N., Mosley, M.J., Westermark, B., & Dubois-Dalcq, M. (1988).
A role for platelet-derived growth factor in normal gliogenesis in the central nervous system. Cell, 53(2), 309-19. [PubMed:2834067] [WorldCat] [DOI] - ↑
Hart, I.K., Richardson, W.D., Heldin, C.H., Westermark, B., & Raff, M.C. (1989).
PDGF receptors on cells of the oligodendrocyte-type-2 astrocyte (O-2A) cell lineage. Development (Cambridge, England), 105(3), 595-603. [PubMed:2558873] [WorldCat] - ↑ 8.0 8.1
Pringle, N.P., & Richardson, W.D. (1993).
A singularity of PDGF alpha-receptor expression in the dorsoventral axis of the neural tube may define the origin of the oligodendrocyte lineage. Development (Cambridge, England), 117(2), 525-33. [PubMed:8330523] [WorldCat] - ↑
Hall, A., Giese, N.A., & Richardson, W.D. (1996).
Spinal cord oligodendrocytes develop from ventrally derived progenitor cells that express PDGF alpha-receptors. Development (Cambridge, England), 122(12), 4085-94. [PubMed:9012528] [WorldCat] - ↑ 10.0 10.1
Calver, A.R., Hall, A.C., Yu, W.P., Walsh, F.S., Heath, J.K., Betsholtz, C., & Richardson, W.D. (1998).
Oligodendrocyte population dynamics and the role of PDGF in vivo. Neuron, 20(5), 869-82. [PubMed:9620692] [WorldCat] [DOI] - ↑ 11.0 11.1
Fruttiger, M., Karlsson, L., Hall, A.C., Abramsson, A., Calver, A.R., Boström, H., ..., & Richardson, W.D. (1999).
Defective oligodendrocyte development and severe hypomyelination in PDGF-A knockout mice. Development (Cambridge, England), 126(3), 457-67. [PubMed:9876175] [WorldCat] - ↑
Richardson, W.D., Smith, H.K., Sun, T., Pringle, N.P., Hall, A., & Woodruff, R. (2000).
Oligodendrocyte lineage and the motor neuron connection. Glia, 29(2), 136-42. [PubMed:10625331] [WorldCat] - ↑
Lu, Q.R., Yuk, D., Alberta, J.A., Zhu, Z., Pawlitzky, I., Chan, J., ..., & Rowitch, D.H. (2000).
Sonic hedgehog--regulated oligodendrocyte lineage genes encoding bHLH proteins in the mammalian central nervous system. Neuron, 25(2), 317-29. [PubMed:10719888] [WorldCat] [DOI] - ↑
Takebayashi, H., Yoshida, S., Sugimori, M., Kosako, H., Kominami, R., Nakafuku, M., & Nabeshima, Y. (2000).
Dynamic expression of basic helix-loop-helix Olig family members: implication of Olig2 in neuron and oligodendrocyte differentiation and identification of a new member, Olig3. Mechanisms of development, 99(1-2), 143-8. [PubMed:11091082] [WorldCat] [DOI] - ↑
Zhou, Q., Wang, S., & Anderson, D.J. (2000).
Identification of a novel family of oligodendrocyte lineage-specific basic helix-loop-helix transcription factors. Neuron, 25(2), 331-43. [PubMed:10719889] [WorldCat] [DOI] - ↑
Qi, Y., Cai, J., Wu, Y., Wu, R., Lee, J., Fu, H., ..., & Qiu, M. (2001).
Control of oligodendrocyte differentiation by the Nkx2.2 homeodomain transcription factor. Development (Cambridge, England), 128(14), 2723-33. [PubMed:11526078] [WorldCat] - ↑
Stolt, C.C., Rehberg, S., Ader, M., Lommes, P., Riethmacher, D., Schachner, M., ..., & Wegner, M. (2002).
Terminal differentiation of myelin-forming oligodendrocytes depends on the transcription factor Sox10. Genes & development, 16(2), 165-70. [PubMed:11799060] [PMC] [WorldCat] [DOI] - ↑
Nishiyama, A., Lin, X.H., Giese, N., Heldin, C.H., & Stallcup, W.B. (1996).
Co-localization of NG2 proteoglycan and PDGF alpha-receptor on O2A progenitor cells in the developing rat brain. Journal of neuroscience research, 43(3), 299-314. [PubMed:8714519] [WorldCat] [DOI] - ↑
Stallcup, W.B., & Beasley, L. (1987).
Bipotential glial precursor cells of the optic nerve express the NG2 proteoglycan. The Journal of neuroscience : the official journal of the Society for Neuroscience, 7(9), 2737-44. [PubMed:3305800] [WorldCat] - ↑
Gotoh, H., Wood, W.M., Patel, K.D., Factor, D.C., Boshans, L.L., Nomura, T., ..., & Nishiyama, A. (2018).
NG2 expression in NG2 glia is regulated by binding of SoxE and bHLH transcription factors to a Cspg4 intronic enhancer. Glia, 66(12), 2684-2699. [PubMed:30306660] [PMC] [WorldCat] [DOI] - ↑
Sommer, I., & Schachner, M. (1981).
Monoclonal antibodies (O1 to O4) to oligodendrocyte cell surfaces: an immunocytological study in the central nervous system. Developmental biology, 83(2), 311-27. [PubMed:6786942] [WorldCat] [DOI] - ↑
Bansal, R., Stefansson, K., & Pfeiffer, S.E. (1992).
Proligodendroblast antigen (POA), a developmental antigen expressed by A007/O4-positive oligodendrocyte progenitors prior to the appearance of sulfatide and galactocerebroside. Journal of neurochemistry, 58(6), 2221-9. [PubMed:1573402] [WorldCat] [DOI] - ↑
Warf, B.C., Fok-Seang, J., & Miller, R.H. (1991).
Evidence for the ventral origin of oligodendrocyte precursors in the rat spinal cord. The Journal of neuroscience : the official journal of the Society for Neuroscience, 11(8), 2477-88. [PubMed:1869925] [WorldCat] - ↑
Ono, K., Bansal, R., Payne, J., Rutishauser, U., & Miller, R.H. (1995).
Early development and dispersal of oligodendrocyte precursors in the embryonic chick spinal cord. Development (Cambridge, England), 121(6), 1743-54. [PubMed:7600990] [WorldCat] - ↑
Orentas, D.M., & Miller, R.H. (1996).
The origin of spinal cord oligodendrocytes is dependent on local influences from the notochord. Developmental biology, 177(1), 43-53. [PubMed:8660875] [WorldCat] [DOI] - ↑
Orentas, D.M., Hayes, J.E., Dyer, K.L., & Miller, R.H. (1999).
Sonic hedgehog signaling is required during the appearance of spinal cord oligodendrocyte precursors. Development (Cambridge, England), 126(11), 2419-29. [PubMed:10226001] [WorldCat] - ↑
Trousse, F., Giess, M.C., Soula, C., Ghandour, S., Duprat, A.M., & Cochard, P. (1995).
Notochord and floor plate stimulate oligodendrocyte differentiation in cultures of the chick dorsal neural tube. Journal of neuroscience research, 41(4), 552-60. [PubMed:7473887] [WorldCat] [DOI] - ↑ 28.0 28.1
Chandran, S., Kato, H., Gerreli, D., Compston, A., Svendsen, C.N., & Allen, N.D. (2003).
FGF-dependent generation of oligodendrocytes by a hedgehog-independent pathway. Development (Cambridge, England), 130(26), 6599-609. [PubMed:14660548] [WorldCat] [DOI] - ↑
Lachapelle, F., Gumpel, M., Baulac, M., Jacque, C., Duc, P., & Baumann, N. (1983).
Transplantation of CNS fragments into the brain of shiverer mutant mice: extensive myelination by implanted oligodendrocytes. I. Immunohistochemical studies. Developmental neuroscience, 6(6), 325-34. [PubMed:6085571] [WorldCat] [DOI] - ↑
Small, R.K., Riddle, P., & Noble, M. (1987).
Evidence for migration of oligodendrocyte--type-2 astrocyte progenitor cells into the developing rat optic nerve. Nature, 328(6126), 155-7. [PubMed:3600791] [WorldCat] [DOI] - ↑
Ono, K., Yasui, Y., Rutishauser, U., & Miller, R.H. (1997).
Focal ventricular origin and migration of oligodendrocyte precursors into the chick optic nerve. Neuron, 19(2), 283-92. [PubMed:9292719] [WorldCat] [DOI] - ↑
Rompani, S.B., & Cepko, C.L. (2010).
A common progenitor for retinal astrocytes and oligodendrocytes. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(14), 4970-80. [PubMed:20371817] [PMC] [WorldCat] [DOI] - ↑
Kirby, B.B., Takada, N., Latimer, A.J., Shin, J., Carney, T.J., Kelsh, R.N., & Appel, B. (2006).
In vivo time-lapse imaging shows dynamic oligodendrocyte progenitor behavior during zebrafish development. Nature neuroscience, 9(12), 1506-11. [PubMed:17099706] [WorldCat] [DOI] - ↑
Mallon, B.S., Shick, H.E., Kidd, G.J., & Macklin, W.B. (2002).
Proteolipid promoter activity distinguishes two populations of NG2-positive cells throughout neonatal cortical development. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(3), 876-85. [PubMed:11826117] [PMC] [WorldCat] - ↑
Sugimoto, Y., Taniguchi, M., Yagi, T., Akagi, Y., Nojyo, Y., & Tamamaki, N. (2001).
Guidance of glial precursor cell migration by secreted cues in the developing optic nerve. Development (Cambridge, England), 128(17), 3321-30. [PubMed:11546748] [WorldCat] - ↑
Tsai, H.H., Tessier-Lavigne, M., & Miller, R.H. (2003).
Netrin 1 mediates spinal cord oligodendrocyte precursor dispersal. Development (Cambridge, England), 130(10), 2095-105. [PubMed:12668624] [WorldCat] [DOI] - ↑
Durand, B., Gao, F.B., & Raff, M. (1997).
Accumulation of the cyclin-dependent kinase inhibitor p27/Kip1 and the timing of oligodendrocyte differentiation. The EMBO journal, 16(2), 306-17. [PubMed:9029151] [PMC] [WorldCat] [DOI] - ↑
Tikoo, R., Osterhout, D.J., Casaccia-Bonnefil, P., Seth, P., Koff, A., & Chao, M.V. (1998).
Ectopic expression of p27Kip1 in oligodendrocyte progenitor cells results in cell-cycle growth arrest. Journal of neurobiology, 36(3), 431-40. [PubMed:9733077] [WorldCat] - ↑
Ishibashi, T., Dakin, K.A., Stevens, B., Lee, P.R., Kozlov, S.V., Stewart, C.L., & Fields, R.D. (2006).
Astrocytes promote myelination in response to electrical impulses. Neuron, 49(6), 823-32. [PubMed:16543131] [PMC] [WorldCat] [DOI] - ↑
Wake, H., Lee, P.R., & Fields, R.D. (2011).
Control of local protein synthesis and initial events in myelination by action potentials. Science (New York, N.Y.), 333(6049), 1647-51. [PubMed:21817014] [PMC] [WorldCat] [DOI] - ↑
Fyffe-Maricich, S.L., Karlo, J.C., Landreth, G.E., & Miller, R.H. (2011).
The ERK2 mitogen-activated protein kinase regulates the timing of oligodendrocyte differentiation. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(3), 843-50. [PubMed:21248107] [PMC] [WorldCat] [DOI] - ↑ 42.0 42.1 42.2
Tripathi, R.B., Clarke, L.E., Burzomato, V., Kessaris, N., Anderson, P.N., Attwell, D., & Richardson, W.D. (2011).
Dorsally and ventrally derived oligodendrocytes have similar electrical properties but myelinate preferred tracts. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(18), 6809-6819. [PubMed:21543611] [PMC] [WorldCat] [DOI] - ↑
Cameron-Curry, P., & Le Douarin, N.M. (1995).
Oligodendrocyte precursors originate from both the dorsal and the ventral parts of the spinal cord. Neuron, 15(6), 1299-310. [PubMed:8845154] [WorldCat] [DOI] - ↑
Pringle, N.P., Guthrie, S., Lumsden, A., & Richardson, W.D. (1998).
Dorsal spinal cord neuroepithelium generates astrocytes but not oligodendrocytes. Neuron, 20(5), 883-93. [PubMed:9620693] [WorldCat] [DOI] - ↑
Cai, J., Qi, Y., Hu, X., Tan, M., Liu, Z., Zhang, J., ..., & Qiu, M. (2005).
Generation of oligodendrocyte precursor cells from mouse dorsal spinal cord independent of Nkx6 regulation and Shh signaling. Neuron, 45(1), 41-53. [PubMed:15629701] [WorldCat] [DOI] - ↑
Vallstedt, A., Klos, J.M., & Ericson, J. (2005).
Multiple dorsoventral origins of oligodendrocyte generation in the spinal cord and hindbrain. Neuron, 45(1), 55-67. [PubMed:15629702] [WorldCat] [DOI] - ↑
Davies, J.E., & Miller, R.H. (2001).
Local sonic hedgehog signaling regulates oligodendrocyte precursor appearance in multiple ventricular zone domains in the chick metencephalon. Developmental biology, 233(2), 513-25. [PubMed:11336511] [WorldCat] [DOI] - ↑
Ono, K., Kagawa, T., Tsumori, T., Yokota, S., & Yasui, Y. (2001).
Morphological changes and cellular dynamics of oligodendrocyte lineage cells in the developing vertebrate central nervous system. Developmental neuroscience, 23(4-5), 346-55. [PubMed:11756750] [WorldCat] [DOI] - ↑
Mecklenburg, N., Garcia-López, R., Puelles, E., Sotelo, C., & Martinez, S. (2011).
Cerebellar oligodendroglial cells have a mesencephalic origin. Glia, 59(12), 1946-57. [PubMed:21901755] [WorldCat] [DOI] - ↑
Pringle, N.P., Mudhar, H.S., Collarini, E.J., & Richardson, W.D. (1992).
PDGF receptors in the rat CNS: during late neurogenesis, PDGF alpha-receptor expression appears to be restricted to glial cells of the oligodendrocyte lineage. Development (Cambridge, England), 115(2), 535-51. [PubMed:1425339] [WorldCat] - ↑
Olivier, C., Cobos, I., Perez Villegas, E.M., Spassky, N., Zalc, B., Martinez, S., & Thomas, J.L. (2001).
Monofocal origin of telencephalic oligodendrocytes in the anterior entopeduncular area of the chick embryo. Development (Cambridge, England), 128(10), 1757-69. [PubMed:11311157] [WorldCat] - ↑
Kessaris, N., Fogarty, M., Iannarelli, P., Grist, M., Wegner, M., & Richardson, W.D. (2006).
Competing waves of oligodendrocytes in the forebrain and postnatal elimination of an embryonic lineage. Nature neuroscience, 9(2), 173-9. [PubMed:16388308] [PMC] [WorldCat] [DOI] - ↑
Chang, A., Nishiyama, A., Peterson, J., Prineas, J., & Trapp, B.D. (2000).
NG2-positive oligodendrocyte progenitor cells in adult human brain and multiple sclerosis lesions. The Journal of neuroscience : the official journal of the Society for Neuroscience, 20(17), 6404-12. [PubMed:10964946] [PMC] [WorldCat] - ↑
Ono, K., Takebayashi, H., Ikeda, K., Furusho, M., Nishizawa, T., Watanabe, K., & Ikenaka, K. (2008).
Regional- and temporal-dependent changes in the differentiation of Olig2 progenitors in the forebrain, and the impact on astrocyte development in the dorsal pallium. Developmental biology, 320(2), 456-68. [PubMed:18582453] [WorldCat] [DOI] - ↑
Zhu, X., Bergles, D.E., & Nishiyama, A. (2008).
NG2 cells generate both oligodendrocytes and gray matter astrocytes. Development (Cambridge, England), 135(1), 145-57. [PubMed:18045844] [WorldCat] [DOI] - ↑
Zhu, X., Hill, R.A., Dietrich, D., Komitova, M., Suzuki, R., & Nishiyama, A. (2011).
Age-dependent fate and lineage restriction of single NG2 cells. Development (Cambridge, England), 138(4), 745-53. [PubMed:21266410] [PMC] [WorldCat] [DOI] - ↑
Sakry, D., Karram, K., & Trotter, J. (2011).
Synapses between NG2 glia and neurons. Journal of anatomy, 219(1), 2-7. [PubMed:21395579] [PMC] [WorldCat] [DOI]