「カルモジュリン調節スペクトリン関連タンパク質」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| 9行目: | 9行目: | ||
{{box|text= カルモジュリン調節スペクトリン関連タンパク質 (CAMSAPs) は、後生動物以降で広く保存されたタンパク質である。微小管マイナス端に結合、安定化する。細胞間接着や微小管ダイナミクスの制御を行い、上皮細胞や神経細胞の極性形成を担う。}} | {{box|text= カルモジュリン調節スペクトリン関連タンパク質 (CAMSAPs) は、後生動物以降で広く保存されたタンパク質である。微小管マイナス端に結合、安定化する。細胞間接着や微小管ダイナミクスの制御を行い、上皮細胞や神経細胞の極性形成を担う。}} | ||
== 背景 == | == 背景 == | ||
CAMSAPファミリーの発見は、まず[[CAMSAP3]]に相当する機能未知タンパク質[[KIAA1543]]が、[[細胞間接着]]に関わるタンパク質として同定され<ref name=Meng2008><pubmed>19041755</pubmed></ref>、 [[Nezha]]と命名されることに始まる。一方で、別のグループにより、[[細胞骨格]]を構成する[[スペクトリン]]と相互作用するタンパク質として[[CAMSAP1]]が同定され、さらに[[バイオインフォマティクス]]解析から<ref name=Baines2009><pubmed>19508979</pubmed></ref> 、これと高い配列類似性を示す[[ヒト]]タンパク質[[KIAA1078]]およびKIAA1543 (= Nezha) が見いだされ、それぞれ[[CAMSAP2]]およびCAMSAP3と命名された。こうして最初に発見されたNezhaも、現在ではCAMSAP3として知られている。 | CAMSAPファミリーの発見は、まず[[CAMSAP3]]に相当する機能未知タンパク質[[KIAA1543]]が、[[細胞間接着]]に関わるタンパク質として同定され[1]<ref name=Meng2008><pubmed>19041755</pubmed></ref>、 [[Nezha]]と命名されることに始まる。一方で、別のグループにより、[[細胞骨格]]を構成する[[スペクトリン]]と相互作用するタンパク質として[[CAMSAP1]]が同定され、さらに[[バイオインフォマティクス]]解析から[2]<ref name=Baines2009><pubmed>19508979</pubmed></ref> 、これと高い配列類似性を示す[[ヒト]]タンパク質[[KIAA1078]]およびKIAA1543 (= Nezha) が見いだされ、それぞれ[[CAMSAP2]]およびCAMSAP3と命名された。こうして最初に発見されたNezhaも、現在ではCAMSAP3として知られている。 | ||
これら3つのCAMSAPタンパク質は[[脊椎動物]]において広く保存されているが、[[無脊椎動物]]ではCAMSAP遺伝子は1つのみ存在することが明らかとなっている。たとえば、無脊椎動物である[[ショウジョウバエ]]では、そのCAMSAPタンパク質が[[微小管]]のマイナス端を保護する機能を持つことが示されており<ref name=Goodwin2010><pubmed>20946984</pubmed></ref>、「保護する者」を意味するラテン語にちなみ[[patronin]]と名付けられた。このような背景から、CAMSAPファミリーは、CAMSAP/patroninファミリーあるいはCAMSAP/patronin/Nezhaファミリーとも呼ばれている。 | これら3つのCAMSAPタンパク質は[[脊椎動物]]において広く保存されているが、[[無脊椎動物]]ではCAMSAP遺伝子は1つのみ存在することが明らかとなっている。たとえば、無脊椎動物である[[ショウジョウバエ]]では、そのCAMSAPタンパク質が[[微小管]]のマイナス端を保護する機能を持つことが示されており[3]<ref name=Goodwin2010><pubmed>20946984</pubmed></ref>、「保護する者」を意味するラテン語にちなみ[[patronin]]と名付けられた。このような背景から、CAMSAPファミリーは、CAMSAP/patroninファミリーあるいはCAMSAP/patronin/Nezhaファミリーとも呼ばれている。 | ||
[[ファイル:Nitta CAMSAP Fig.png|サムネイル|'''図1. CAMSAPファミリータンパク質のドメイン構造'''<br>CH: カルポニンホモロジードメイン。CC: コイルドコイル。MBD: 微小管結合ドメイン。CKK: CAMSAP1、KIAA1078、KIAA1543ドメイン。微小管結合能を有するドメインは赤色で示している。]] | [[ファイル:Nitta CAMSAP Fig.png|サムネイル|'''図1. CAMSAPファミリータンパク質のドメイン構造'''<br>CH: カルポニンホモロジードメイン。CC: コイルドコイル。MBD: 微小管結合ドメイン。CKK: CAMSAP1、KIAA1078、KIAA1543ドメイン。微小管結合能を有するドメインは赤色で示している。]] | ||
== 構造 == | == 構造 == | ||
CAMSAPファミリータンパク質に共通して、N末端には[[カルポニンホモロジー]] (CH) ドメインが、C末端には微小管結合能を有する球状の[[CKKドメイン|CAMSAP1、KIAA1078、KIAA1543 (CKK)ドメイン]]が存在し、その間に3つの[[コイルドコイルドメイン|コイルドコイル (CC) ドメイン]]が挟まれている。CKKドメインはコイルドコイルと協調して、微小管の両端のうちマイナス端に特異的に結合する性質を持つ。この結合特異性は、CKKドメインが4つの[[チューブリン]]の間の溝に結合し、微小管末端のわずかな曲率の違いを識別することによって生じると考えられている<ref name=Atherton2017><pubmed>28991265</pubmed></ref>。 | CAMSAPファミリータンパク質に共通して、N末端には[[カルポニンホモロジー]] (CH) ドメインが、C末端には微小管結合能を有する球状の[[CKKドメイン|CAMSAP1、KIAA1078、KIAA1543 (CKK)ドメイン]]が存在し、その間に3つの[[コイルドコイルドメイン|コイルドコイル (CC) ドメイン]]が挟まれている。CKKドメインはコイルドコイルと協調して、微小管の両端のうちマイナス端に特異的に結合する性質を持つ。この結合特異性は、CKKドメインが4つの[[チューブリン]]の間の溝に結合し、微小管末端のわずかな曲率の違いを識別することによって生じると考えられている[4]<ref name=Atherton2017><pubmed>28991265</pubmed></ref>。 | ||
== 発現 == | == 発現 == | ||
=== 組織分布 === | === 組織分布 === | ||
| 23行目: | 23行目: | ||
== 機能 == | == 機能 == | ||
=== 微小管マイナス端特異的な結合と安定化 === | === 微小管マイナス端特異的な結合と安定化 === | ||
CAMSAPファミリータンパク質は、いずれも微小管のマイナス端に特異的に結合する性質を共有するが、サブタイプによって微小管結合領域の数や微小管に及ぼす影響が異なる。CAMSAP1は微小管結合ドメイン(MBD)を持たず、CKKドメインのみで微小管と相互作用するため、微小管のマイナス端を追跡する機能にとどまる。一方、CAMSAP2とCAMSAP3はMBDおよびCKKドメインを介して微小管と結合し、微小管重合の際は、マイナス端周辺を覆うように結合する。これにより、CAMSAP2/3に覆われた微小管のマイナス端は安定化され、[[重合]]・[[脱重合]]ともに抑制される。この安定化効果はCAMSAP3で特に顕著である<ref name=Jiang2014><pubmed>24486153</pubmed></ref>。また、微小管脱重合因子である[[キネシン-13]] ([[MCAK]]) の微小管への結合を阻害することで、マイナス端の保護にも寄与している<ref name=Hendershott2014><pubmed>24706919</pubmed></ref>。 | CAMSAPファミリータンパク質は、いずれも微小管のマイナス端に特異的に結合する性質を共有するが、サブタイプによって微小管結合領域の数や微小管に及ぼす影響が異なる。CAMSAP1は微小管結合ドメイン(MBD)を持たず、CKKドメインのみで微小管と相互作用するため、微小管のマイナス端を追跡する機能にとどまる。一方、CAMSAP2とCAMSAP3はMBDおよびCKKドメインを介して微小管と結合し、微小管重合の際は、マイナス端周辺を覆うように結合する。これにより、CAMSAP2/3に覆われた微小管のマイナス端は安定化され、[[重合]]・[[脱重合]]ともに抑制される。この安定化効果はCAMSAP3で特に顕著である[5]<ref name=Jiang2014><pubmed>24486153</pubmed></ref>。また、微小管脱重合因子である[[キネシン-13]] ([[MCAK]]) の微小管への結合を阻害することで、マイナス端の保護にも寄与している[6]<ref name=Hendershott2014><pubmed>24706919</pubmed></ref>。 | ||
=== 微小管形成中心としての機能 === | === 微小管形成中心としての機能 === | ||
細胞内の微小管は、従来、[[中心体]]内部に存在する[[γ-tubulin ring complex]]を起点として重合すると考えられてきた。しかし近年では、中心体に依存しない微小管形成の存在が明らかとなり、CAMSAPファミリータンパク質がこの非中心体性微小管形成に関与していると考えられている。実際、[[γ- | 細胞内の微小管は、従来、[[中心体]]内部に存在する[[γ-tubulin ring complex]]を起点として重合すると考えられてきた。しかし近年では、中心体に依存しない微小管形成の存在が明らかとなり、CAMSAPファミリータンパク質がこの非中心体性微小管形成に関与していると考えられている。実際、[[γ-tubulin]]を欠損させた細胞において、いったん全ての微小管を脱重合させた後でも微小管が再形成されるが、この再形成にはCAMSAPsが不可欠である[7]<ref name=Tsuchiya2021><pubmed>34779859</pubmed></ref>。また、CAMSAP2およびCAMSAP3が微小管の重合起点となる様子は、再構成系や培養細胞系の両方で観察されており、この現象にはCAMSAPsの液-液相分離(LLPS)能が関与していると考えられている<ref name=Imasaki2022><pubmed>35762204</pubmed></ref><ref name=Tanaka2012><pubmed>23169647</pubmed></ref>[8, 9]。 | ||
=== スペクトリンとの結合 === | === スペクトリンとの結合 === | ||
CAMSAPsの名前の由来通り、スペクトリンと直接結合すること、およびその結合が[[カルモジュリン]]で制御されることが確認されている<ref name=King2014><pubmed>24117850</pubmed></ref>。 | CAMSAPsの名前の由来通り、スペクトリンと直接結合すること、およびその結合が[[カルモジュリン]]で制御されることが確認されている[10]<ref name=King2014><pubmed>24117850</pubmed></ref>。 | ||
=== アクチン線維との結合 === | === アクチン線維との結合 === | ||
CAMSAPファミリータンパク質は、様々な因子を介して、[[アクチン線維]]と直接または間接的に相互作用していると考えられている。たとえば、CAMSAP3の細胞内局在は、アクチン脱重合剤[[ラトランキュリン]]によって消失することから<ref name=Toya2016><pubmed>26715742</pubmed></ref>、アクチン線維がその局在維持に必要であることが示されている。[[線虫]]のCAMSAPホモログである[[PTRN-1]]は、N末端のCHドメインを介してアクチン重合因子[[フォルミン]]と結合し、アクチン線維の重合を促進する<ref name=Gong2018><pubmed>29567645</pubmed></ref>。 また、CAMSAPsのCC1およびCC2ドメインは、微小管とアクチン線維をつなぐリンカータンパク質である[[ACF7]]と結合する<ref name=Ning2016><pubmed>27693509</pubmed></ref>ことが報告されている。これらの知見から、CAMSAPsは微小管マイナス端をアクチン線維にアンカーする役割を担っていると考えられている。 | CAMSAPファミリータンパク質は、様々な因子を介して、[[アクチン線維]]と直接または間接的に相互作用していると考えられている。たとえば、CAMSAP3の細胞内局在は、アクチン脱重合剤[[ラトランキュリン]]によって消失することから[11]<ref name=Toya2016><pubmed>26715742</pubmed></ref>、アクチン線維がその局在維持に必要であることが示されている。[[線虫]]のCAMSAPホモログである[[PTRN-1]]は、N末端のCHドメインを介してアクチン重合因子[[フォルミン]]と結合し、アクチン線維の重合を促進する[12]<ref name=Gong2018><pubmed>29567645</pubmed></ref>。 また、CAMSAPsのCC1およびCC2ドメインは、微小管とアクチン線維をつなぐリンカータンパク質である[[ACF7]]と結合する[13]<ref name=Ning2016><pubmed>27693509</pubmed></ref>ことが報告されている。これらの知見から、CAMSAPsは微小管マイナス端をアクチン線維にアンカーする役割を担っていると考えられている。 | ||
=== 細胞極性の形成と維持 === | === 細胞極性の形成と維持 === | ||
CAMSAP3は、上皮細胞の極性形成に伴って頂端側に局在する。この局在には、CAMSAP3のCC1ドメインおよびCKKドメインが必要である。CAMSAP3の局在が乱れると、[[aPKC]]や[[ZO-1]]といった他の頂端局在タンパク質の局在も失われることから、CAMSAP3は極性形成に不可欠な因子であると考えられている。さらに、CAMSAP3のCKKドメインを欠損させると、マウス腸管上皮細胞において微小管の配向が乱れ、細胞核や細胞内小器官の位置異常に生じる<ref name=Toya2016 />。 | CAMSAP3は、上皮細胞の極性形成に伴って頂端側に局在する。この局在には、CAMSAP3のCC1ドメインおよびCKKドメインが必要である。CAMSAP3の局在が乱れると、[[aPKC]]や[[ZO-1]]といった他の頂端局在タンパク質の局在も失われることから、CAMSAP3は極性形成に不可欠な因子であると考えられている。さらに、CAMSAP3のCKKドメインを欠損させると、マウス腸管上皮細胞において微小管の配向が乱れ、細胞核や細胞内小器官の位置異常に生じる[11]<ref name=Toya2016 />。 | ||
=== 神経細胞における機能 === | === 神経細胞における機能 === | ||
神経細胞の発達において、CAMSAPファミリータンパク質は軸索の伸長および樹状突起の分枝形成に関与する。軸索の成長は微小管の伸張と極性に依存しており、CAMSAPが微小管のマイナス端に局在することで、成長円錐における微小管の安定化が促進される。このとき、CAMSAP1、CAMSAP2、CAMSAP3が協働的あるいは相補的に機能していると考えられているが、分化段階における軸索および樹状突起への局在や、翻訳後修飾を受けた微小管の認識の違いなど、未解明の点が多く、確立された知見には至っていない<ref name=Yau2014><pubmed>24908486</pubmed></ref><ref name=Pongrakhananon2018><pubmed>30190432</pubmed></ref><ref name=Zhou2020><pubmed>32839317</pubmed></ref>。神経細胞の発達において、CAMSAPファミリータンパク質は軸索の伸長および樹状突起の分枝形成に関与する。軸索の成長は微小管の伸張と極性に依存しており、CAMSAPが微小管のマイナス端に局在することで、成長円錐における微小管の安定化が促進される。 | 神経細胞の発達において、CAMSAPファミリータンパク質は軸索の伸長および樹状突起の分枝形成に関与する。軸索の成長は微小管の伸張と極性に依存しており、CAMSAPが微小管のマイナス端に局在することで、成長円錐における微小管の安定化が促進される。このとき、CAMSAP1、CAMSAP2、CAMSAP3が協働的あるいは相補的に機能していると考えられているが、分化段階における軸索および樹状突起への局在や、翻訳後修飾を受けた微小管の認識の違いなど、未解明の点が多く、確立された知見には至っていない<ref name=Yau2014><pubmed>24908486</pubmed></ref><ref name=Pongrakhananon2018><pubmed>30190432</pubmed></ref><ref name=Zhou2020><pubmed>32839317</pubmed></ref>[14, 15, 16]。神経細胞の発達において、CAMSAPファミリータンパク質は軸索の伸長および樹状突起の分枝形成に関与する。軸索の成長は微小管の伸張と極性に依存しており、CAMSAPが微小管のマイナス端に局在することで、成長円錐における微小管の安定化が促進される。 | ||
CAMSAP3のCKKドメインを欠損させた場合、[[初代培養]]した[[マウス]][[海馬]]ニューロンにおいて複数の[[軸索]]が形成されるという異常が観察される<ref name=Pongrakhananon2018></ref>が、同様の現象はCAMSAP2では確認されていない。このような神経細胞の極性形成の異常は、CAMSAP1のノックアウトにおいても報告されており、CAMSAP1は[[MARK2]]キナーゼによる[[リン酸化]]を介して制御されていることが示されている<ref name=Zhou2020></ref>。 | CAMSAP3のCKKドメインを欠損させた場合、[[初代培養]]した[[マウス]][[海馬]]ニューロンにおいて複数の[[軸索]]が形成されるという異常が観察される[15]<ref name=Pongrakhananon2018></ref>が、同様の現象はCAMSAP2では確認されていない。このような神経細胞の極性形成の異常は、CAMSAP1のノックアウトにおいても報告されており、CAMSAP1は[[MARK2]]キナーゼによる[[リン酸化]]を介して制御されていることが示されている[16]<ref name=Zhou2020></ref>。 | ||
== 疾患との関わり == | == 疾患との関わり == | ||
=== 神経疾患 === | === 神経疾患 === | ||
近年の研究により、CAMSAPの異常が神経疾患や[[発達障害]]に関連する可能性が示唆されている。たとえば、CAMSAP1の機能欠損は、[[てんかん]]を伴う[[滑脳症]]や[[脳回]]肥厚を引き起こすことが報告されている<ref name=Khalaf-Nazzal2022><pubmed>36283405</pubmed></ref>。この研究で、神経細胞移動障害を持つ患者由来の[[iPS細胞]]を用いて[[神経前駆細胞]]から神経細胞への分化過程を観察し、増殖速度・分化速度の低下、[[アポトーシス]]率の上昇が示されている<ref name=Khalaf-Nazzal2022 />。また、CAMSAP2についても、[[ゲノムワイド関連解析]]([[GWAS]])および細胞生物学的解析から、てんかんの発症リスクとの関連が報告されている<ref name=Zhang2013><pubmed>24148305</pubmed></ref>。 | 近年の研究により、CAMSAPの異常が神経疾患や[[発達障害]]に関連する可能性が示唆されている。たとえば、CAMSAP1の機能欠損は、[[てんかん]]を伴う[[滑脳症]]や[[脳回]]肥厚を引き起こすことが報告されている[17]<ref name=Khalaf-Nazzal2022><pubmed>36283405</pubmed></ref>。この研究で、神経細胞移動障害を持つ患者由来の[[iPS細胞]]を用いて[[神経前駆細胞]]から神経細胞への分化過程を観察し、増殖速度・分化速度の低下、[[アポトーシス]]率の上昇が示されている[17]<ref name=Khalaf-Nazzal2022 />。また、CAMSAP2についても、[[ゲノムワイド関連解析]]([[GWAS]])および細胞生物学的解析から、てんかんの発症リスクとの関連が報告されている[18]<ref name=Zhang2013><pubmed>24148305</pubmed></ref>。 | ||
=== 神経疾患以外の疾患 === | === 神経疾患以外の疾患 === | ||
CAMSAPは細胞分裂や細胞極性の維持に関与することから、神経系以外でも、特に[[腫瘍]]の形成や転移に関与することが報告されている。たとえば、特定の[[肝癌]]ではCAMSAP2の発現亢進ががん細胞の浸潤と関連することが報告されており<ref name=Li2020><pubmed>32206120</pubmed></ref>、一方でCAMSAP3の発現低下は、[[肺癌]]の悪性化、浸潤、血管新生に関与することが示されている<ref name=Pongrakhananon2018 /><ref name=Seephan2023><pubmed>37019300</pubmed></ref>。さらに、CAMSAP3は上皮細胞における頂端-[[基底]]極性の形成および維持に必須であり、その機能障害は、[[皮膚]]<ref name=Kobori2024><pubmed>38190868</pubmed></ref>、[[腸管]]<ref name=Toya2016></ref>、腎臓<ref name=Mitsuhata2021><pubmed>33712686</pubmed></ref>、卵管<ref name=Usami2021><pubmed>33468623 </pubmed></ref>などにおけるバリア機能、吸収機能、[[繊毛]]運動といった上皮機能の破綻を引き起こす可能性がある。 | CAMSAPは細胞分裂や細胞極性の維持に関与することから、神経系以外でも、特に[[腫瘍]]の形成や転移に関与することが報告されている。たとえば、特定の[[肝癌]]ではCAMSAP2の発現亢進ががん細胞の浸潤と関連することが報告されており[19]<ref name=Li2020><pubmed>32206120</pubmed></ref>、一方でCAMSAP3の発現低下は、[[肺癌]]の悪性化、浸潤、血管新生に関与することが示されている<ref name=Pongrakhananon2018 /><ref name=Seephan2023><pubmed>37019300</pubmed></ref>[15, 20]。さらに、CAMSAP3は上皮細胞における頂端-[[基底]]極性の形成および維持に必須であり、その機能障害は、[[皮膚]][21]<ref name=Kobori2024><pubmed>38190868</pubmed></ref>、[[腸管]][11]<ref name=Toya2016></ref>、腎臓[22]<ref name=Mitsuhata2021><pubmed>33712686</pubmed></ref>、卵管[23]<ref name=Usami2021><pubmed>33468623 </pubmed></ref>などにおけるバリア機能、吸収機能、[[繊毛]]運動といった上皮機能の破綻を引き起こす可能性がある。 | ||
== 関連項目 == | == 関連項目 == | ||
2025年7月24日 (木) 00:02時点における版
劉 涵今、吉川 知志、今崎 剛、仁田 亮
神戸大学大学院医学研究科 生体構造解剖学分野
DOI:10.14931/bsd.11120 原稿受付日:2025年7月10日 原稿完成日:2025年7月22日
担当編集委員:古屋敷 智之(東京科学大学大学院 医歯学総合研究科 薬理学分野)
英:calmodulin-regulated spectrin-associated proteins
略称:CAMSAP
カルモジュリン調節スペクトリン関連タンパク質 (CAMSAPs) は、後生動物以降で広く保存されたタンパク質である。微小管マイナス端に結合、安定化する。細胞間接着や微小管ダイナミクスの制御を行い、上皮細胞や神経細胞の極性形成を担う。
背景
CAMSAPファミリーの発見は、まずCAMSAP3に相当する機能未知タンパク質KIAA1543が、細胞間接着に関わるタンパク質として同定され[1][1]、 Nezhaと命名されることに始まる。一方で、別のグループにより、細胞骨格を構成するスペクトリンと相互作用するタンパク質としてCAMSAP1が同定され、さらにバイオインフォマティクス解析から[2][2] 、これと高い配列類似性を示すヒトタンパク質KIAA1078およびKIAA1543 (= Nezha) が見いだされ、それぞれCAMSAP2およびCAMSAP3と命名された。こうして最初に発見されたNezhaも、現在ではCAMSAP3として知られている。
これら3つのCAMSAPタンパク質は脊椎動物において広く保存されているが、無脊椎動物ではCAMSAP遺伝子は1つのみ存在することが明らかとなっている。たとえば、無脊椎動物であるショウジョウバエでは、そのCAMSAPタンパク質が微小管のマイナス端を保護する機能を持つことが示されており[3][3]、「保護する者」を意味するラテン語にちなみpatroninと名付けられた。このような背景から、CAMSAPファミリーは、CAMSAP/patroninファミリーあるいはCAMSAP/patronin/Nezhaファミリーとも呼ばれている。
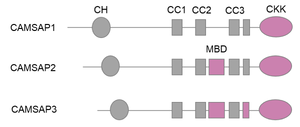
CH: カルポニンホモロジードメイン。CC: コイルドコイル。MBD: 微小管結合ドメイン。CKK: CAMSAP1、KIAA1078、KIAA1543ドメイン。微小管結合能を有するドメインは赤色で示している。
構造
CAMSAPファミリータンパク質に共通して、N末端にはカルポニンホモロジー (CH) ドメインが、C末端には微小管結合能を有する球状のCAMSAP1、KIAA1078、KIAA1543 (CKK)ドメインが存在し、その間に3つのコイルドコイル (CC) ドメインが挟まれている。CKKドメインはコイルドコイルと協調して、微小管の両端のうちマイナス端に特異的に結合する性質を持つ。この結合特異性は、CKKドメインが4つのチューブリンの間の溝に結合し、微小管末端のわずかな曲率の違いを識別することによって生じると考えられている[4][4]。
発現
組織分布
CAMSAPファミリータンパク質は、多くの動物組織に広汎に発現しており、サブタイプにより発現傾向に違いが見られる。CAMSAP1は中枢神経系、特に大脳皮質や視細胞のほか、膵臓や膀胱などでも比較的高い発現が認められる。CAMSAP2は中枢神経系、特に興奮性および抑制性神経細胞、ならびにグリア細胞に強く発現しており、さらに骨格筋、心筋、血管内皮、血球系において高発現が確認されている。CAMSAP3は中枢神経系全体に中等度に発現する一方、消化管上皮、皮膚、腎尿細管などの上皮系組織や生殖細胞では比較的高い発現が見られる。
細胞内分布
細胞内では、CAMSAPは主に微小管のマイナス端に局在し、微小管の安定化や束化に関与するタンパク質として知られている。細胞の特性に応じて、細胞質全体に分布する微小管ネットワークの安定化を担うだけでなく、CAMSAP2はゴルジ体、CAMSAP3は上皮細胞の頂端皮質面に局在することで微小管の配向に極性を与え、細胞の形態形成、突起形成や運動などを制御している。
機能
微小管マイナス端特異的な結合と安定化
CAMSAPファミリータンパク質は、いずれも微小管のマイナス端に特異的に結合する性質を共有するが、サブタイプによって微小管結合領域の数や微小管に及ぼす影響が異なる。CAMSAP1は微小管結合ドメイン(MBD)を持たず、CKKドメインのみで微小管と相互作用するため、微小管のマイナス端を追跡する機能にとどまる。一方、CAMSAP2とCAMSAP3はMBDおよびCKKドメインを介して微小管と結合し、微小管重合の際は、マイナス端周辺を覆うように結合する。これにより、CAMSAP2/3に覆われた微小管のマイナス端は安定化され、重合・脱重合ともに抑制される。この安定化効果はCAMSAP3で特に顕著である[5][5]。また、微小管脱重合因子であるキネシン-13 (MCAK) の微小管への結合を阻害することで、マイナス端の保護にも寄与している[6][6]。
微小管形成中心としての機能
細胞内の微小管は、従来、中心体内部に存在するγ-tubulin ring complexを起点として重合すると考えられてきた。しかし近年では、中心体に依存しない微小管形成の存在が明らかとなり、CAMSAPファミリータンパク質がこの非中心体性微小管形成に関与していると考えられている。実際、γ-tubulinを欠損させた細胞において、いったん全ての微小管を脱重合させた後でも微小管が再形成されるが、この再形成にはCAMSAPsが不可欠である[7][7]。また、CAMSAP2およびCAMSAP3が微小管の重合起点となる様子は、再構成系や培養細胞系の両方で観察されており、この現象にはCAMSAPsの液-液相分離(LLPS)能が関与していると考えられている[8][9][8, 9]。
スペクトリンとの結合
CAMSAPsの名前の由来通り、スペクトリンと直接結合すること、およびその結合がカルモジュリンで制御されることが確認されている[10][10]。
アクチン線維との結合
CAMSAPファミリータンパク質は、様々な因子を介して、アクチン線維と直接または間接的に相互作用していると考えられている。たとえば、CAMSAP3の細胞内局在は、アクチン脱重合剤ラトランキュリンによって消失することから[11][11]、アクチン線維がその局在維持に必要であることが示されている。線虫のCAMSAPホモログであるPTRN-1は、N末端のCHドメインを介してアクチン重合因子フォルミンと結合し、アクチン線維の重合を促進する[12][12]。 また、CAMSAPsのCC1およびCC2ドメインは、微小管とアクチン線維をつなぐリンカータンパク質であるACF7と結合する[13][13]ことが報告されている。これらの知見から、CAMSAPsは微小管マイナス端をアクチン線維にアンカーする役割を担っていると考えられている。
細胞極性の形成と維持
CAMSAP3は、上皮細胞の極性形成に伴って頂端側に局在する。この局在には、CAMSAP3のCC1ドメインおよびCKKドメインが必要である。CAMSAP3の局在が乱れると、aPKCやZO-1といった他の頂端局在タンパク質の局在も失われることから、CAMSAP3は極性形成に不可欠な因子であると考えられている。さらに、CAMSAP3のCKKドメインを欠損させると、マウス腸管上皮細胞において微小管の配向が乱れ、細胞核や細胞内小器官の位置異常に生じる[11][11]。
神経細胞における機能
神経細胞の発達において、CAMSAPファミリータンパク質は軸索の伸長および樹状突起の分枝形成に関与する。軸索の成長は微小管の伸張と極性に依存しており、CAMSAPが微小管のマイナス端に局在することで、成長円錐における微小管の安定化が促進される。このとき、CAMSAP1、CAMSAP2、CAMSAP3が協働的あるいは相補的に機能していると考えられているが、分化段階における軸索および樹状突起への局在や、翻訳後修飾を受けた微小管の認識の違いなど、未解明の点が多く、確立された知見には至っていない[14][15][16][14, 15, 16]。神経細胞の発達において、CAMSAPファミリータンパク質は軸索の伸長および樹状突起の分枝形成に関与する。軸索の成長は微小管の伸張と極性に依存しており、CAMSAPが微小管のマイナス端に局在することで、成長円錐における微小管の安定化が促進される。
CAMSAP3のCKKドメインを欠損させた場合、初代培養したマウス海馬ニューロンにおいて複数の軸索が形成されるという異常が観察される[15][15]が、同様の現象はCAMSAP2では確認されていない。このような神経細胞の極性形成の異常は、CAMSAP1のノックアウトにおいても報告されており、CAMSAP1はMARK2キナーゼによるリン酸化を介して制御されていることが示されている[16][16]。
疾患との関わり
神経疾患
近年の研究により、CAMSAPの異常が神経疾患や発達障害に関連する可能性が示唆されている。たとえば、CAMSAP1の機能欠損は、てんかんを伴う滑脳症や脳回肥厚を引き起こすことが報告されている[17][17]。この研究で、神経細胞移動障害を持つ患者由来のiPS細胞を用いて神経前駆細胞から神経細胞への分化過程を観察し、増殖速度・分化速度の低下、アポトーシス率の上昇が示されている[17][17]。また、CAMSAP2についても、ゲノムワイド関連解析(GWAS)および細胞生物学的解析から、てんかんの発症リスクとの関連が報告されている[18][18]。
神経疾患以外の疾患
CAMSAPは細胞分裂や細胞極性の維持に関与することから、神経系以外でも、特に腫瘍の形成や転移に関与することが報告されている。たとえば、特定の肝癌ではCAMSAP2の発現亢進ががん細胞の浸潤と関連することが報告されており[19][19]、一方でCAMSAP3の発現低下は、肺癌の悪性化、浸潤、血管新生に関与することが示されている[15][20][15, 20]。さらに、CAMSAP3は上皮細胞における頂端-基底極性の形成および維持に必須であり、その機能障害は、皮膚[21][21]、腸管[11][11]、腎臓[22][22]、卵管[23][23]などにおけるバリア機能、吸収機能、繊毛運動といった上皮機能の破綻を引き起こす可能性がある。
関連項目
参考文献
- ↑
Meng, W., Mushika, Y., Ichii, T., & Takeichi, M. (2008).
Anchorage of microtubule minus ends to adherens junctions regulates epithelial cell-cell contacts. Cell, 135(5), 948-59. [PubMed:19041755] [WorldCat] [DOI] - ↑
Baines, A.J., Bignone, P.A., King, M.D., Maggs, A.M., Bennett, P.M., Pinder, J.C., & Phillips, G.W. (2009).
The CKK domain (DUF1781) binds microtubules and defines the CAMSAP/ssp4 family of animal proteins. Molecular biology and evolution, 26(9), 2005-14. [PubMed:19508979] [WorldCat] [DOI] - ↑
Goodwin, S.S., & Vale, R.D. (2010).
Patronin regulates the microtubule network by protecting microtubule minus ends. Cell, 143(2), 263-74. [PubMed:20946984] [PMC] [WorldCat] [DOI] - ↑
Atherton, J., Jiang, K., Stangier, M.M., Luo, Y., Hua, S., Houben, K., ..., & Akhmanova, A. (2017).
A structural model for microtubule minus-end recognition and protection by CAMSAP proteins. Nature structural & molecular biology, 24(11), 931-943. [PubMed:28991265] [PMC] [WorldCat] [DOI] - ↑
Jiang, K., Hua, S., Mohan, R., Grigoriev, I., Yau, K.W., Liu, Q., ..., & Akhmanova, A. (2014).
Microtubule minus-end stabilization by polymerization-driven CAMSAP deposition. Developmental cell, 28(3), 295-309. [PubMed:24486153] [WorldCat] [DOI] - ↑
Hendershott, M.C., & Vale, R.D. (2014).
Regulation of microtubule minus-end dynamics by CAMSAPs and Patronin. Proceedings of the National Academy of Sciences of the United States of America, 111(16), 5860-5. [PubMed:24706919] [PMC] [WorldCat] [DOI] - ↑
Tsuchiya, K., & Goshima, G. (2021).
Microtubule-associated proteins promote microtubule generation in the absence of γ-tubulin in human colon cancer cells. The Journal of cell biology, 220(12). [PubMed:34779859] [PMC] [WorldCat] [DOI] - ↑
Imasaki, T., Kikkawa, S., Niwa, S., Saijo-Hamano, Y., Shigematsu, H., Aoyama, K., ..., & Nitta, R. (2022).
CAMSAP2 organizes a γ-tubulin-independent microtubule nucleation centre through phase separation. eLife, 11. [PubMed:35762204] [PMC] [WorldCat] [DOI] - ↑
Tanaka, N., Meng, W., Nagae, S., & Takeichi, M. (2012).
Nezha/CAMSAP3 and CAMSAP2 cooperate in epithelial-specific organization of noncentrosomal microtubules. Proceedings of the National Academy of Sciences of the United States of America, 109(49), 20029-34. [PubMed:23169647] [PMC] [WorldCat] [DOI] - ↑
King, M.D., Phillips, G.W., Bignone, P.A., Hayes, N.V., Pinder, J.C., & Baines, A.J. (2014).
A conserved sequence in calmodulin regulated spectrin-associated protein 1 links its interaction with spectrin and calmodulin to neurite outgrowth. Journal of neurochemistry, 128(3), 391-402. [PubMed:24117850] [PMC] [WorldCat] [DOI] - ↑ 11.0 11.1 11.2
Toya, M., Kobayashi, S., Kawasaki, M., Shioi, G., Kaneko, M., Ishiuchi, T., ..., & Takeichi, M. (2016).
CAMSAP3 orients the apical-to-basal polarity of microtubule arrays in epithelial cells. Proceedings of the National Academy of Sciences of the United States of America, 113(2), 332-7. [PubMed:26715742] [PMC] [WorldCat] [DOI] - ↑
Gong, T., Yan, Y., Zhang, J., Liu, S., Liu, H., Gao, J., ..., & Shi, A. (2018).
PTRN-1/CAMSAP promotes CYK-1/formin-dependent actin polymerization during endocytic recycling. The EMBO journal, 37(9). [PubMed:29567645] [PMC] [WorldCat] [DOI] - ↑
Ning, W., Yu, Y., Xu, H., Liu, X., Wang, D., Wang, J., ..., & Meng, W. (2016).
The CAMSAP3-ACF7 Complex Couples Noncentrosomal Microtubules with Actin Filaments to Coordinate Their Dynamics. Developmental cell, 39(1), 61-74. [PubMed:27693509] [WorldCat] [DOI] - ↑
Yau, K.W., van Beuningen, S.F., Cunha-Ferreira, I., Cloin, B.M., van Battum, E.Y., Will, L., ..., & Hoogenraad, C.C. (2014).
Microtubule minus-end binding protein CAMSAP2 controls axon specification and dendrite development. Neuron, 82(5), 1058-73. [PubMed:24908486] [WorldCat] [DOI] - ↑ 15.0 15.1 15.2
Pongrakhananon, V., Saito, H., Hiver, S., Abe, T., Shioi, G., Meng, W., & Takeichi, M. (2018).
CAMSAP3 maintains neuronal polarity through regulation of microtubule stability. Proceedings of the National Academy of Sciences of the United States of America, 115(39), 9750-9755. [PubMed:30190432] [PMC] [WorldCat] [DOI] - ↑ 16.0 16.1
Zhou, Z., Xu, H., Li, Y., Yang, M., Zhang, R., Shiraishi, A., ..., & Meng, W. (2020).
CAMSAP1 breaks the homeostatic microtubule network to instruct neuronal polarity. Proceedings of the National Academy of Sciences of the United States of America, 117(36), 22193-22203. [PubMed:32839317] [PMC] [WorldCat] [DOI] - ↑ 17.0 17.1
Khalaf-Nazzal, R., Fasham, J., Inskeep, K.A., Blizzard, L.E., Leslie, J.S., Wakeling, M.N., ..., & Baple, E.L. (2022).
Bi-allelic CAMSAP1 variants cause a clinically recognizable neuronal migration disorder. American journal of human genetics, 109(11), 2068-2079. [PubMed:36283405] [PMC] [WorldCat] [DOI] - ↑
Zhang, S., Kwan, P., & Baum, L. (2013).
The potential role of CAMSAP1L1 in symptomatic epilepsy. Neuroscience letters, 556, 146-51. [PubMed:24148305] [WorldCat] [DOI] - ↑
Li, D., Ding, X., Xie, M., Huang, Z., Han, P., Tian, D., & Xia, L. (2020).
CAMSAP2-mediated noncentrosomal microtubule acetylation drives hepatocellular carcinoma metastasis. Theranostics, 10(8), 3749-3766. [PubMed:32206120] [PMC] [WorldCat] [DOI] - ↑
Seephan, S., Sasaki, S.I., Wattanathamsan, O., Singharajkomron, N., He, K., Ucche, S., ..., & Pongrakhananon, V. (2023).
CAMSAP3 negatively regulates lung cancer cell invasion and angiogenesis through nucleolin/HIF-1α mRNA complex stabilization. Life sciences, 322, 121655. [PubMed:37019300] [WorldCat] [DOI] - ↑
Kobori, M., Abe, J., Saito, R., & Hirai, Y. (2024).
CAMSAP3, a microtubule orientation regulator, plays a vital role in manifesting differentiation-dependent characteristics in keratinocytes. Experimental cell research, 435(1), 113927. [PubMed:38190868] [WorldCat] [DOI] - ↑
Mitsuhata, Y., Abe, T., Misaki, K., Nakajima, Y., Kiriya, K., Kawasaki, M., ..., & Sato, M. (2021).
Cyst formation in proximal renal tubules caused by dysfunction of the microtubule minus-end regulator CAMSAP3. Scientific reports, 11(1), 5857. [PubMed:33712686] [PMC] [WorldCat] [DOI] - ↑
Usami, F.M., Arata, M., Shi, D., Oka, S., Higuchi, Y., Tissir, F., ..., & Fujimori, T. (2021).
Intercellular and intracellular cilia orientation is coordinated by CELSR1 and CAMSAP3 in oviduct multi-ciliated cells. Journal of cell science, 134(4). [PubMed:33468623] [WorldCat] [DOI]