「ミトコンドリア」の版間の差分
細 →グリア細胞 |
細 →疾患との関わり |
||
| 109行目: | 109行目: | ||
== 疾患との関わり== | == 疾患との関わり== | ||
=== パーキンソン病 === | === パーキンソン病 === | ||
[[パーキンソン病]]とミトコンドリアの関連が初めて明らかになったのは1980年代初頭からである。[[オピオイド]]の違法合成の過程でできた副産物[[1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン]] ([[MPTP]])を摂取した薬物依存者がパーキンソン様症状を示したことが発端である。MPTPは酸化されて[[MPP+]]となり、[[ドーパミントランスポーター]]を通じてドーパミンニューロンに取り込まれ、ミトコンドリアに蓄積して電子伝達系の複合体Iの活性を阻害する。1998年にパーキンソン病の原因遺伝子としてミトコンドリア局在タンパク質であるParkin遺伝子がクローニングされ、機能低下したミトコンドリアが蓄積することでドーパミンニューロンの脱落を引き起こすと考えられている。Parkinのみをノックアウトしたマウスで大きな表現型は見られないが、mtDNAの複製に働く[[DNA polymerase gamma, catalytic subunit]] ([[POLG]])のDNA複製の校正機能に異常を来した変異体マウスとParkinノックアウトマウスを交配したマウスでは、中脳黒質におけるドーパミンニューロンの細胞死、mtDNAの変異蓄積、ミトコンドリア呼吸鎖の低下が見られる<ref name=Pickrell2015><pubmed>25611507</pubmed></ref>67。 | |||
=== アルツハイマー病 === | === アルツハイマー病 === | ||
[[アルツハイマー病]]患者の脳ではグルコース代謝、酸素消費量が低下していることから、ミトコンドリアの機能異常がアルツハイマー病の発症に寄与する可能性が考えられている。また、ミトコンドリア機能異常とアルツハイマー病発症との関連を示すより直接的な証拠として、アルツハイマー病罹患者の死後脳の電子顕微鏡観察から、ミトコンドリアのサイズ低下やクリステ構造の異常が観察されている<ref name=Trimmer2000><pubmed>10716887</pubmed></ref>68。さらに、アルツハイマー病罹患者においてピルビン酸脱水素酵素や[[α-ケトグルタル酸脱水素酵素]]複合体の活性低下が見られることから、ミトコンドリアのATP産生能低下がアルツハイマー病発症につながる可能性が考えられている<ref name=Bhatia2022><pubmed>33998995</pubmed></ref>69。 | |||
=== 多発性硬化症 === | === 多発性硬化症 === | ||
[[多発性硬化症]]は、[[中枢神経]]([[脳]]・[[脊髄]])や[[視神経]]で起きる脱髄性の[[神経変性疾患]]である。病変部位の周囲に異常活性化したミクログリアを初めとするミエロイド系の細胞が蓄積し、[[腫瘍壊死因子]] ([[tumor necrosis factor]]; [[TNF]])、[[インターロイキン1β]] ([[IL-1β]])、[[一酸化窒素]]やROSを慢性的に放出することで髄鞘の再形成阻害、神経細胞や軸索の障害を引き起こすと考えられている。多発性硬化症の発症機序において、これまで主にオリゴデンドロサイトやニューロンにおけるミトコンドリア機能異常が注目されてきた。一方、近年の研究により、ミクログリアにおいて呼吸鎖複合体を介した電子伝達が逆方向に流れる電子伝達の逆回し([[reverse electron transport]]; [[RET]]) が生じ、複合体IIから複合体Iへ電子が逆行することで大量のROSが生成されることが明らかとなっている。これにより、ミクログリアの異常活性化に伴う[[慢性炎症]]が多発性硬化症の病態進行に寄与する可能性が示唆されるとともに、ミクログリアにおける複合体I活性の選択的抑制による新規治療戦略の有望性が提示された<ref name=Peruzzotti-Jametti2024><pubmed>38480879</pubmed></ref>70。 | |||
== 関連項目 == | == 関連項目 == | ||
2025年12月31日 (水) 23:37時点における版
壷井 將史、杜 羽丹、平林 祐介
東京大学大学院 工学系研究科
DOI:10.14931/bsd.11447 原稿受付日:2025年6月18日 原稿完成日:2025年12月14日
担当編集委員:古屋敷 智之(東京科学大学大学院 医歯学総合研究科 薬理学分野)
英語名:mitochondrion (複数形:mitochondria)、独:Mitochondrion (複数形:Mitochondrien) 仏:mitochondrie (複数形:mitochondries)
脳のミトコンドリアは、神経細胞が必要とする膨大なエネルギーを供給する中心的な細胞内小器官であり、ATP産生を通じて興奮性シグナル伝達やシナプス可塑性など、多くの神経機能を支えている。脳では糖代謝が主要なエネルギー源とされるが、ミトコンドリアは乳酸、ケトン体、脂肪酸など多様な基質を柔軟に利用でき、特に活動の激しいシナプスや樹状突起に局在することで局所的なエネルギー需要に即応している。また、ミトコンドリアはカルシウムの緩衝・調節を通じて神経細胞の興奮性を制御し、神経伝達物質放出や長期増強(LTP)などの可塑性機構に直接影響を与える。さらに、活性酸素種(ROS)の産生と解毒、細胞死シグナルの統合、分裂と融合を繰り返す動態(ミトコンドリアダイナミクス)、および軸索・樹状突起内での輸送など、神経細胞の恒常性維持に不可欠な多彩な機能を担う。こうした過程が障害されると、シナプスの形態異常や代謝低下、カルシウム破綻が生じ、アルツハイマー病やパーキンソン病をはじめとする神経変性疾患や老化に伴う認知機能低下と密接に関連することが知られている。
ミトコンドリアとは
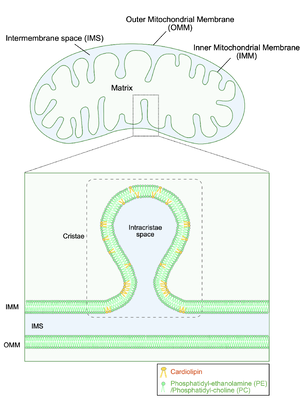
ミトコンドリアは外膜 (Outer Mitochondrial Membrane: OMM)、内膜 (Inner Mitochondrial Membrane: IMM)の2つの脂質二重膜からなり、内膜は複雑に入り組んだ膜構造を示す(クリステ構造)。ミトコンドリア内膜は、2分子のリン酸基、4分子の脂肪酸鎖を有するカルジオリピンを多く含む。4分子の脂肪酸鎖を有するカルジオリピンは円錐形状を示し極性頭部を膜の内側に向けた配向を取り、これが曲率の高い複雑なクリステ構造の形成に重要であると考えられている。IMS, Intermembrane space.
ミトコンドリアは、真核生物における細胞小器官の一つであり、ATP合成、Ca2+取り込み、脂質合成、アミノ酸代謝など細胞の恒常性維持に必須の生化学反応の場として知られる。また、ミトコンドリアは様々なシグナル伝達の“ハブ”として機能し、細胞の増殖、細胞死、代謝調節の制御に重要な働きを担う。
構造
他のオルガネラと異なり、外膜、内膜の2つの脂質二重膜からなり、内膜は複雑に入り組んだ膜構造を示す(クリステ構造)(図1)。核ゲノムとは異なる独自のDNA(mitochondrial DNA: mtDNA)を有しており、電子伝達系タンパク質複合体の一部およびそれらを翻訳するためのtransfer RNA, ribosomal RNAはmtDNAにコードされている。
ミトコンドリアの形態は静的ではなく、生合成・分裂・融合・分解を経ることで動的にその形態を変える。さらにモータータンパク質により細胞骨格上を活発に輸送されることで局所での細胞の機能発揮を支える。古典的な教科書に描かれているような球状あるいは楕円状の単一の構造ではなく、非常に多様な形態をとり、時には細長い筒状構造が連結した構造を示す。極めて長く複雑な突起を有し、細胞内の機能的区画化を示すニューロンにおいて、ミトコンドリアは細胞区画ごとにユニークな形態を示す。樹状突起においては長い筒状の構造を示し、突起が枝分かれする場合、ミトコンドリアもそれに沿った枝分かれ構造を示す。一方で、軸索においては直径数百 nmから1 µmの顆粒状の構造を示し、大脳の投射ニューロンの場合にはそのおよそ半分がシナプス前部近傍に局在する。
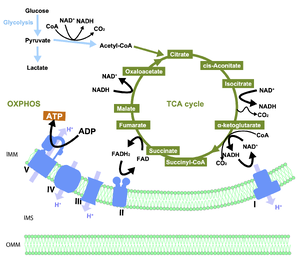
解糖系 (細胞質) によりグルコースから生成されたピルビン酸 (Pyruvate) は酸化的脱炭酸反応により2炭素のアセチルCoA (Acetyl-CoA) に変換され、TCA回路 (クエン酸回路, Krebs回路) に入る。アセチルCoA は4炭素のオキサロ酢酸 (oxaloacetate) と結合して6炭素のクエン酸を生成する。一連の反応により、1分子のアセチルCoAから3分子のNADHと1分子のFADH2が生成される。これらはそれぞれ呼吸鎖複合体 (電子伝達系, Electron transport chain) の複合体Iと複合体IIへ供給される。NADHとFADH2が持つ電子は電子伝達系に渡され、複合体I, 複合体III, 複合体IV (複合体I, IVのプロトンポンプとしての働き、もしくは副反応) によりH+がミトコンドリア内膜から膜間へと汲み出されH+濃度勾配が形成される。このH+濃度勾配により複合体 V (ATP合成酵素) が駆動されATPが産生される。
基本機能
TCA回路
トリカルボン酸 (tricarboxylic acid; TCA)回路 (クエン酸回路, Krebs回路) は、脂肪酸やアミノ酸、ピルビン酸の酸化から生じた2炭素のアセチルCoAが、4炭素のオキサロ酢酸と結合して6炭素のクエン酸を生成する反応から始まる閉鎖型ループ反応である (図2)。一連の8段階の反応により、1分子のアセチルCoAから3分子のNADHと1分子のFADH2が生成される。これらはそれぞれ呼吸鎖複合体 (電子伝達系, Electron transport chain) の複合体Iと複合体IIへ供給され、最終的に酸化的リン酸化を介したATP産生に利用される。
また、TCA回路は異化反応 (catabolism) だけでなく同化反応 (anabolism) にも重要な役割を果たし、その中間体はアミノ酸やヌクレオチドなどの生体分子の合成に寄与する。例えば、オキサロ酢酸はアスパラギン酸、α-ケトグルタル酸はグルタミン酸の前駆体として各アミノ酸の生合成に関与する。同化反応によって回路内の中間体が不足すると、回路を維持するためにアナプレロシス (anaplerosis) と呼ばれる補充経路が必要となる。代表的なアナプレロティック反応として、ピルビン酸カルボキシラーゼによって触媒されるピルビン酸からオキサロ酢酸への変換がある。
酸化的リン酸化
TCA回路で生成されたNADHとFADH2は、ミトコンドリア内膜に位置する呼吸鎖複合体(複合体I:NADH-ユビキノン酸化還元酵素、複合体II:コハク酸脱水素酵素、複合体III:シトクロムbc1複合体、複合体IV:シトクロムc酸化酵素)のうち、それぞれ複合体I及び複合体IIに電子を供与する。ユビキノン(コエンザイムQとも呼ばれる)は酸化還元活性を有する脂溶性の分子であり、複合体I、複合体IIにより還元されてユビキノールとなる。複合体IIIはユビキノールを酸化し、ヘムタンパク質の一種であり水溶性分子のシトクロムcを還元する。シトクロムcは複合体IVにより酸化され、酸素分子に電子を伝達することで水が生成される。この過程で放出されるエネルギーは、プロトン (H+) を膜間腔へ輸送するために使われ、H+濃度勾配が形成される。このH+濃度勾配に従って複合体V (ATP合成酵素複合体) を通しH+がマトリックスへ流入すると、そのエネルギーによって酸化的リン酸化反応が駆動される。複合体Vは時計回りに回転すると、ADPのリン酸化により細胞のエネルギー通貨であるATPを産生する一方、H+濃度勾配や膜電位が低下すると、ATPの加水分解を駆動力として複合体Vは逆回転し、H+を膜間腔へ押し出すことでH+濃度勾配や膜電位の回復に寄与する。定常時にこの逆回転反応はATPIF1 (ATPase inhibitor factor 1) により抑制されている。また、呼吸鎖複合体も細胞の環境に応じて電子伝達の逆回し(Reverse electron transport; RET)を行い、積極的に活性酸素種(reactive oxygen Species; ROS)を発生させることが知られる。
複合体IIを除くすべての呼吸鎖複合体は、核DNAとmtDNAの両方にコードされたサブユニットを持つ。複合体同士が会合し、スーパーコンプレックスが形成されることもある。さらに近年、呼吸鎖複合体構成タンパク質の一部は、脳や心臓などの非分裂細胞を含む組織において、非常にターンオーバーが遅く、数ヶ月以上残存する(長寿命タンパク質; Long-lived mitochondrial proteins; mt-LLPsである)ことが報告されている[1][2][3]1-3。
脂質合成
ミトコンドリアの脂質二重膜は400種類以上の脂質で構成されており、その中でもリン脂質の一種であるカルジオリピン (cardiolipin, CL) は、ミトコンドリアの特に内膜に存在する (図1)。カルジオリピンはホスファチジン酸 (PA) を前駆体として合成され、ホスファチジン酸は小胞体からミトコンドリア–小胞体接触部位 (mitochondria-endoplasmitic reticulum contact sites; MERCS) を介して輸送される。また、ミトコンドリア内膜ではホスファチジルエタノールアミンの合成も行われている。
カルジオリピンは、ミトコンドリア内膜のクリステ構造の形成を促し、呼吸鎖複合体などの膜タンパク質の触媒活性を維持する上で重要な役割を果たす。さらに、中枢神経系では、カルジオリピンの含量や構造、局在の異常が神経新生の障害や神経機能不全と関連し、アルツハイマー病やパーキンソン病をはじめとする複数の神経変性疾患の病態に関与すると考えられている[4]4。
カルシウムイオンの取り込み
ミトコンドリアは、マトリクス内にCa2+を取り込むことで、細胞質Ca2+濃度の調整を行う。ミトコンドリアのCa2+取り込みは、ミトコンドリア外膜に局在する電位依存性アニオンチャネル(VDAC; Voltage-dependent anion channel)と、内膜に局在するCa2+ユニポーター複合体によって制御される。Ca2+ユニポーター複合体は、2回膜貫通型タンパク質であるmitochondrial calcium uniporter (MCU)がオリゴマー化して形成するチャネル孔と、Mitochondrial calcium uptake (MICU)やessential MCU regulatory element (EMRE)などのサブユニットから構成される。Mitochondrial calcium uniporter複合体のCa2+親和性は非常に低く、多くの細胞においてmitochondrial calcium uniporterの開口にはミトコンドリア表面のCa2+濃度が10 µM以上に達する必要がある[5][6]5,6。通常、細胞質のCa2+濃度は約100 nMだが、小胞体膜上のイノシトール1,4,5-三リン酸受容体 (IP3R) やリアノジン受容体 (RyR) を介したCa2+放出により、小胞体近傍では局所的にCa2+の高濃度域帯が形成される。これにより、mitochondrial calcium uniporterの開口に十分なCa2+濃度が達成され、ミトコンドリアへのCa2+取り込みが促進される。したがって、ミトコンドリアと小胞体の接触は、ミトコンドリアのCa2+取り込みにおいて重要だと考えられている[7][8]7,8。
ミトコンドリアに取り込まれたCa2+は、TCA回路に関与する3つの脱水素酵素 (ピルビン酸デヒドロゲナーゼ (PDH)、イソクエン酸デヒドロゲナーゼ (IDH)、オキサロアセテートデヒドロゲナーゼ (OGDH)) を活性化し、電子伝達系によるATP産生を促進する。その後、主にNa+/Ca2+交換輸送体 (NCLX) によってCa2+はマトリックスから排出される。
興味深いことに、ニューロンではmitochondrial calcium uniporterの開口に必要なCa2+濃度の閾値が他の細胞よりも低いことが報告されている[9]9。これはMICU3のニューロン特異的な発現が関与していると考えられており、実際、MICU3を発現させたHEK細胞ではmitochondrial calcium uniporterの開口に必要なCa2+濃度の閾値が大幅に低下することが示されている。ミトコンドリアは、ニューロンの細胞膜電位の脱分極に伴いシナプス前終末へ流入するCa2+の緩衝に重要な役割を果たす。
アポトーシスの誘導
ミトコンドリアはシトクロムcの放出により、プログラム細胞死の一つであるアポトーシスの誘導の決定的な過程の場となっている。Bcl-2ファミリータンパク質BaxとBakはオリゴマー化しミトコンドリア外膜へ挿入された後、ミトコンドリア外膜に孔 (pore) を形成する。そして、ミトコンドリアのintermembrane space (IMS) からシトクロムC、Smac/DIABLO、プロテアーゼOmi/HtrA2、ヌクレアーゼEndoG、酸化還元酵素アポトーシス誘導因子 (AIF)の細胞質への放出を担う。このBax/Bakポアの形成は、栄養飢餓、DNA損傷、小胞体ストレス等の刺激に依存したホスファチジルイノシトール3キナーゼ (PI3K)-Akt経路の不活性化、c-Jun N-terminal kinase (JNK) の活性化などにより制御される。放出されたシトクロムcはApaf-1と結合してアポプトソームを形成し、イニシエーターカスパーゼであるカスパーゼ-9を活性化する。カスパーゼ-9はエフェクターカスパーゼであるカスパーゼ-3やカスパーゼ-7を活性化してアポトーシスが誘導される。
シトクロムcの放出はミトコンドリア外膜上でのBax/Bakによるポア形成に加えて、クリステの再構成や電子伝達系の不安定化によっても促進される。ミトコンドリア膜電位の脱分極に応答して、OMA1プロテアーゼがOpa1を分解し、クリステ再構成を促進し、シトクロムcの放出を促進することが示唆されている[10]。興味深いことに、Opa1はニューロンの成熟に伴って発現が増加し神経保護作用を持つことが示されており、ニューロンにおいてもOpa1を介したクリステ再構成がシトクロムc放出、引いてはアポトーシス制御に関わると考えられる。
多くの細胞種では、シトクロムc放出は不可逆的にアポトーシスを誘導するが、交感神経ニューロンではBH3-onlyタンパク質の過剰発現やシトクロムcのmicroinjectionではアポトーシスが誘導されないことから、一部のニューロンではシトクロムc放出はアポトーシス誘導に十分ではない[11][12][13]。交感神経ニューロンは、神経成長因子 (nerve growth factor, NGF) の存在下で生存が維持され、神経成長因子の除去によりアポトーシスが誘導される。神経成長因子の除去によりシトクロムcが放出されても、ミトコンドリア膜電位が失われる前に神経成長因子を再添加するとニューロンは生存するが、膜電位が失われた後に神経成長因子を再添加してもニューロンの生存は回復されない。このことから、交感神経ニューロンにおけるアポトーシス誘導の可逆性の閾値は、シトクロムc放出ではなくミトコンドリア膜電位の脱分極が決定すると考えられる。
また、シトクロムc放出後にニューロンが膜電位を維持するメカニズムとして、電子伝達系を逆方向に動かす経路が働いていることが知られている。神経成長因子の除去に応答してアポトーシスを開始したニューロンは、酸化的リン酸化ではなく解糖系に依存してATP産生を行う。このATPは通常の細胞機能維持だけでなく、電子伝達系 (複合体V) を逆方向に動かし、プロトン勾配を生成し短期的ではあるがミトコンドリア膜電位の維持に働く[14]。このようにして、交感神経ニューロンはアポトーシス誘導の可逆性の閾値を遅らせることを可能にしている。
さらに、ニューロンがシトクロムcに抵抗性を示す他のメカニズムとして、シトクロムcの酸化還元状態の制御とシトクロムcの分解制御の2つが考えられている。シトクロムcには酸化型と還元型があり、酸化型シトクロムcは還元型よりも強力にカスパーゼを活性化する。健常なニューロンは高度に解糖的であり、ペントースリン酸経路へのグルコース-6-リン酸のフラックスによって高レベルのグルタチオン(GSH)が生成され、細胞内環境を還元状態に保っている。その結果、ミトコンドリアから放出されたシトクロムcは還元型で不活性化され、カスパーゼを活性化できない[15]15。アポトーシス時にはROSの増加により細胞内環境が酸化的になり、シトクロムc依存のカスパーゼ活性化が促進される[15][16][17][18]。GSHはミトコンドリアからのシトクロムc放出の抑制など複数の機構を介してアポトーシスを制御しており、上述のシトクロムcの酸化還元状態を介したカスパーゼ活性化の抑制も、その重要な機構の一つと考えられる。さらに、シトクロムcの酸化還元状態による不活性化に加え、ニューロンは細胞質内シトクロムcを分解する機構を有し、シトクロムcはE3ユビキチンリガーゼCul9/Parcによって分解される[19]。
動態
生合成経路
ミトコンドリアの生合成は、ミトコンドリア局在タンパク質および脂質の供給、ならびにミトコンドリアDNAの複製を伴う複雑なプロセスである。ニューロンにおいては、ミトコンドリアの生合成は主に細胞体において行われるが、軸索内における生合成の存在も報告されている[20]。ミトコンドリアには約1,000-1,500種類のタンパク質が存在するとされ、その大部分は核ゲノムにコードされている。一方、電子伝達系を構成する13種類のタンパク質はミトコンドリアDNAにコードされており、これら核ゲノムとミトコンドリアDNAにコードされたタンパク質の発現が協調して制御されることにより、ミトコンドリアの生合成が行われる。この制御機構には、転写共役因子PGC1-αの活性化により、転写因子NRF-1およびNRF-2による核ゲノムにコードされたミトコンドリアタンパク質の遺伝子発現を増強させる経路が中心的な役割を果たす。ニューロンにおいてはAMP依存性プロテインキナーゼ (AMPK)の活性化や、脳由来神経栄養因子 (BDNF)によるcAMP応答配列結合タンパク質 (CREB)のリン酸化などがペルオキシソーム増殖因子活性化受容体γコアクチベーター1α(peroxisome proliferator-activated receptor gamma coactivator 1-α, PGC1-α)の発現量を増加させることが知られる一方[20]20、アストロサイト成熟の際には代謝活性型グルタミン酸受容体5 (mGluR5)の活性化がPGC1-αの発現量を増加させる[21]21。
分裂・融合
ミトコンドリアは非常にダイナミックなオルガネラであり、分裂と融合を繰り返している。ミトコンドリア融合は3つのGTPase、外膜局在のmitofusin(Mfn1、Mfn2)と内膜局在のoptic atrophy 1 (OPA1) によって制御されている。Mfn1とMfn2は隣接するミトコンドリア上で協調的に働き、外膜同士を繋留する。GTP加水分解により外膜が融合し、その後OPA1によって内膜の融合が進行する。一方、ミトコンドリア分裂はdynamin-related protein 1 (Drp1) によって担われる。Drp1はGTP結合型になると、細胞質からミトコンドリア外膜の分裂部位にリクルートされ、外膜に集積して多量体を形成する。その後、リング状構造を作り、GTPase活性を利用してミトコンドリアを分裂させる。Fission 1 protein (Fis1)やmitochondrial fission factor (Mff)、mitochondrial dynamics protein of 49 kDa/51 kDa (Mid49/51)といった外膜局在タンパク質は、Drp1のミトコンドリアへのリクルートに関与するDrp1受容体として知られている。
ニューロンの軸索と樹状突起で、ミトコンドリアは異なる形態を示す[22][23][24][25]。これは区画特異的な分裂・融合制御の結果だと考えられており、軸索ではMffが、樹状突起ではFis1がそれぞれ選択的にミトコンドリア形態の決定と維持に重要であることが報告されている[26][27]。また、神経活動や長期増強現象 (LTP)誘導時にミトコンドリアの分裂が促進されることが知られており、成熟したニューロンにおいても可塑的にその形態を変化させ神経伝達制御に寄与する。
分解
膜電位の低下・喪失など機能低下したミトコンドリアはオートファゴソーム膜によって隔離されリソソームによって分解される (マイトファジー)。ショウジョウバエやパーキンソン病患者の逆遺伝学的な解析から、ParkinおよびPTEN-induced putative kinase 1 (Pink1) 遺伝子がマイトファジーにおいて中心的な役割を担うことが明らかになった。ミトコンドリアに局在するキナーゼであるPink1タンパク質は膜電位の低下等により活性化し、E3ユビキチンリガーゼであるParkinやユビキチンをリン酸化する。リン酸化されて活性化したParkinはミトコンドリア外膜上のタンパク質にユビキチン化修飾を施し、optineurin (OPTN)、nuclear dot protein 52 kDa (NDP52)、Tax1 binding protein 1 (TAX1BP1)などのオートファジーのアダプタータンパク質を呼び込む。Pink1タンパク質の活性化機構として、通常はミトコンドリア内膜に輸送されて切断を受け細胞質のプロテアソームによって分解されて低いレベルに保たれているが、膜電位の低下によりPink1の切断が行われず外膜に蓄積するというモデルが提唱されている[28]。
一方、マイトファジーレポーターであるmito-QCマウスを用いた組織学的な解析から、発達期や若年齢から特にエネルギー需要の高い心臓や脳などの組織では定常的にマイトファジーが起きていることが分かってきた。興味深いことに、この生理的な条件下で起きるマイトファジーはParkinをノックアウトしたマウスのドーパミン産生ニューロンにおいて減少しなかった[29]。このことから、生理的な条件下ではPink1-Parkin非依存的なマイトファジー経路がミトコンドリアの品質管理に働く可能性が示唆されている。培養細胞等を用いた研究からmicrotubule-associated protein 1 light chain 3 (LC3)と結合しオートファゴソーム膜を誘導するレセプターがいくつか知られているが[30][31]、ニューロンにおけるそれら因子の働きについては未だよく分かっていない。
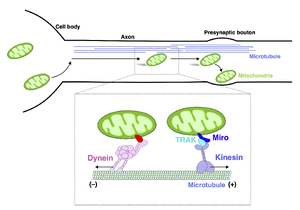
軸索において、ミトコンドリアは微小管上をモータータンパク質により能動的に輸送される。軸索の微小管は、細胞体から軸索遠位部方向に(-)端から(+)端へ決まった配向で伸展する。細胞体から軸索遠位部への輸送 (anterograde transport)、軸索遠位部から細胞体への輸送 (retrograde transport) はそれぞれモータータンパク質であるキネシン、ダイニンによって担われる。Miro, TRAKタンパク質はミトコンドリア外膜に局在し、ミトコンドリアを選択的にキネシンモータータンパク質にアンカーさせる。ニューロン成熟に伴い、ミトコンドリアはシナプス前部領域近傍においてモータータンパク質から離れ、安定的に局在するようになる。
輸送機構
ミトコンドリアは分裂、融合を繰り返しながら移動を繰り返し、エネルギー需要等に応じて目的の細胞区画に輸送される。特に、数十cmから1 mにも及ぶ軸索では、ミトコンドリアは神経突起の発達に伴って長距離を活発に輸送される (図3)。一方で、成熟したニューロンにおいては、軸索、樹状突起双方でミトコンドリアのダイナミクスは大きく低下する[32][33]。未成熟なマウス皮質由来のニューロンでは、およそ70%ものミトコンドリアが動的な挙動を示す (motile mitochondria) のに対し、成熟したニューロンにおいてはその割合はおよそ10%程度まで低下する。成熟した海馬由来のニューロンにおいて、その移動速度はおよそ0.2-2 µm/secと計測されている[34]。細胞体からシナプス前部 (順行性輸送; anterograde transport)、またシナプス前部から細胞体への輸送 (逆行性輸送; retrograde transport) の長距離の移動においては、他のカーゴ(オルガネラ、膜小胞)と同様にモータータンパク質であるキネシン、ダイニンタンパク質に乗り微小管上を輸送される (図3)。モータータンパク質は、ミトコンドリア以外の様々なカーゴの運搬にも用いられる共通の装置であり、ミトコンドリアを選択的に輸送するための分子装置が存在する。Trafficking kinesin-binding proteins (TRAK) タンパク質 (ショウジョウバエにおいてはMiltonとして知られる) はkinesin heavy chain isoform 5 (KIF5) 及びダイニンと相互作用し、ミトコンドリア輸送に働く[35][36]。ミトコンドリア外膜上ミトコンドリアとモータータンパク質の繋留はmitochondrial Rho GTPases (MIROs) によって制御される[37]。
上述の通り、成熟したニューロンにおいてミトコンドリアは主にシナプス前部近傍において移動速度が低下し安定的に局在する。MIROタンパク質は2つのGTPaseドメインと、それらに挟まれたCa2+結合能を有する2つのEF-hand motif、C末端にミトコンドリア外膜と結合するドメインを有す。シナプス前部において神経活動に依存したCa2+流入によりMIROのEF-hand motifが構造変化し、ミトコンドリアがモータータンパク質から外れることでシナプス前部に局在するというモデルが提唱されている[38]。
一方で、in vivoにおける二光子顕微鏡を用いた研究では自発的なCa2+ transientと樹状突起ミトコンドリアの移動性には正の相関がないという報告もあり議論が分かれている[39]。また、シナプス前部へミトコンドリアを繋留する因子としてSyntaphilinタンパク質が同定されており[40]、シグナル伝達経路として、liver kinase B1 (LKB1)-NUAK family SNF1-like kinase (NUAK)を介したキナーゼカスケードの必要性も示されている[41]41。さらに、細胞外の栄養状態に応じてミトコンドリアの動態が変化することも知られており、グルコースがミトコンドリアの移動制御に関わる可能性が示唆されている[42]42。TRAK1タンパク質はO-linked N-acetylglucosamine (O-GlcNAc) transferase 110 kDa subunit (OGT)と複合体を組み、O-GlcNAc修飾を受ける。細胞外のグルコース濃度の上昇によりTRAK1のO-GlcNAc修飾量が増加しミトコンドリアの繋留が起きる。
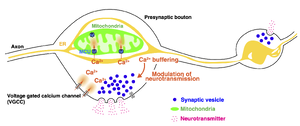
大脳皮質グルタミン酸作動性ニューロンのシナプス前部において、ミトコンドリアは粒状の構造をとり、その多くがシナプス前部近傍に局在する。シナプス前部のミトコンドリアは神経活動時に細胞質からカルシウムイオンを取り込み、シナプス小胞のエキソサイトーシスを抑制する。ミトコンドリア外膜にはミトコンドリアPorinであるVDAC (Voltage-dependent anion channels) が存在し5 kDa程度以下の様々な物質を透過する。そのため、外膜のカルシウムイオンの透過率は非常に高く、IMSにおけるカルシウムイオン濃度は細胞質とほとんど変わらない。ミトコンドリアへのカルシウムイオンの取り込みは、ミトコンドリアの内膜に存在するトランスポータであるmitochondrial calcium uniporter (Mitochondria Calcium Uniporter) 複合体によって制御される。ニューロンにおいてはmitochondrial calcium uniporterのアクセサリータンパク質であるMICU3の発現が高く、比較的低い細胞質Ca2+濃度においてもmitochondrial calcium uniporterが開口し、細胞質Ca2+がミトコンドリアへと取り込まれる。
機能
シナプス前部
マウス大脳のグルタミン酸作動性ニューロンでは、軸索に存在するミトコンドリアのうち半分程度はシナプス前部に局在する。一方で全てのシナプス前終末にミトコンドリアが局在するわけではなく、およそ50%のシナプス前終末にミトコンドリアが局在している。シナプス前終末におけるミトコンドリア繋留メカニズムとして様々なシグナル経路やタンパク質が同定されているが、ミトコンドリア局在と非局在のシナプス前終末がどのようなメカニズムで作られるのかは未だ明らかでない。
シナプス前終末におけるミトコンドリアの役割として、神経発火と共に上昇した細胞質Ca2+の取り込みが明らかになっている[26][43][44] (図4)。ミトコンドリアへのカルシウムイオン流入はミトコンドリアの内膜に局在するmitochondrial calcium uniporter が担うが、mitochondrial calcium uniporterの開口は細胞質側のCa2+濃度に依存する。軸索のミトコンドリアはmitochondrial calcium uniporterのアクセサリータンパク質であるmitochondrial calcium uptake family member 3 (MICU3)を多く発現しているため、比較的低い細胞質Ca2+濃度においてもmitochondrial calcium uniporterが開口し、細胞質Ca2+がミトコンドリアへと取り込まれる。細胞質Ca2+が取り込まれた結果、ミトコンドリア局在シナプス前終末においてはシナプス小胞の開口放出が抑制されることが明らかになっている[9]。
シナプス前終末における、開口放出とそれに伴うエンドサイトーシス、シナプス小胞への神経伝達物質の再充填はATP消費が非常に大きな過程である[45]45。ミトコンドリアにおけるATP産生がこの過程に必須であると考えられて来た一方で、ミトコンドリア局在、非局在シナプス前終末の間でATP量に大きな差が見られないこと[46]、マウス大脳皮質・海馬由来ニューロンの機能維持には解糖系によるATP産生が主要な役割を果たすことなどが報告されている。したがって、ミトコンドリアにおけるATP産生のシナプス前終末における開口放出への寄与については未だ議論が続いている。
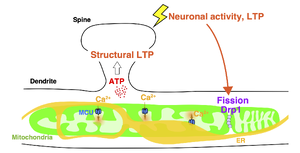
大脳皮質グルタミン酸作動性ニューロンのシナプス後部において、ミトコンドリアは細長いチューブ状の構造を示す。神経活動やシナプスの長期増強によりDynamin-related protein 1に依存したミトコンドリアの分裂が促進する。これら形態変化は、ミトコンドリアによるATP産生を促進すると考えられており、樹状突起ミトコンドリアのATP産生はスパインの構造的可塑性誘導に必要であることが示唆されている。また、樹状突起ミトコンドリアは、ミトコンドリア–小胞体接触部位を介して小胞体から放出されるカルシウムイオンを取り込む。接触部位形成を阻害すると細胞質のカルシウムイオン濃度が上昇することから、ミトコンドリアによるカルシウムイオン取り込みは、細胞質カルシウム濃度の調節に寄与する。
シナプス後部
樹状突起においても、ニューロンの発達に伴ってミトコンドリアの運動性が徐々に低下することが観察されている[47][48]。このミトコンドリア運動性の制御は樹状突起の発達に重要であると考えられ、実際に、発達期のマウス大脳皮質興奮性ニューロンにおいてミトコンドリアの運動性を人為的に変え、細胞体から近位の領域にミトコンドリアを留めると樹状突起の発達が過剰になる[49]。
樹状突起のミトコンドリアは軸索ミトコンドリアと異なり神経突起の形態に添った細長い形状を示し、成熟したニューロンの樹状突起ではミトコンドリアはアクチンや微小管などの細胞骨格タンパク質にアンカーして安定的に局在する。樹状突起のミトコンドリアはスパインの構造的長期増強 (structural LTP) における新規タンパク質合成に必要なATPを供給する[50]50 (図5)。
また、樹状突起のミトコンドリアは神経活動や長期増強現象などのシナプス可塑性に依存して可塑的にその形態を変化させる。薬理学的に誘導するシナプス長期増強 (chemical LTP) の誘導による細胞質Ca2+濃度の増加がDrp1によるミトコンドリア分裂およびミトコンドリア内のCa2+濃度の増加を誘導し、このミトコンドリア分裂がスパインの構造変化を伴うシナプス長期増強 (structural LTP) に必要であることが示されている[51]51 (図5)。CA1錐体細胞では樹状突起内のapical tuftとapical oblique, basal dendriteの樹状突起内のサブコンパートメント間でミトコンドリア形態が異なっており、これは活動依存的なCa2+およびCamkk2依存的なAMPKの活性化によって制御されることが示されている[52]52。
神経幹細胞
胎生期のマウス大脳皮質由来神経前駆細胞 (neural precursor cells, NPCs) や成体海馬神経幹細胞 (neural stem cells, NSCs) において、ニューロン分化に伴いミトコンドリアの形態が変化することが示されている[53][54]。大脳皮質神経前駆細胞ではミトコンドリアは細長いが、中間型前駆細胞 (intermediate progenitor cell; IPCs) への分化時に断片化し、その後、ニューロンへの分化に伴い再び細長くなる[54]。成体海馬神経幹細胞では、電子顕微鏡を用いたより高解像度のミトコンドリア形態解析が行われており、神経幹細胞では小さなミトコンドリアが、ニューロン分化に伴い細長い形状を取るようになる[53]。このミトコンドリアの形態変化は神経幹細胞の運命制御に重要な役割を果たすと考えられており、ミトコンドリアの形態制御に関わるOPA1の機能阻害により、胎生期大脳皮質神経前駆細胞の未分化性が失われ早熟なニューロン分化が起きる。また、成体海馬神経幹細胞においても、MFN1/2の機能欠損により、神経幹細胞の数が低下し、神経新生が低下する[54]54。
一方、胎生期大脳皮質神経前駆細胞や成体海馬神経幹細胞がニューロンへと分化する際、解糖系依存型からミトコンドリアの酸化的リン酸化依存型へと代謝のスイッチが起こる[55]。ミトコンドリアの酸化的リン酸化は、反応の副産物として活性酸素種ROSを産生し、実際に大脳皮質神経前駆細胞において低レベルに抑えられているROSはニューロン分化に伴い増加する。ROSは転写因子の一つであるNuclear factor erythroid 2 (NRF2) の安定化を促進し、核内移行したNRF2はニューロン分化関連遺伝子の転写を活性化し、ニューロン分化を促進する[54]。また、成体海馬においてmtDNAの複製、安定化に関わるタンパク質transcription factor A, mitochondrial (TFAM)をノックアウトすると、中間型前駆細胞の生存、増殖が低下し成体神経新生に異常が生じる[53]。mtDNAは酸化的リン酸化を担う呼吸鎖複合体 の一部をコードすることから、ミトコンドリアの酸化的リン酸化によるエネルギー産生が神経幹細胞のニューロン分化に重要な役割を担うことが示唆されている。このような神経幹細胞のニューロン分化に伴う代謝のスイッチはミトコンドリアの形態変化と相関して起きることから、ミトコンドリアの形態変化が、ミトコンドリアの酸化的リン酸化依存型代謝への移行を介してニューロン分化を促進する可能性が考えられる。
グリア細胞
アストロサイト
アストロサイトの分化過程では一過的なミトコンドリア生合成の上昇とそれに伴う酸化的リン酸化の上昇、解糖系の低下が起こる。これらはアストロサイト前駆細胞からアストロサイトへの分化に必要である[21]。成熟したアストロサイトは細い突起をシナプス付近に伸ばし、シナプス制御に重要な役割を果たす。これらの突起中にミトコンドリアは積極的に輸送されること、そこでATP産生やカルシウムの吸収・放出、グルタミン酸の代謝などに重要な役割を果たすことが知られている[56]56。
オリゴデンドロサイト
軸索をwrappingするミエリン鞘の形成、維持には脂質(コレステロール、リン脂質、糖スフィンゴ脂質)供給が必要となり、膨大なATPを要する。およそ1 gのミエリンを形成するのに約3.3×10²³個のATP分子が必要であると見積もられている[57]。このミエリン産生時期に必要な膨大なATPは主にミトコンドリアの酸化的リン酸化により担われると考えられている。実際に、ミエリン発達期のオリゴデンドロサイトにおいて、呼吸鎖複合体複合体IVの構成因子であるヘムAの生合成に重要なCox10遺伝子 (heme A:farnesyltransferase gene) のノックアウトにより顕著なミエリン形成異常が起きる。一方、ミエリン形成後におけるCox10のノックアウトではミエリンや軸索機能異常は見られなかった[58]58。このことから、オリゴデンドロサイト前駆細胞 (oligodendrocyte precursor cell; OPC) やミエリン形成を担うオリゴデンドロサイトはミトコンドリア呼吸鎖複合体によるATP産生に依存する一方で、成熟したオリゴデンドロサイトは解糖系に依存し、エネルギー代謝経路のスイッチングが起きると考えられている。このオリゴデンドロサイトの成熟におけるエネルギー代謝経路のスイッチングと一致して、オリゴデンドロサイトの成熟に伴いミトコンドリア形態や密度も変化することが知られている[57]。未成熟なオリゴデンドロサイトでは長いミトコンドリアが多い一方、成熟したオリゴデンドロサイトではミトコンドリアは短い断片化した形態を示し突起部に存在する。また、長年、中枢神経系のミエリンにはミトコンドリアが存在しないと考えられてきたが、近年、ミエリンにもミトコンドリアが存在することが確認され[59][60][61]、一次突起の3分の1程度の密度ではあるが細胞質チャネルやパラノード領域に存在する。このミエリンにおけるミトコンドリアの役割についてはあまり分かっていないが、Ca2+シグナルや脂質合成の制御に関わる可能性が示唆されている。
他オルガネラとの相互作用
電子顕微鏡を用いた観察により1980年代頃から、ニューロンにおいてミトコンドリアが小胞体と接触していることが報告されてきた[62][63][64][65][66]62-66。3次元電子顕微鏡画像の解析から、ニューロンのすべてのコンパートメントに広範なミトコンドリア–小胞体接触部位が存在することも明らかになっている (図4、5)。ミトコンドリア–小胞体接触のニューロンにおける主要な役割の一つは小胞体からミトコンドリアへのCa2+輸送である。上述のようにミトコンドリア内膜に存在するCa2+チャネルmitochondrial calcium uniporterの開口には通常、ミトコンドリア表面における10 µM以上のCa2+濃度を必要とする。細胞質のCa2+濃度がmitochondrial calcium uniporterの開口に必要なレベルに達するのは、小胞体内に蓄積された高濃度(数百µM)のCa2+が、IP₃受容体やリアノジン受容体を介して放出された際の小胞体近傍のみである。したがって、ミトコンドリアが小胞体と10-30 nmの距離にある接触部位に限局して、ミトコンドリア表面の局所的なCa2+濃度がmitochondrial calcium uniporterの活性化閾値を上回るレベルにまで上昇し、ミトコンドリアにCa2+が取り込まれる (図5)。
疾患との関わり
パーキンソン病
パーキンソン病とミトコンドリアの関連が初めて明らかになったのは1980年代初頭からである。オピオイドの違法合成の過程でできた副産物1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン (MPTP)を摂取した薬物依存者がパーキンソン様症状を示したことが発端である。MPTPは酸化されてMPP+となり、ドーパミントランスポーターを通じてドーパミンニューロンに取り込まれ、ミトコンドリアに蓄積して電子伝達系の複合体Iの活性を阻害する。1998年にパーキンソン病の原因遺伝子としてミトコンドリア局在タンパク質であるParkin遺伝子がクローニングされ、機能低下したミトコンドリアが蓄積することでドーパミンニューロンの脱落を引き起こすと考えられている。Parkinのみをノックアウトしたマウスで大きな表現型は見られないが、mtDNAの複製に働くDNA polymerase gamma, catalytic subunit (POLG)のDNA複製の校正機能に異常を来した変異体マウスとParkinノックアウトマウスを交配したマウスでは、中脳黒質におけるドーパミンニューロンの細胞死、mtDNAの変異蓄積、ミトコンドリア呼吸鎖の低下が見られる[67]67。
アルツハイマー病
アルツハイマー病患者の脳ではグルコース代謝、酸素消費量が低下していることから、ミトコンドリアの機能異常がアルツハイマー病の発症に寄与する可能性が考えられている。また、ミトコンドリア機能異常とアルツハイマー病発症との関連を示すより直接的な証拠として、アルツハイマー病罹患者の死後脳の電子顕微鏡観察から、ミトコンドリアのサイズ低下やクリステ構造の異常が観察されている[68]68。さらに、アルツハイマー病罹患者においてピルビン酸脱水素酵素やα-ケトグルタル酸脱水素酵素複合体の活性低下が見られることから、ミトコンドリアのATP産生能低下がアルツハイマー病発症につながる可能性が考えられている[69]69。
多発性硬化症
多発性硬化症は、中枢神経(脳・脊髄)や視神経で起きる脱髄性の神経変性疾患である。病変部位の周囲に異常活性化したミクログリアを初めとするミエロイド系の細胞が蓄積し、腫瘍壊死因子 (tumor necrosis factor; TNF)、インターロイキン1β (IL-1β)、一酸化窒素やROSを慢性的に放出することで髄鞘の再形成阻害、神経細胞や軸索の障害を引き起こすと考えられている。多発性硬化症の発症機序において、これまで主にオリゴデンドロサイトやニューロンにおけるミトコンドリア機能異常が注目されてきた。一方、近年の研究により、ミクログリアにおいて呼吸鎖複合体を介した電子伝達が逆方向に流れる電子伝達の逆回し(reverse electron transport; RET) が生じ、複合体IIから複合体Iへ電子が逆行することで大量のROSが生成されることが明らかとなっている。これにより、ミクログリアの異常活性化に伴う慢性炎症が多発性硬化症の病態進行に寄与する可能性が示唆されるとともに、ミクログリアにおける複合体I活性の選択的抑制による新規治療戦略の有望性が提示された[70]70。
関連項目
参考文献
- ↑
Bomba-Warczak, E., Edassery, S.L., Hark, T.J., & Savas, J.N. (2021).
Long-lived mitochondrial cristae proteins in mouse heart and brain. The Journal of cell biology, 220(9). [PubMed:34259807] [PMC] [WorldCat] [DOI] - ↑
Krishna, S., Arrojo E Drigo, R., Capitanio, J.S., Ramachandra, R., Ellisman, M., & Hetzer, M.W. (2021).
Identification of long-lived proteins in the mitochondria reveals increased stability of the electron transport chain. Developmental cell, 56(21), 2952-2965.e9. [PubMed:34715012] [PMC] [WorldCat] [DOI] - ↑
Li, W., Dasgupta, A., Yang, K., Wang, S., Hemandhar-Kumar, N., Chepyala, S.R., ..., & Liu, Y. (2025).
Turnover atlas of proteome and phosphoproteome across mouse tissues and brain regions. Cell, 188(8), 2267-2287.e21. [PubMed:40118046] [PMC] [WorldCat] [DOI] - ↑
Falabella, M., Vernon, H.J., Hanna, M.G., Claypool, S.M., & Pitceathly, R.D.S. (2021).
Cardiolipin, Mitochondria, and Neurological Disease. Trends in endocrinology and metabolism: TEM, 32(4), 224-237. [PubMed:33640250] [PMC] [WorldCat] [DOI] - ↑
Gunter, T.E., Gunter, K.K., Sheu, S.S., & Gavin, C.E. (1994).
Mitochondrial calcium transport: physiological and pathological relevance. The American journal of physiology, 267(2 Pt 1), C313-39. [PubMed:8074170] [WorldCat] [DOI] - ↑
Bragadin, M., Pozzan, T., & Azzone, G.F. (1979).
Kinetics of Ca2+ carrier in rat liver mitochondria. Biochemistry, 18(26), 5972-8. [PubMed:42437] [WorldCat] [DOI] - ↑
Giacomello, M., Drago, I., Bortolozzi, M., Scorzeto, M., Gianelle, A., Pizzo, P., & Pozzan, T. (2010).
Ca2+ hot spots on the mitochondrial surface are generated by Ca2+ mobilization from stores, but not by activation of store-operated Ca2+ channels. Molecular cell, 38(2), 280-90. [PubMed:20417605] [WorldCat] [DOI] - ↑
Csordás, G., Várnai, P., Golenár, T., Roy, S., Purkins, G., Schneider, T.G., ..., & Hajnóczky, G. (2010).
Imaging interorganelle contacts and local calcium dynamics at the ER-mitochondrial interface. Molecular cell, 39(1), 121-32. [PubMed:20603080] [PMC] [WorldCat] [DOI] - ↑ 9.0 9.1
Ashrafi, G., de Juan-Sanz, J., Farrell, R.J., & Ryan, T.A. (2020).
Molecular Tuning of the Axonal Mitochondrial Ca2+ Uniporter Ensures Metabolic Flexibility of Neurotransmission. Neuron, 105(4), 678-687.e5. [PubMed:31862210] [PMC] [WorldCat] [DOI] - ↑
Jiang, X., Jiang, H., Shen, Z., & Wang, X. (2014).
Activation of mitochondrial protease OMA1 by Bax and Bak promotes cytochrome c release during apoptosis. Proceedings of the National Academy of Sciences of the United States of America, 111(41), 14782-7. [PubMed:25275009] [PMC] [WorldCat] [DOI] - ↑
Deshmukh, M., & Johnson, E.M. (1998).
Evidence of a novel event during neuronal death: development of competence-to-die in response to cytoplasmic cytochrome c. Neuron, 21(4), 695-705. [PubMed:9808457] [WorldCat] [DOI] - ↑
Deshmukh, M., Kuida, K., & Johnson, E.M. (2000).
Caspase inhibition extends the commitment to neuronal death beyond cytochrome c release to the point of mitochondrial depolarization. The Journal of cell biology, 150(1), 131-43. [PubMed:10893262] [PMC] [WorldCat] [DOI] - ↑
Martinou, I., Desagher, S., Eskes, R., Antonsson, B., André, E., Fakan, S., & Martinou, J.C. (1999).
The release of cytochrome c from mitochondria during apoptosis of NGF-deprived sympathetic neurons is a reversible event. The Journal of cell biology, 144(5), 883-9. [PubMed:10085288] [PMC] [WorldCat] [DOI] - ↑
Chang, L.K., Schmidt, R.E., & Johnson, E.M. (2003).
Alternating metabolic pathways in NGF-deprived sympathetic neurons affect caspase-independent death. The Journal of cell biology, 162(2), 245-56. [PubMed:12876275] [PMC] [WorldCat] [DOI] - ↑ 15.0 15.1
Vaughn, A.E., & Deshmukh, M. (2008).
Glucose metabolism inhibits apoptosis in neurons and cancer cells by redox inactivation of cytochrome c. Nature cell biology, 10(12), 1477-83. [PubMed:19029908] [PMC] [WorldCat] [DOI] - ↑
Greenlund, L.J., Deckwerth, T.L., & Johnson, E.M. (1995).
Superoxide dismutase delays neuronal apoptosis: a role for reactive oxygen species in programmed neuronal death. Neuron, 14(2), 303-15. [PubMed:7857640] [WorldCat] [DOI] - ↑
Kirkland, R.A., Windelborn, J.A., Kasprzak, J.M., & Franklin, J.L. (2002).
A Bax-induced pro-oxidant state is critical for cytochrome c release during programmed neuronal death. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(15), 6480-90. [PubMed:12151527] [PMC] [WorldCat] [DOI] - ↑
Kirkland, R.A., & Franklin, J.L. (2001).
Evidence for redox regulation of cytochrome C release during programmed neuronal death: antioxidant effects of protein synthesis and caspase inhibition. The Journal of neuroscience : the official journal of the Society for Neuroscience, 21(6), 1949-63. [PubMed:11245680] [PMC] [WorldCat] [DOI] - ↑
Gama, V., Swahari, V., Schafer, J., Kole, A.J., Evans, A., Huang, Y., ..., & Deshmukh, M. (2014).
The E3 ligase PARC mediates the degradation of cytosolic cytochrome c to promote survival in neurons and cancer cells. Science signaling, 7(334), ra67. [PubMed:25028717] [PMC] [WorldCat] [DOI] - ↑ 20.0 20.1
Cardanho-Ramos, C., & Morais, V.A. (2021).
Mitochondrial Biogenesis in Neurons: How and Where. International journal of molecular sciences, 22(23). [PubMed:34884861] [PMC] [WorldCat] [DOI] - ↑ 21.0 21.1
Zehnder, T., Petrelli, F., Romanos, J., De Oliveira Figueiredo, E.C., Lewis, T.L., Déglon, N., ..., & Bezzi, P. (2021).
Mitochondrial biogenesis in developing astrocytes regulates astrocyte maturation and synapse formation. Cell reports, 35(2), 108952. [PubMed:33852851] [WorldCat] [DOI] - ↑
Popov, V., Medvedev, N.I., Davies, H.A., & Stewart, M.G. (2005).
Mitochondria form a filamentous reticular network in hippocampal dendrites but are present as discrete bodies in axons: a three-dimensional ultrastructural study. The Journal of comparative neurology, 492(1), 50-65. [PubMed:16175555] [WorldCat] [DOI] - ↑
Chang, D.T.W., & Reynolds, I.J. (2006).
Differences in mitochondrial movement and morphology in young and mature primary cortical neurons in culture. Neuroscience, 141(2), 727-736. [PubMed:16797853] [WorldCat] [DOI] - ↑
Lee, A., Hirabayashi, Y., Kwon, S.K., Lewis, T.L., & Polleux, F. (2018).
Emerging roles of mitochondria in synaptic transmission and neurodegeneration. Current opinion in physiology, 3, 82-93. [PubMed:30320242] [PMC] [WorldCat] [DOI] - ↑
Turner, N.L., Macrina, T., Bae, J.A., Yang, R., Wilson, A.M., Schneider-Mizell, C., ..., & Seung, H.S. (2022).
Reconstruction of neocortex: Organelles, compartments, cells, circuits, and activity. Cell, 185(6), 1082-1100.e24. [PubMed:35216674] [PMC] [WorldCat] [DOI] - ↑ 26.0 26.1
Lewis, T.L., Kwon, S.K., Lee, A., Shaw, R., & Polleux, F. (2018).
MFF-dependent mitochondrial fission regulates presynaptic release and axon branching by limiting axonal mitochondria size. Nature communications, 9(1), 5008. [PubMed:30479337] [PMC] [WorldCat] [DOI] - ↑ Strucinska, K. et al. (2025).
Fis1 is required for the development of the dendritic mitochondrial network in pyramidal cortical neurons. bioRxiv (2025). https://doi.org/10.1101/2025.01.07.631801 - ↑
Narendra, D.P., & Youle, R.J. (2024).
The role of PINK1-Parkin in mitochondrial quality control. Nature cell biology, 26(10), 1639-1651. [PubMed:39358449] [WorldCat] [DOI] - ↑
McWilliams, T.G., Prescott, A.R., Montava-Garriga, L., Ball, G., Singh, F., Barini, E., ..., & Ganley, I.G. (2018).
Basal Mitophagy Occurs Independently of PINK1 in Mouse Tissues of High Metabolic Demand. Cell metabolism, 27(2), 439-449.e5. [PubMed:29337137] [PMC] [WorldCat] [DOI] - ↑
Onishi, M., Yamano, K., Sato, M., Matsuda, N., & Okamoto, K. (2021).
Molecular mechanisms and physiological functions of mitophagy. The EMBO journal, 40(3), e104705. [PubMed:33438778] [PMC] [WorldCat] [DOI] - ↑
Uoselis, L., Nguyen, T.N., & Lazarou, M. (2023).
Mitochondrial degradation: Mitophagy and beyond. Molecular cell, 83(19), 3404-3420. [PubMed:37708893] [WorldCat] [DOI] - ↑
Lewis, T.L., Turi, G.F., Kwon, S.K., Losonczy, A., & Polleux, F. (2016).
Progressive Decrease of Mitochondrial Motility during Maturation of Cortical Axons In Vitro and In Vivo. Current biology : CB, 26(19), 2602-2608. [PubMed:27641765] [PMC] [WorldCat] [DOI] - ↑
Smit-Rigter, L., Rajendran, R., Silva, C.A., Spierenburg, L., Groeneweg, F., Ruimschotel, E.M., ..., & Levelt, C.N. (2016).
Mitochondrial Dynamics in Visual Cortex Are Limited In Vivo and Not Affected by Axonal Structural Plasticity. Current biology : CB, 26(19), 2609-2616. [PubMed:27641766] [WorldCat] [DOI] - ↑
Devine, M.J., & Kittler, J.T. (2018).
Mitochondria at the neuronal presynapse in health and disease. Nature reviews. Neuroscience, 19(2), 63-80. [PubMed:29348666] [WorldCat] [DOI] - ↑
Stowers, R.S., Megeath, L.J., Górska-Andrzejak, J., Meinertzhagen, I.A., & Schwarz, T.L. (2002).
Axonal transport of mitochondria to synapses depends on milton, a novel Drosophila protein. Neuron, 36(6), 1063-77. [PubMed:12495622] [WorldCat] [DOI] - ↑
van Spronsen, M., Mikhaylova, M., Lipka, J., Schlager, M.A., van den Heuvel, D.J., Kuijpers, M., ..., & Hoogenraad, C.C. (2013).
TRAK/Milton motor-adaptor proteins steer mitochondrial trafficking to axons and dendrites. Neuron, 77(3), 485-502. [PubMed:23395375] [WorldCat] [DOI] - ↑
Guo, X., Macleod, G.T., Wellington, A., Hu, F., Panchumarthi, S., Schoenfield, M., ..., & Zinsmaier, K.E. (2005).
The GTPase dMiro is required for axonal transport of mitochondria to Drosophila synapses. Neuron, 47(3), 379-93. [PubMed:16055062] [WorldCat] [DOI] - ↑
Wang, X., & Schwarz, T.L. (2009).
The mechanism of Ca2+ -dependent regulation of kinesin-mediated mitochondrial motility. Cell, 136(1), 163-74. [PubMed:19135897] [PMC] [WorldCat] [DOI] - ↑
Silva, C.A., Yalnizyan-Carson, A., Fernández Busch, M.V., van Zwieten, M., Verhage, M., & Lohmann, C. (2021).
Activity-dependent regulation of mitochondrial motility in developing cortical dendrites. eLife, 10. [PubMed:34491202] [PMC] [WorldCat] [DOI] - ↑
Kang, J.S., Tian, J.H., Pan, P.Y., Zald, P., Li, C., Deng, C., & Sheng, Z.H. (2008).
Docking of axonal mitochondria by syntaphilin controls their mobility and affects short-term facilitation. Cell, 132(1), 137-48. [PubMed:18191227] [PMC] [WorldCat] [DOI] - ↑
Courchet, J., Lewis, T.L., Lee, S., Courchet, V., Liou, D.Y., Aizawa, S., & Polleux, F. (2013).
Terminal axon branching is regulated by the LKB1-NUAK1 kinase pathway via presynaptic mitochondrial capture. Cell, 153(7), 1510-25. [PubMed:23791179] [PMC] [WorldCat] [DOI] - ↑
Pekkurnaz, G., Trinidad, J.C., Wang, X., Kong, D., & Schwarz, T.L. (2014).
Glucose regulates mitochondrial motility via Milton modification by O-GlcNAc transferase. Cell, 158(1), 54-68. [PubMed:24995978] [PMC] [WorldCat] [DOI] - ↑
Vaccaro, V., Devine, M.J., Higgs, N.F., & Kittler, J.T. (2017).
Miro1-dependent mitochondrial positioning drives the rescaling of presynaptic Ca2+ signals during homeostatic plasticity. EMBO reports, 18(2), 231-240. [PubMed:28039205] [PMC] [WorldCat] [DOI] - ↑
Kwon, S.K., Sando, R., Lewis, T.L., Hirabayashi, Y., Maximov, A., & Polleux, F. (2016).
LKB1 Regulates Mitochondria-Dependent Presynaptic Calcium Clearance and Neurotransmitter Release Properties at Excitatory Synapses along Cortical Axons. PLoS biology, 14(7), e1002516. [PubMed:27429220] [PMC] [WorldCat] [DOI] - ↑
Rangaraju, V., Calloway, N., & Ryan, T.A. (2014).
Activity-driven local ATP synthesis is required for synaptic function. Cell, 156(4), 825-35. [PubMed:24529383] [PMC] [WorldCat] [DOI] - ↑
Pathak, D., Shields, L.Y., Mendelsohn, B.A., Haddad, D., Lin, W., Gerencser, A.A., ..., & Nakamura, K. (2015).
The role of mitochondrially derived ATP in synaptic vesicle recycling. The Journal of biological chemistry, 290(37), 22325-36. [PubMed:26126824] [PMC] [WorldCat] [DOI] - ↑
Faits, M.C., Zhang, C., Soto, F., & Kerschensteiner, D. (2016).
Dendritic mitochondria reach stable positions during circuit development. eLife, 5, e11583. [PubMed:26742087] [PMC] [WorldCat] [DOI] - ↑
Macaskill, A.F., Rinholm, J.E., Twelvetrees, A.E., Arancibia-Carcamo, I.L., Muir, J., Fransson, A., ..., & Kittler, J.T. (2009).
Miro1 is a calcium sensor for glutamate receptor-dependent localization of mitochondria at synapses. Neuron, 61(4), 541-55. [PubMed:19249275] [PMC] [WorldCat] [DOI] - ↑
Kimura, T., & Murakami, F. (2014).
Evidence that dendritic mitochondria negatively regulate dendritic branching in pyramidal neurons in the neocortex. The Journal of neuroscience : the official journal of the Society for Neuroscience, 34(20), 6938-51. [PubMed:24828647] [PMC] [WorldCat] [DOI] - ↑
Rangaraju, V., Lauterbach, M., & Schuman, E.M. (2019).
Spatially Stable Mitochondrial Compartments Fuel Local Translation during Plasticity. Cell, 176(1-2), 73-84.e15. [PubMed:30612742] [WorldCat] [DOI] - ↑
Divakaruni, S.S., Van Dyke, A.M., Chandra, R., LeGates, T.A., Contreras, M., Dharmasri, P.A., ..., & Blanpied, T.A. (2018).
Long-Term Potentiation Requires a Rapid Burst of Dendritic Mitochondrial Fission during Induction. Neuron, 100(4), 860-875.e7. [PubMed:30318410] [PMC] [WorldCat] [DOI] - ↑
Virga, D.M., Hamilton, S., Osei, B., Morgan, A., Kneis, P., Zamponi, E., ..., & Lewis, T.L. (2024).
Activity-dependent compartmentalization of dendritic mitochondria morphology through local regulation of fusion-fission balance in neurons in vivo. Nature communications, 15(1), 2142. [PubMed:38459070] [PMC] [WorldCat] [DOI] - ↑ 53.0 53.1 53.2
Beckervordersandforth, R., Ebert, B., Schäffner, I., Moss, J., Fiebig, C., Shin, J., ..., & Lie, D.C. (2017).
Role of Mitochondrial Metabolism in the Control of Early Lineage Progression and Aging Phenotypes in Adult Hippocampal Neurogenesis. Neuron, 93(3), 560-573.e6. [PubMed:28111078] [PMC] [WorldCat] [DOI] - ↑ 54.0 54.1 54.2 54.3
Khacho, M., Clark, A., Svoboda, D.S., Azzi, J., MacLaurin, J.G., Meghaizel, C., ..., & Slack, R.S. (2016).
Mitochondrial Dynamics Impacts Stem Cell Identity and Fate Decisions by Regulating a Nuclear Transcriptional Program. Cell stem cell, 19(2), 232-247. [PubMed:27237737] [WorldCat] [DOI] - ↑
Khacho, M., Harris, R., & Slack, R.S. (2019).
Mitochondria as central regulators of neural stem cell fate and cognitive function. Nature reviews. Neuroscience, 20(1), 34-48. [PubMed:30464208] [WorldCat] [DOI] - ↑
Jackson, J.G., & Robinson, M.B. (2018).
Regulation of mitochondrial dynamics in astrocytes: Mechanisms, consequences, and unknowns. Glia, 66(6), 1213-1234. [PubMed:29098734] [PMC] [WorldCat] [DOI] - ↑ 57.0 57.1
Meyer, N., & Rinholm, J.E. (2021).
Mitochondria in Myelinating Oligodendrocytes: Slow and Out of Breath? Metabolites, 11(6). [PubMed:34198810] [PMC] [WorldCat] [DOI] - ↑
Fünfschilling, U., Supplie, L.M., Mahad, D., Boretius, S., Saab, A.S., Edgar, J., ..., & Nave, K.A. (2012).
Glycolytic oligodendrocytes maintain myelin and long-term axonal integrity. Nature, 485(7399), 517-21. [PubMed:22622581] [PMC] [WorldCat] [DOI] - ↑
Rinholm, J.E., Vervaeke, K., Tadross, M.R., Tkachuk, A.N., Kopek, B.G., Brown, T.A., ..., & Clayton, D.A. (2016).
Movement and structure of mitochondria in oligodendrocytes and their myelin sheaths. Glia, 64(5), 810-25. [PubMed:26775288] [WorldCat] [DOI] - ↑
Nakamura, D.S., Lin, Y.H., Khan, D., Gothié, J.M., de Faria, O., Dixon, J.A., ..., & Kennedy, T.E. (2021).
Mitochondrial dynamics and bioenergetics regulated by netrin-1 in oligodendrocytes. Glia, 69(2), 392-412. [PubMed:32910475] [WorldCat] [DOI] - ↑
Battefeld, A., Popovic, M.A., de Vries, S.I., & Kole, M.H.P. (2019).
High-Frequency Microdomain Ca2+ Transients and Waves during Early Myelin Internode Remodeling. Cell reports, 26(1), 182-191.e5. [PubMed:30605675] [PMC] [WorldCat] [DOI] - ↑
McGraw, C.F., Somlyo, A.V., & Blaustein, M.P. (1980).
Localization of calcium in presynaptic nerve terminals. An ultrastructural and electron microprobe analysis. The Journal of cell biology, 85(2), 228-41. [PubMed:7372706] [PMC] [WorldCat] [DOI] - ↑
Tsukita, S., & Ishikawa, H. (1976).
Three-dimensional distribution of smooth endoplasmic reticulum in myelinated axons. Journal of electron microscopy, 25(3), 141-9. [PubMed:1025229] [WorldCat] - ↑
Tsukita, S., & Ishikawa, H. (1980).
The movement of membranous organelles in axons. Electron microscopic identification of anterogradely and retrogradely transported organelles. The Journal of cell biology, 84(3), 513-30. [PubMed:6153657] [PMC] [WorldCat] [DOI] - ↑
Lindsey, J.D., & Ellisman, M.H. (1985).
The neuronal endomembrane system. III. The origins of the axoplasmic reticulum and discrete axonal cisternae at the axon hillock. The Journal of neuroscience : the official journal of the Society for Neuroscience, 5(12), 3135-44. [PubMed:3878394] [PMC] [WorldCat] [DOI] - ↑
Hirokawa, N., & Kirino, T. (1980).
An ultrastructural study of nerve and glial cells by freeze-substitution. Journal of neurocytology, 9(2), 243-54. [PubMed:7003067] [WorldCat] [DOI] - ↑
Pickrell, A.M., & Youle, R.J. (2015).
The roles of PINK1, parkin, and mitochondrial fidelity in Parkinson's disease. Neuron, 85(2), 257-73. [PubMed:25611507] [PMC] [WorldCat] [DOI] - ↑
Trimmer, P.A., Swerdlow, R.H., Parks, J.K., Keeney, P., Bennett, J.P., Miller, S.W., ..., & Parker, W.D. (2000).
Abnormal mitochondrial morphology in sporadic Parkinson's and Alzheimer's disease cybrid cell lines. Experimental neurology, 162(1), 37-50. [PubMed:10716887] [WorldCat] [DOI] - ↑
Bhatia, S., Rawal, R., Sharma, P., Singh, T., Singh, M., & Singh, V. (2022).
Mitochondrial Dysfunction in Alzheimer's Disease: Opportunities for Drug Development. Current neuropharmacology, 20(4), 675-692. [PubMed:33998995] [PMC] [WorldCat] [DOI] - ↑
Peruzzotti-Jametti, L., Willis, C.M., Krzak, G., Hamel, R., Pirvan, L., Ionescu, R.B., ..., & Pluchino, S. (2024).
Mitochondrial complex I activity in microglia sustains neuroinflammation. Nature, 628(8006), 195-203. [PubMed:38480879] [PMC] [WorldCat] [DOI]