「細胞外プロテアーゼ」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| 1行目: | 1行目: | ||
英:extracellular protease, extracellular proteinase | 英:extracellular protease, extracellular proteinase | ||
[[wikipedia:ja:タンパク質|タンパク質]]、[[wikipedia:ja:ペプチド|ペプチド]] | [[wikipedia:ja:タンパク質|タンパク質]]、[[wikipedia:ja:ペプチド|ペプチド]]を形成する[[wikipedia:ja:ペプチド結合|ペプチド結合]]を切断する酵素をプロテアーゼ(protease)と総称する。プロテアーゼには細胞外作用型と細胞内作用型の2種類があり作用機序そのものは変わらないが、[[wikipedia:ja:シグナル配列|シグナル配列]]を持ち細胞外へ分泌されるかどうかによって機能は大きく異なる。ここでは細胞外作用型つまり細胞外プロテアーゼについて概説する。 | ||
== 細胞外プロテアーゼとは== | |||
タンパク質、ペプチドを形成する基本的な結合(ペプチド結合)を切断する酵素をプロテアーゼ(protease)と総称する。プロテイネース(proteinase)と呼ぶこともありこちらの方が正式名称であるが、日本語でも英語でもプロテアーゼの方が一般的に使われている。ペプチド結合を切断するのでペプチデースと呼ぶこともある。たとえばプロテアーゼ活性を測定するため[[wikipedia:ja:オリゴペプチド|オリゴペプチド]]合成基質を用いて測定するとプロテアーゼ活性であっても、正確にはペプチデース活性と記載する。プロテアーゼには細胞外作用型と細胞内作用型の2種類があり作用機序そのものは変わらないが、シグナル配列を持ち細胞外へ分泌されるかどうかによって機能は大きく異なる。ここでは細胞外作用型つまり細胞外プロテアーゼについて概説する。切断されるタンパク質、もしくはペプチドはプロテアーゼによって抱え込まれ、その活性部位で切断される。プロテアーゼはいくつかのタイプに分類される。触媒部位を形成する[[wikipedia:ja:アミノ酸|アミノ酸]]による分類およびターゲットとなるタンパク質の基質特異性による分類である。前者ではプロテアーゼの結合サイトとハサミの部分を活性部位の特徴による分類がある。アミノ酸の[[wikipedia:ja:セリン|セリン]]を活性部位にもつものはセリンプロテアーゼと呼び、同様に[[wikipedia:ja:システイン|システイン]]プロテアーゼ、アス[[wikipedia:ja:パラギン酸|パラギン酸]]プロテアーゼおよびメタロ(金属)プロテアーゼなどがある。 | |||
== セリンプロテアーゼ == | == セリンプロテアーゼ == | ||
2012年6月2日 (土) 00:32時点における版
英:extracellular protease, extracellular proteinase
タンパク質、ペプチドを形成するペプチド結合を切断する酵素をプロテアーゼ(protease)と総称する。プロテアーゼには細胞外作用型と細胞内作用型の2種類があり作用機序そのものは変わらないが、シグナル配列を持ち細胞外へ分泌されるかどうかによって機能は大きく異なる。ここでは細胞外作用型つまり細胞外プロテアーゼについて概説する。
細胞外プロテアーゼとは
タンパク質、ペプチドを形成する基本的な結合(ペプチド結合)を切断する酵素をプロテアーゼ(protease)と総称する。プロテイネース(proteinase)と呼ぶこともありこちらの方が正式名称であるが、日本語でも英語でもプロテアーゼの方が一般的に使われている。ペプチド結合を切断するのでペプチデースと呼ぶこともある。たとえばプロテアーゼ活性を測定するためオリゴペプチド合成基質を用いて測定するとプロテアーゼ活性であっても、正確にはペプチデース活性と記載する。プロテアーゼには細胞外作用型と細胞内作用型の2種類があり作用機序そのものは変わらないが、シグナル配列を持ち細胞外へ分泌されるかどうかによって機能は大きく異なる。ここでは細胞外作用型つまり細胞外プロテアーゼについて概説する。切断されるタンパク質、もしくはペプチドはプロテアーゼによって抱え込まれ、その活性部位で切断される。プロテアーゼはいくつかのタイプに分類される。触媒部位を形成するアミノ酸による分類およびターゲットとなるタンパク質の基質特異性による分類である。前者ではプロテアーゼの結合サイトとハサミの部分を活性部位の特徴による分類がある。アミノ酸のセリンを活性部位にもつものはセリンプロテアーゼと呼び、同様にシステインプロテアーゼ、アスパラギン酸プロテアーゼおよびメタロ(金属)プロテアーゼなどがある。
セリンプロテアーゼ
セリンプロテアーゼはセリン、ヒスチジン、アスパラギン酸の3つのアミノ酸によって活性中心が形成されることが特徴である(図3参照)。
セリンプロテアーゼの一種、トロンビン、組織プラスミノーゲンアクティベータ(tissue plasminogen activator;tPA)と プラスミン(plasmin)をトロンビン様プロテアーゼは、血液凝固線溶系および炎症反応での役割が古くからよく知られている。その他、トリプシン様プロテアーゼは食物消化の機能が最初に明らかにされた。しかし最近、脳内においてセリンプロテアーゼが、神経系の発達、維持、可塑性、疾患等に重要な役割を果たしていることが明らかとなって注目されるようになって来た。
トロンビン(thrombin)
血液脳関門が損なわれる病態においてトロンビンは、脳実質内に入る他、脳内においても合成されることが知られる。従って、病態のみならず、正常脳においても何らかの役割を果たすことが示唆されている。培養神経細胞や神経芽細胞腫細胞にトロンビンを投与すると神経突起伸長を阻害する。高濃度のトロンビンで処理すると、神経細胞とアストロサイトの両方でアポトーシスが誘導される。一方、トロンビンは神経可塑性にも関係する。海馬スライスにトロンビンをバスアプライすると、NMDA電流が増強される。短時間のトロンビン暴露はゆっくりとした長続きするFEPSPを誘導する[1][2] 。
組織プラスミノーゲンアクチベーター(tissue plasminogen activator; tPA)
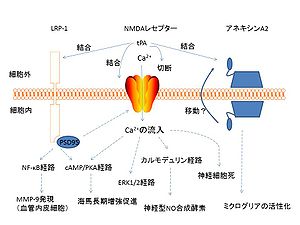
参考:中枢神経系におけるtPAの役割 永井信夫 血栓止血誌20(1)18~22 2009
tPAは神経細胞、グリア細胞、上皮細胞によって合成分泌され、海馬など様々な脳領域に高発現している。多くの研究によってtPAはシナプス機能を修飾することが示されてきた。tPAの神経機能修飾作用としてタンパク質分解活性依存的なものと非依存的なものの2種類あることが知られている。tPAのタンパク質分解活性はGluN1サブユニットの切断を介してNMDAシグナルを増強する。一方、tPAはNMDA受容体GluN2Bサブユニットと結合して、そのリン酸化を促進する。この結果EPK/MAPK経路の活性化を引き起こす。さらに、tPAはlow-density lipoprotein receptor related protein(LRP)と結合してNMDAシグナルに間接的に影響を与える可能性がある。その他tPAはアネキシンA2と結合してミクログリアの活性化を行うことが示唆されている。これらの経路を通じてtPAは神経可塑性の調節に深く関わる(図1参照)。海馬スライスにおいて、tPA活性を阻害するかあるいはtPA遺伝子欠損マウスを用いるとlate phase long-term potentiation(L-LTP)が阻害される。tPA欠損マウスは能動的回避反応とステップダウン型回避試験の成績の低下や新規空間と物体への反応の欠如、文脈付恐怖条件づけのすくみの低下、小脳依存的な運動学習タスクの獲得の低下など学習タスクで障害を示した。[1] [2]
プラスミン(plasmin)
プラスミノーゲンはtPAによって切断されて幅広い特異性をもつプラスミンになる。このtPA-プラスミンカスケードは神経可塑性に関わっている。プラスミン活性はLTPのいくつかの形に重要であることが示されてきている。例えば、プラスミンの投与時にテタナス刺激を同時に行うとLTPが増強された。プラスミンによるproBDNFから成熟BDNFへの活性化はL-LTPの発現に重要であることが明らかとなっている。動物個体による行動研究から、側坐核へのプラスミンの微量注入の結果、モルヒネ依存性のドーパミン放出が増強され、マウスの過剰運動など薬物依存の症状が見られた。ここでは、プラスミンによるprotease-activated receptor1(PAR1)の活性化を介することが示されている[1] 。
ニューロトリプシン(Neurotrypsin)
1997年に二つのラボから独立して同定された比較的新しいセリンプロテアーゼである。ヒトおよびマウスの脳で、海馬と扁桃体に高発現している。免疫電子顕微鏡観察と培養マウス海馬神経細胞を用いた共焦点顕微鏡による研究からニューロトリプシンはシナプス前終末に局在していることが示されている。ニューロトリプシンは神経活動依存的に神経細胞より分泌されて、細胞外プロテオリグリカンの一種アグリンを基質として分解する。ニューロトリプシンノックアウトマウスでは、異常な社会行動をしめし、また組織学的には海馬神経細胞でスパイン密度の減少が示された。臨床研究では、一部の精神遅滞の原因遺伝子としてニューロトリプシンが同定されている。アルジェリアの2つの家系において、ニューロトリプシン遺伝子の4塩基欠損が常染色体劣性遺伝によって受け継がれ、欠損ニューロトリプシンタンパク質となり、その結果重度の精神遅滞となることが明らかとなっている[1]。
(日本蛋白質構造データバンク (PDBj))
ニューロプシン(Neuropsin)
ニューロプシンはトリプシン様セリンプロテアーゼとして1995年に脳で同定された(図2,3参照)。脳において、ニューロプシンは海馬CA1-3の錐体細胞と外側扁桃体の神経細胞に高発現している。海馬スライスを用いた細胞外記録で、低濃度のニューロプシン(1-2.5 nM)を還流してシータ刺激を行うと、early-phase LTP(E-LTP)の著しい増強が見られる。ニューロプシンの基質として細胞接着因子L1CAMおよびEphB2受容体が同定されており、ニューロプシンによるL1CAMの分解は、NMDA受容体依存的なシナプス活動の増強を誘導する。EphB2受容体は、ニューロプシンによって切断され一方、扁桃体においてEphB2-NMDA受容体結合を阻害することからNMDA受容体の活性化を導き、不安関連行動を増強させる。
ニューロプシンノックアウトマウスはE-LTPの障害と一致してモリス水迷路とY字迷路での海馬依存的な学習障害を示した[1][2]。
Kishi T et al. The Journal of biological chemistry. 1999 274(7):4220-4
メタロ(金属)プロテアーゼ(メトジンシンプロテアーゼファミリー(Metzincin protease family))
マトリックスメタロプロテアーゼのスーパーファミリーとしてメトジンシンプロテアーゼファミリーと呼ばれている。細胞外マトリックスタンパク質(例えば、タイプⅠ、Ⅳ コラーゲン、ラミニン、フィブロネクチン等)を切断する。活性部位のメチオニン残基(Met)および亜鉛イオン(zinc ion)がペプチドの切断に重要である(図4,5参照)。
マトリックスメタロプロテアーゼ(MMP)
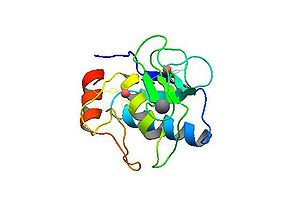
(日本.蛋白質構造データバンク (PDBj))
ピンクの球体が亜鉛イオン、グレーの球体がカルシウムイオン。アミノ酸側鎖はヒスチジンを示している。
MMPはヒトで24種類、マウスで23種類の遺伝子がコードされており、分泌型と膜結合型のメンバーを含み、それらがドメイン構造に従って,コラゲナーゼ,ストロメライシン,ゼラチナーゼと膜型 MMP(MT-MMP)の4つの主なサブグループに分けられている。最近のニューロンとアストロサイトでの報告によると多くのMMPは小胞で分泌されるためのシグナルペプチドを持ち、細胞外で機能すると考えられる。しかしながら、神経細胞とグリア細胞の核でのMMP-2,9,13の存在から、細胞内でのMMPの機能も報告されている。膜結合型のMT-MMPは、フューリン(furin)あるいはプラスミンによって、ゴルジネットワーク内において、つまり細胞内で活性化され、細胞外にある間は活性があると考えられる。MMPの発現は、多くの成長因子、サイトカイン、ケモカインに

ピンクの球体が亜鉛イオン、グレーの球体がカルシウムイオン。アミノ酸側鎖はヒスチジンを示している。
よって[wikipedia:ja:転写|転写]レベルで制御されており、また一方転写後あるいはエピジェネティクス修飾によっても調節を受けている。MMPは神経生理学に関連する細胞外マトリックスタンパク質の分解や、成長因子およびその受容体、あるいはサイトカインの活性化、細胞外マトリックス受容体の分解も行う。MMPのうち、MMP-2、3、9は脳内でもっとも豊富に発現している[3]。
MMP-9は、スパインに発現するβジストログリカンとintracellular adhesion molecule(ICAM)5を基質とし、神経可塑性に関わることが報告されている。ICAM5は未成熟なフィロポディアに多く発現し、切断を受けることでスパインの成熟が進む。MMP-9によってICAM5は切断され、そのN末断片がインテグリンシグナルを介してコフィリン(cofilin)のリン酸化を誘導し、アクチンリモデリングによりスパインの拡大が引き起こされると考えられている。海馬スライスにおいて、MMP-9活性を阻害するか、あるいはMMP-9遺伝子欠損マウスを用いるとL-LTPが阻害される。MMP-9 欠損マウスでは、文脈的恐怖条件付けの行動実験の結果、海馬依存的な学習が阻害され、扁桃体依存的な学習には影響が見られなかった。
A disintegrin and metalloproteinase(ADAM)
ADAMは動物の受精にかかわることで注目された。ヒトに21個、マウスに37個あるADAM遺伝子のうち7個が精巣に発現している。一方、ADAMは神経発生と機能に重要な役割をはたすことも明らかとなってきた。ADAMと ADAMT
S(ADAM proteases with thrombospondin motif(後述))はディスインテグリン様ドメインをもち、このドメインによってインテグリンと結合する。ADAM15を除くADAMは古典的なRGDインテグリン結合モチーフをもたず、(D/E)ECD モチーフを持ち、このモチーフがインテグリン結合特異性に貢献し、細胞接着に関係する。逆に、ADAMとADAMTSのシステインリッチドメインはシンデカン、フィブロネクチン、ほかのADAMとの結合を介して細胞接着を促進する。多くのADAM(ADAM-10とADAM-17を除いて)は、膜貫通ドメインに近接する上皮成長因子(EGF)likeドメインをもつ。ADAMの細胞内ドメインは、様々な長さを持ち、シグナル伝達に関与すると考えられている。ADAMの多くが神経系に発現している。しかしながら、ADAM-22欠損マウスとADAM-23欠損マウスはたとえば、運動失調、歩行困難、震えなどのフェノタイプを示す。ADAM-10 欠損マウスとADAM-17欠損マウスは胎生、周産期致死となる[2][3]。
ADAM proteases with thrombospondin motif(ADAMTS)
トランスポゾンタイプ1(thrombospondin type1)様リピートをもつメタロプロテアーゼである。ADAMと同様に、ADAMTSは細胞内で活性化され活性型で分泌される。保存されたトランスポゾンタイプ1様リピートはプロテオグリカン上の硫酸化プリコサミノグリカンの結合ドメインとして機能すると考えられている。ADAMTS-1、4,5,8,9と15はアグリカンを切断すると報告されている。ADAMTS-4と5は、アグリカンの他、ヒアルロナン結合レクチカンプロテオグリカンのバーシカンとブレビカンも切断し、ブレビカン切断は神経系の生理、特に神経可塑性と神経謬腫侵襲に関連があるとされる。ADAMTS-1発現はアルツハイマー病とダウン症で増加しADAMTS-1、4、8と9は脳虚血で上昇することから神経変性疾患に関係すると考えられている。ADAMTS-4発現は実験的自己免疫性脳脊髄炎で減少し、また多発性硬化症の白質で上昇するというやや相違した結果も得られている。その阻害物質TIMP-3はこれにおいて逆相関が見られている[3]。
アスパラギン酸プロテアーゼ
BACE1
アルツハイマー病の主原因である(アミロイドベータ)Aβ生産に関わるβセクレターゼとして単離されてきた。Aβは膜貫通タンパク質であるamyloid precursor protein(APP)をβ-セクレターゼが細胞外の切断に関わり、γ‐セクレターゼが膜貫通領域の細胞質側で切断することから産生される。その結果、患者の老人班が形成されることになる。
システインプロテアーゼ
カルパイン(Calpain)
神経細胞死に関わる細胞内プロテアーゼである。
関連項目
参考文献
- ↑ 1.0 1.1 1.2 1.3 1.4
Almonte, A.G., & Sweatt, J.D. (2011).
Serine proteases, serine protease inhibitors, and protease-activated receptors: roles in synaptic function and behavior. Brain research, 1407, 107-22. [PubMed:21782155] [PMC] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2 2.3
Lukasiuk, K., Wilczynski, G.M., & Kaczmarek, L. (2011).
Extracellular proteases in epilepsy. Epilepsy research, 96(3), 191-206. [PubMed:21893397] [WorldCat] [DOI] - ↑ 3.0 3.1 3.2
Rivera, S., Khrestchatisky, M., Kaczmarek, L., Rosenberg, G.A., & Jaworski, D.M. (2010).
Metzincin proteases and their inhibitors: foes or friends in nervous system physiology? The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(46), 15337-57. [PubMed:21084591] [PMC] [WorldCat] [DOI]
(執筆者:鈴木春満 担当編集委員:河西春郎)