「ドーパミン」の版間の差分
編集の要約なし |
細編集の要約なし |
||
| (2人の利用者による、間の11版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | |||
<font size="+1">[http://researchmap.jp/kkatsutky 小林克典]</font><br> | |||
''日本医科大学 薬理学講座''<br> | |||
DOI:<selfdoi /> 原稿受付日:2013年4月8日 原稿完成日:2013年6月21日<br> | |||
担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所 脳科学総合研究センター)<br> | |||
</div> | |||
{{chembox | {{chembox | ||
| verifiedrevid = 464188976 | | verifiedrevid = 464188976 | ||
| 13行目: | 21行目: | ||
| InChI = 1/C8H11NO2/c9-4-3-6-1-2-7(10)8(11)5-6/h1-2,5,10-11H,3-4,9H2 | | InChI = 1/C8H11NO2/c9-4-3-6-1-2-7(10)8(11)5-6/h1-2,5,10-11H,3-4,9H2 | ||
| InChIKey = VYFYYTLLBUKUHU-UHFFFAOYAA | | InChIKey = VYFYYTLLBUKUHU-UHFFFAOYAA | ||
| StdInChI_Ref = {{stdinchicite|correct | | StdInChI_Ref = {{stdinchicite|correct|chemspider}} | ||
| StdInChI = 1S/C8H11NO2/c9-4-3-6-1-2-7(10)8(11)5-6/h1-2,5,10-11H,3-4,9H2 | | StdInChI = 1S/C8H11NO2/c9-4-3-6-1-2-7(10)8(11)5-6/h1-2,5,10-11H,3-4,9H2 | ||
| StdInChIKey_Ref = {{stdinchicite|correct|chemspider}} | | StdInChIKey_Ref = {{stdinchicite|correct|chemspider}} | ||
| 22行目: | 30行目: | ||
| CASNo1_Comment = (hydrochloride) | | CASNo1_Comment = (hydrochloride) | ||
| CASNo1_Ref = {{cascite|correct|CAS}} | | CASNo1_Ref = {{cascite|correct|CAS}} | ||
| | | PubChem=681 | ||
| ChEMBL_Ref = {{ebicite|correct|EBI}} | | ChEMBL_Ref = {{ebicite|correct|EBI}} | ||
| | | ChEMBL = 59 | ||
| ChemSpiderID_Ref = {{chemspidercite|correct|chemspider}} | | ChemSpiderID_Ref = {{chemspidercite|correct|chemspider}} | ||
| ChemSpiderID = 661 | | ChemSpiderID = 661 | ||
| KEGG_Ref = {{keggcite|correct | | KEGG_Ref = {{keggcite|correct|kegg}} | ||
| | | KEGG = D07870 | ||
| DrugBank_Ref = {{drugbankcite|correct | | DrugBank_Ref = {{drugbankcite|correct|drugbank}} | ||
| | | DrugBank = DB00988 | ||
| ChEBI_Ref = {{ebicite|correct|EBI}} | | ChEBI_Ref = {{ebicite|correct|EBI}} | ||
| | | ChEBI = 18243 | ||
| SMILES = c1cc(c(cc1CCN)O)O | | SMILES = c1cc(c(cc1CCN)O)O | ||
| ATCCode_prefix = C01 | | ATCCode_prefix = C01 | ||
| 41行目: | 49行目: | ||
| MolarMass=153.18 g/mol | | MolarMass=153.18 g/mol | ||
| Appearance=colorless solid | | Appearance=colorless solid | ||
| | | Density= 1.26 g/cm<sup>3</sup> | ||
| MeltingPtC= 128 | | MeltingPtC= 128 | ||
| BoilingPt= decomposes | | BoilingPt= decomposes | ||
| | | Solubility=60.0 g/100 ml | ||
}} | }} | ||
|Section3= {{Chembox Hazards | |Section3= {{Chembox Hazards | ||
| 59行目: | 67行目: | ||
英語名:dopamine 独:Dopamin 仏:dopamine | 英語名:dopamine 独:Dopamin 仏:dopamine | ||
{{box|text= | |||
[[wikipedia:ja:カテコール核|カテコール核]]を持つ[[wikipedia:ja:アミン|アミン]]([[カテコールアミン]])で、[[中枢神経系]]の[[伝達物質]]、及び末梢のシグナル分子として働く。生体内のドーパミンは[[wikipedia:ja:チロシン|チロシン]]から二段階の酵素反応によって合成され、[[小胞モノアミントランスポーター]]によって細胞内の小胞に取り込まれる。[[開口放出]]によって放出されたドーパミンは放出部位から比較的離れた場所に存在する[[受容体]]に結合して標的細胞の生理機能を調節する。ドーパミン受容体は全て[[Gタンパク質共役型]]で、遅い信号伝達もしくは神経細胞機能の修飾を担う。[[中脳]]から[[大脳]]に投射するドーパミン神経が中枢のドーパミン神経系の大部分を占め、[[運動]]機能、[[認知]]機能などの中枢機能の調節に関与する。また、ドーパミン神経系は[[精神疾患]]の病態生理に対する関与が示唆されており、[[抗精神病薬]]等の治療薬や[[依存性薬物]]の標的となる。 | [[wikipedia:ja:カテコール核|カテコール核]]を持つ[[wikipedia:ja:アミン|アミン]]([[カテコールアミン]])で、[[中枢神経系]]の[[伝達物質]]、及び末梢のシグナル分子として働く。生体内のドーパミンは[[wikipedia:ja:チロシン|チロシン]]から二段階の酵素反応によって合成され、[[小胞モノアミントランスポーター]]によって細胞内の小胞に取り込まれる。[[開口放出]]によって放出されたドーパミンは放出部位から比較的離れた場所に存在する[[受容体]]に結合して標的細胞の生理機能を調節する。ドーパミン受容体は全て[[Gタンパク質共役型]]で、遅い信号伝達もしくは神経細胞機能の修飾を担う。[[中脳]]から[[大脳]]に投射するドーパミン神経が中枢のドーパミン神経系の大部分を占め、[[運動]]機能、[[認知]]機能などの中枢機能の調節に関与する。また、ドーパミン神経系は[[精神疾患]]の病態生理に対する関与が示唆されており、[[抗精神病薬]]等の治療薬や[[依存性薬物]]の標的となる。 | ||
}} | |||
== 生合成と代謝 == | == 生合成と代謝 == | ||
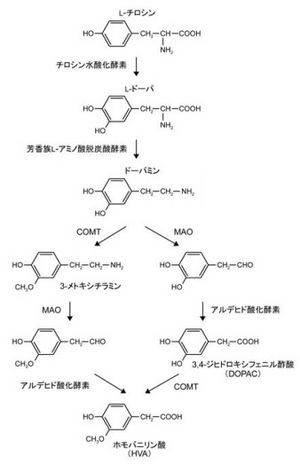
L-チロシンから[[チロシン水酸化酵素]](tyrosine hydoxylase、TH)によって[[L-ドーパ]](レボドーパ)が合成され、さらに[[芳香族L-アミノ酸脱炭酸酵素]]([[Aromatic L-amino acid decarboxylase]]、[[AADC]] | L-チロシンから[[チロシン水酸化酵素]](tyrosine hydoxylase、TH)によって[[L-ドーパ]](レボドーパ)が合成され、さらに[[芳香族L-アミノ酸脱炭酸酵素]]([[Aromatic L-amino acid decarboxylase]]、[[AADC]])によってドーパミンが合成される。ドーパミンと同じくカテコールアミン類の伝達物質である[[ノルアドレナリン]]は[[ドーパミン-β-水酸化酵素]]によってドーパミンから合成される。 | ||
ドーパミン合成の[[律速酵素]]であるTHは、[[セロトニン]]合成経路の[[トリプトファン水酸化酵素]]と同様に[[テトラヒドロビオプテリン]]を[[補因子]] | ドーパミン合成の[[律速酵素]]であるTHは、[[セロトニン]]合成経路の[[トリプトファン水酸化酵素]]と同様に[[テトラヒドロビオプテリン]]を[[補因子]]とし、通常はチロシンで飽和している。THはしばしばドーパミン又はカテコールアミン作動性神経のマーカーとして用いられるが、THを発現していてもAADCを発現していない場合があり、THを発現していても必ずしもカテコールアミン作動性神経とは言えない<ref name="ref1"><pubmed> 17408759 </pubmed></ref>。 | ||
合成されたドーパミンは基質特異性の低い小胞モノアミントランスポーター([[vesicular monoamine transporter]]、[[VMAT]])によってシナプス小胞に貯蔵される<ref><pubmed> 20135628 </pubmed></ref>。VMATには[[VMAT1]]と[[VMAT2]]のアイソフォームが存在し、中枢神経系には主にVMAT2が発現している。 | |||
ドーパミンの代謝には[[モノアミン酸化酵素]]([[Monoamine oxidase]]、[[MAO]])による経路と[[カテコール-O-メチル基転移酵素]]([[Catechol-O-methyltransferase]]、[[COMT]])による経路の二通りがあり、両者とも最終的に代謝産物として[[ホモバニリン酸]]を生じる。MAOには[[MAOA|MAO<sub>A</sub>]]と[[MAOB|MAO<sub>B</sub>]]の二種類のアイソザイムが存在し、カテコールアミン作動性神経には主にMAO<sub>A</sub>が発現しているが、[[wikipedia:ja:ヒト|ヒト]]の場合ドーパミンはMAO<sub>B</sub>によって代謝される<ref name="ref2"><pubmed> 10202537 </pubmed></ref>。 | ドーパミンの代謝には[[モノアミン酸化酵素]]([[Monoamine oxidase]]、[[MAO]])による経路と[[カテコール-O-メチル基転移酵素]]([[Catechol-O-methyltransferase]]、[[COMT]])による経路の二通りがあり、両者とも最終的に代謝産物として[[ホモバニリン酸]]を生じる。MAOには[[MAOA|MAO<sub>A</sub>]]と[[MAOB|MAO<sub>B</sub>]]の二種類のアイソザイムが存在し、カテコールアミン作動性神経には主にMAO<sub>A</sub>が発現しているが、[[wikipedia:ja:ヒト|ヒト]]の場合ドーパミンはMAO<sub>B</sub>によって代謝される<ref name="ref2"><pubmed> 10202537 </pubmed></ref>。 | ||
| 73行目: | 83行目: | ||
== 放出と信号伝達 == | == 放出と信号伝達 == | ||
小胞内に貯蔵されたドーパミンは開口放出によって細胞外に放出される。ドーパミン神経の投射部位のみならず黒質や腹側被蓋野でもドーパミンは放出される。これらの部位では細胞体や樹状突起からドーパミンが放出され、特に黒質ではそれが主であると考えられている。 | |||
軸索終末からの放出も[[細胞体]]・[[樹状突起]]からの放出も共に[[Ca2+|Ca<sup>2+</sup>]]依存性であるが、軸索における放出の方がより高濃度の細胞外Ca<sup>2+</sup>を必要とする<ref name="ref7"><pubmed> 21939738 </pubmed></ref>。線条体においてドーパミン放出部位と考えられる構造の60-70%は明確なシナプス構造を形成していない<ref name="ref7" />。また、ドーパミン受容体の大部分はシナプス外の部位に発現している<ref name="ref8"><pubmed> 9651506 </pubmed></ref>。従ってドーパミンによって担われる信号伝達は、主として放出部位から比較的離れた受容体に作用する[[拡散性伝達]]([[Volume transmission]])によると考えられる<ref name="ref8" />。 | 軸索終末からの放出も[[細胞体]]・[[樹状突起]]からの放出も共に[[Ca2+|Ca<sup>2+</sup>]]依存性であるが、軸索における放出の方がより高濃度の細胞外Ca<sup>2+</sup>を必要とする<ref name="ref7"><pubmed> 21939738 </pubmed></ref>。線条体においてドーパミン放出部位と考えられる構造の60-70%は明確なシナプス構造を形成していない<ref name="ref7" />。また、ドーパミン受容体の大部分はシナプス外の部位に発現している<ref name="ref8"><pubmed> 9651506 </pubmed></ref>。従ってドーパミンによって担われる信号伝達は、主として放出部位から比較的離れた受容体に作用する[[拡散性伝達]]([[Volume transmission]])によると考えられる<ref name="ref8" />。 | ||
| 91行目: | 101行目: | ||
=== D<sub>2</sub>様受容体 === | === D<sub>2</sub>様受容体 === | ||
D<sub>2</sub>、D<sub>4</sub> | D<sub>2</sub>、D<sub>4</sub>受容体は線条体、大脳皮質、辺縁系などに強く発現している。D<sub>3</sub>受容体は主に中脳―皮質・辺縁系に発現しており、線条体での発現は弱い<ref name="ref13" />。アデニル酸シクラーゼの抑制以外に、[[Gβγ]]を介してイオンチャネルの修飾とPLCの活性化を生じる<ref name="ref14" />。シナプス伝達に対して主に抑制的に働き、線条体ニューロンのup stateの興奮性を下げる<ref name="ref12" /><ref name="ref15" />。また、興奮性シナプス伝達の[[長期抑圧]]の形成に重要な役割を果たす<ref name="ref11" /><ref name="ref16" />。 | ||
D<sub>2</sub>受容体には[[D2L|D<sub>2L</sub>]](ロングフォーム)と[[D2S|D<sub>2S</sub>]](ショートフォーム)の[[スプライスバリアント]]が存在する。D<sub>2L</sub>とD<sub>2S</sub>は分布や機能が異なることが示されており、D<sub>2S</sub>はドーパミン細胞に発現する抑制性の自己受容体として機能する<ref name="ref18"><pubmed> 19138563 </pubmed></ref>。D<sub>3</sub>受容体も自己受容体として機能することが示唆されており<ref name="ref14" />、D<sub>4</sub>受容体もドーパミン神経系に何らかの抑制的働きを持つことが示唆されている<ref name="ref19"><pubmed> 15567422 </pubmed></ref>。 | D<sub>2</sub>受容体には[[D2L|D<sub>2L</sub>]](ロングフォーム)と[[D2S|D<sub>2S</sub>]](ショートフォーム)の[[スプライスバリアント]]が存在する。D<sub>2L</sub>とD<sub>2S</sub>は分布や機能が異なることが示されており、D<sub>2S</sub>はドーパミン細胞に発現する抑制性の自己受容体として機能する<ref name="ref18"><pubmed> 19138563 </pubmed></ref>。D<sub>3</sub>受容体も自己受容体として機能することが示唆されており<ref name="ref14" />、D<sub>4</sub>受容体もドーパミン神経系に何らかの抑制的働きを持つことが示唆されている<ref name="ref19"><pubmed> 15567422 </pubmed></ref>。 | ||
| 97行目: | 107行目: | ||
== ドーパミントランスポーター == | == ドーパミントランスポーター == | ||
細胞外に放出されたドーパミンは細胞膜上の[[ドーパミントランスポーター]]([[Dopamine transporter]], [[DAT]])によって細胞内に取り込まれる。ノルアドレナリンやセロトニンのトランスポーターと同様にイオンの電気化学的勾配によって駆動される12回膜貫通構造を持つトランスポーターで、ドーパミン、Na<sup>+</sup>、Cl<sup>-</sup>を1:2:1の比で輸送する。ドーパミン神経や[[wikipedia:ja:腸管|腸管]]、[[wikipedia:ja:肺|肺]]、[[wikipedia:ja:膵臓|膵臓]]、[[wikipedia:ja:腎臓|腎臓]]、[[wikipedia:ja:リンパ球|リンパ球]]などに発現している<ref name="ref9"><pubmed> 16613553 </pubmed></ref>。 | |||
DATは[[シナプス]]直下ではなくシナプス周辺に主に発現しているため、シナプスにおけるドーパミン濃度よりもその周辺の細胞外液における濃度調節に重要と考えられている<ref name="ref8" /><ref name="ref9" />。DAT欠損マウスではドーパミンの基底濃度が上昇しており、一過性の濃度上昇からの回復が100-300倍遅くなっている<ref name="ref9" /><ref name="ref10"><pubmed> 8628395 </pubmed></ref>。[[コカイン]]や[[アンフェタミン]]などの[[精神刺激薬]]([[Psychostimulants]])はDATを主要なターゲットとし、ドーパミン取込の阻害又は逆輸送によるドーパミン放出を引き起こす。[[wikipedia:ja:ラット|ラット]]や[[wikipedia:ja:マウス|マウス]]にこれらの薬物を投与すると多動になる。DAT欠損マウスは野生型マウスよりも多動で、中枢刺激薬を投与しても行動量が変化しない<ref name="ref10" />。 | DATは[[シナプス]]直下ではなくシナプス周辺に主に発現しているため、シナプスにおけるドーパミン濃度よりもその周辺の細胞外液における濃度調節に重要と考えられている<ref name="ref8" /><ref name="ref9" />。DAT欠損マウスではドーパミンの基底濃度が上昇しており、一過性の濃度上昇からの回復が100-300倍遅くなっている<ref name="ref9" /><ref name="ref10"><pubmed> 8628395 </pubmed></ref>。[[コカイン]]や[[アンフェタミン]]などの[[精神刺激薬]]([[Psychostimulants]])はDATを主要なターゲットとし、ドーパミン取込の阻害又は逆輸送によるドーパミン放出を引き起こす。[[wikipedia:ja:ラット|ラット]]や[[wikipedia:ja:マウス|マウス]]にこれらの薬物を投与すると多動になる。DAT欠損マウスは野生型マウスよりも多動で、中枢刺激薬を投与しても行動量が変化しない<ref name="ref10" />。 | ||
| 112行目: | 122行目: | ||
黒質と腹側被蓋野からの線維投射は必ずしもこれらの経路に限られるのではなく、黒質から皮質、辺縁系に投射する線維や腹側被蓋野から線条体に投射する線維も存在する<ref name="ref1" />。 | 黒質と腹側被蓋野からの線維投射は必ずしもこれらの経路に限られるのではなく、黒質から皮質、辺縁系に投射する線維や腹側被蓋野から線条体に投射する線維も存在する<ref name="ref1" />。 | ||
大脳皮質に対する投射の中では、[[前頭前野]]に対する投射が良く知られており、その機能に関して豊富な知見があるが、他の皮質領域に対する投射も存在する<ref name="ref3"><pubmed> 19446627 </pubmed></ref>。これら以外に[[間脳]][[A11]]から脊髄に投射する下行性のドーパミン神経も存在し<ref name="ref4"><pubmed> 20503420 </pubmed></ref>、[[嗅球]]や[[網膜]]ではドーパミンが局所的に産生、放出される<ref name="ref5"><pubmed> 19731547 </pubmed></ref><ref name="ref6"><pubmed> 18061262 </pubmed></ref>。 | |||
== 中枢神経機能 == | == 中枢神経機能 == | ||
| 128行目: | 138行目: | ||
ドーパミンは学習・記憶、[[注意]]、[[実行機能]]などの[[認知機能]]を調節することが示されており、特に[[作業記憶]]に対する寄与に関して多くの知見が存在する<ref name="ref23">'''T.W. Robbins'''<br>Role of cortical and striatal dopamine in cognitive function.<br>''Handbook of Chemical Neuroanatomy 21, Dopamine<br>Edited by A. S.B. Dunnett, M. Bentivoglio, A. Björklund, & T. Hökfelt'':2005<br>http://dx.doi.org/10.1016/S0924-8196(05)80011-9</ref>。 | ドーパミンは学習・記憶、[[注意]]、[[実行機能]]などの[[認知機能]]を調節することが示されており、特に[[作業記憶]]に対する寄与に関して多くの知見が存在する<ref name="ref23">'''T.W. Robbins'''<br>Role of cortical and striatal dopamine in cognitive function.<br>''Handbook of Chemical Neuroanatomy 21, Dopamine<br>Edited by A. S.B. Dunnett, M. Bentivoglio, A. Björklund, & T. Hökfelt'':2005<br>http://dx.doi.org/10.1016/S0924-8196(05)80011-9</ref>。 | ||
主にサルを用いた研究によって作業記憶課題中に前頭前野のドーパミンレベルが上昇し、前頭前野に対するドーパミン[[神経毒]]の注入、D<sub>1</sub>様受容体の遮断や過剰な活性化によって課題遂行が阻害されることが示されている<ref name="ref24"><pubmed> 15129848 </pubmed></ref><ref name="ref25"><pubmed> 21232555 </pubmed></ref>。前頭前野のみならず線条体のドーパミン系も作業記憶に関与することが示されており、パーキンソン病患者では作業記憶等の認知機能の障害が見られる<ref name="ref23" /><ref name="ref24" />。 | |||
海馬に対するドーパミン神経毒や受容体アゴニストの注入によって、空間記憶の保持や作業記憶課題が変化する<ref name="ref11" />。D<sub>1</sub>受容体欠損マウスでは[[恐怖記憶]]の消去や[[空間学習]]の障害が生じる<ref name="ref19" />。 | 海馬に対するドーパミン神経毒や受容体アゴニストの注入によって、空間記憶の保持や作業記憶課題が変化する<ref name="ref11" />。D<sub>1</sub>受容体欠損マウスでは[[恐怖記憶]]の消去や[[空間学習]]の障害が生じる<ref name="ref19" />。 | ||
| 138行目: | 148行目: | ||
=== 神経内分泌 === | === 神経内分泌 === | ||
[[視床下部]]の隆起漏斗路のドーパミン神経系は[[下垂体]]からの[[プロラクチン]]放出を抑制する<ref name="ref30"><pubmed> 11739329 </pubmed></ref>。この神経系ではドーパミンは毛細血管近傍に放出されて[[門脈]]を介して[[下垂体前葉]]に到達する。ドーパミンはD<sub>2</sub>受容体を介してプロラクチン分泌細胞胞内のCa<sup>2+</sup>濃度を低下させてプロラクチン分泌を抑制する。さらに、プロラクチン遺伝子の発現を抑制し、プロラクチン分泌細胞の分裂を抑制すると考えられている。[[抗精神病薬]]などのD<sub>2</sub>遮断作用を持つ薬物は[[高プロラクチン血症]] | [[視床下部]]の隆起漏斗路のドーパミン神経系は[[下垂体]]からの[[プロラクチン]]放出を抑制する<ref name="ref30"><pubmed> 11739329 </pubmed></ref>。この神経系ではドーパミンは毛細血管近傍に放出されて[[門脈]]を介して[[下垂体前葉]]に到達する。ドーパミンはD<sub>2</sub>受容体を介してプロラクチン分泌細胞胞内のCa<sup>2+</sup>濃度を低下させてプロラクチン分泌を抑制する。さらに、プロラクチン遺伝子の発現を抑制し、プロラクチン分泌細胞の分裂を抑制すると考えられている。[[抗精神病薬]]などのD<sub>2</sub>遮断作用を持つ薬物は[[高プロラクチン血症]]を生じさせる。視床下部から下垂体に直接投射するドーパミン神経も存在する。 | ||
=== 視覚 === | === 視覚 === | ||
| 148行目: | 158行目: | ||
[[統合失調症]]及び[[精神病性障害]]にドーパミン神経系の異常が関与することが示唆されている<ref name="ref32"><pubmed> 19499420 </pubmed></ref>。この[[ドーパミン仮説]]は、これらの疾患、障害の治療薬である抗精神病薬にD<sub>2</sub>受容体の遮断作用があることから提唱されたものであるが、現在でもその直接的な証拠はない。ドーパミントランスポーターを主な標的とし、ドーパミン濃度を上昇させる[[精神刺激薬]]によって薬物性の精神病性症状が生じることもこの仮説を支持する証拠とされている。しかし、精神刺激薬によって生じる精神症状や行動異常は疾患の症状と必ずしも同一ではなく、精神刺激薬の標的もドーパミン神経系に限定したものではない。他にドーパミン仮説を支持する証拠として、統合失調症患者においてドーパミンの放出やドーパミン前駆物質ドーパの取込の増加などが示されている<ref name="ref32" />。 | [[統合失調症]]及び[[精神病性障害]]にドーパミン神経系の異常が関与することが示唆されている<ref name="ref32"><pubmed> 19499420 </pubmed></ref>。この[[ドーパミン仮説]]は、これらの疾患、障害の治療薬である抗精神病薬にD<sub>2</sub>受容体の遮断作用があることから提唱されたものであるが、現在でもその直接的な証拠はない。ドーパミントランスポーターを主な標的とし、ドーパミン濃度を上昇させる[[精神刺激薬]]によって薬物性の精神病性症状が生じることもこの仮説を支持する証拠とされている。しかし、精神刺激薬によって生じる精神症状や行動異常は疾患の症状と必ずしも同一ではなく、精神刺激薬の標的もドーパミン神経系に限定したものではない。他にドーパミン仮説を支持する証拠として、統合失調症患者においてドーパミンの放出やドーパミン前駆物質ドーパの取込の増加などが示されている<ref name="ref32" />。 | ||
ドーパミンは[[うつ病]]にも関与することが示唆されているが、これも確実な証拠はない<ref name="ref33"><pubmed> 20558238 </pubmed></ref>。パーキンソン病でうつ症状や不安が生じるため、ドーパミン系の機能不全がこれらの[[情動]]異常に関与する可能性がある。しかし、パーキンソン病の標準的治療薬であるドーパミン前駆物質レボドーパを投与しても、これらの症状は必ずしも改善しない<ref name="ref34"><pubmed> 20615430 </pubmed></ref> | ドーパミンは[[うつ病]]にも関与することが示唆されているが、これも確実な証拠はない<ref name="ref33"><pubmed> 20558238 </pubmed></ref>。パーキンソン病でうつ症状や不安が生じるため、ドーパミン系の機能不全がこれらの[[情動]]異常に関与する可能性がある。しかし、パーキンソン病の標準的治療薬であるドーパミン前駆物質レボドーパを投与しても、これらの症状は必ずしも改善しない<ref name="ref34"><pubmed> 20615430 </pubmed></ref>。抗うつ薬はセロトニン神経系やノルアドレナリン神経系を主な標的とするが、ドーパミン系にも変化を生じさせる<ref name="ref17" /><ref name="ref35"><pubmed> 11033341 </pubmed></ref>。精神刺激薬の[[メチルフェニデート]]がうつ病治療に用いられていたが現在は適応外である。また、ドーパミン取込阻害作用のある[[ブプロピオン]]が抗うつ薬として用いられるが、日本では未承認である。メチルフェニデートは[[注意欠陥多動障害]]([[Attention-deficit hyperactivity disorder]]、[[ADHD]])の治療に用いられるが、この一見矛盾した治療効果のメカニズムの詳細は未だ明らかではない<ref name="ref36"><pubmed> 21550021 </pubmed></ref>。 | ||
== 関連項目 == | == 関連項目 == | ||
*[[ドーパミン仮説(統合失調症)]] | *[[ドーパミン仮説(統合失調症)]] | ||
*[[報酬系]] | *[[報酬系]] | ||
| 164行目: | 172行目: | ||
<references /> | <references /> | ||
2022年7月13日 (水) 11:03時点における最新版
小林克典
日本医科大学 薬理学講座
DOI:10.14931/bsd.3611 原稿受付日:2013年4月8日 原稿完成日:2013年6月21日
担当編集委員:林 康紀(独立行政法人理化学研究所 脳科学総合研究センター)
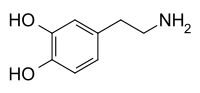
| ドーパミン | |
|---|---|
| |
| |
4-(2-aminoethyl)benzene-1,2-diol | |
別称 2-(3,4-dihydroxyphenyl)ethylamine; 3,4-dihydroxyphenethylamine; 3-hydroxytyramine; DA; Intropin; Revivan; Oxytyramine | |
| Identifiers | |
| 51-61-6 62-31-7 (hydrochloride) | |
| ATC code | |
| ChEBI | |
| ChEMBL | ChEMBL59 |
| ChemSpider | 661 |
| DrugBank | {{{value}}} |
| |
| Jmol-3D images | Image |
| KEGG | D07870 |
| PubChem | 681 |
| |
| UNII | VTD58H1Z2X |
| Properties | |
| Molar mass | 153.18 g/mol |
| Appearance | colorless solid |
| Density | 1.26 g/cm3 |
| Melting point | 128 °C (262 °F; 401 K) |
| Boiling point | |
| 60.0 g/100 ml | |
| 危険性 | |
| Rフレーズ | R36/37/38 |
| S-phrases | S26 S36 |
| 特記なき場合、データは常温(25 °C)・常圧(100 kPa)におけるものである。 | |
英語名:dopamine 独:Dopamin 仏:dopamine
カテコール核を持つアミン(カテコールアミン)で、中枢神経系の伝達物質、及び末梢のシグナル分子として働く。生体内のドーパミンはチロシンから二段階の酵素反応によって合成され、小胞モノアミントランスポーターによって細胞内の小胞に取り込まれる。開口放出によって放出されたドーパミンは放出部位から比較的離れた場所に存在する受容体に結合して標的細胞の生理機能を調節する。ドーパミン受容体は全てGタンパク質共役型で、遅い信号伝達もしくは神経細胞機能の修飾を担う。中脳から大脳に投射するドーパミン神経が中枢のドーパミン神経系の大部分を占め、運動機能、認知機能などの中枢機能の調節に関与する。また、ドーパミン神経系は精神疾患の病態生理に対する関与が示唆されており、抗精神病薬等の治療薬や依存性薬物の標的となる。
生合成と代謝
L-チロシンからチロシン水酸化酵素(tyrosine hydoxylase、TH)によってL-ドーパ(レボドーパ)が合成され、さらに芳香族L-アミノ酸脱炭酸酵素(Aromatic L-amino acid decarboxylase、AADC)によってドーパミンが合成される。ドーパミンと同じくカテコールアミン類の伝達物質であるノルアドレナリンはドーパミン-β-水酸化酵素によってドーパミンから合成される。
ドーパミン合成の律速酵素であるTHは、セロトニン合成経路のトリプトファン水酸化酵素と同様にテトラヒドロビオプテリンを補因子とし、通常はチロシンで飽和している。THはしばしばドーパミン又はカテコールアミン作動性神経のマーカーとして用いられるが、THを発現していてもAADCを発現していない場合があり、THを発現していても必ずしもカテコールアミン作動性神経とは言えない[1]。
合成されたドーパミンは基質特異性の低い小胞モノアミントランスポーター(vesicular monoamine transporter、VMAT)によってシナプス小胞に貯蔵される[2]。VMATにはVMAT1とVMAT2のアイソフォームが存在し、中枢神経系には主にVMAT2が発現している。
ドーパミンの代謝にはモノアミン酸化酵素(Monoamine oxidase、MAO)による経路とカテコール-O-メチル基転移酵素(Catechol-O-methyltransferase、COMT)による経路の二通りがあり、両者とも最終的に代謝産物としてホモバニリン酸を生じる。MAOにはMAOAとMAOBの二種類のアイソザイムが存在し、カテコールアミン作動性神経には主にMAOAが発現しているが、ヒトの場合ドーパミンはMAOBによって代謝される[3]。
放出と信号伝達
小胞内に貯蔵されたドーパミンは開口放出によって細胞外に放出される。ドーパミン神経の投射部位のみならず黒質や腹側被蓋野でもドーパミンは放出される。これらの部位では細胞体や樹状突起からドーパミンが放出され、特に黒質ではそれが主であると考えられている。
軸索終末からの放出も細胞体・樹状突起からの放出も共にCa2+依存性であるが、軸索における放出の方がより高濃度の細胞外Ca2+を必要とする[4]。線条体においてドーパミン放出部位と考えられる構造の60-70%は明確なシナプス構造を形成していない[4]。また、ドーパミン受容体の大部分はシナプス外の部位に発現している[5]。従ってドーパミンによって担われる信号伝達は、主として放出部位から比較的離れた受容体に作用する拡散性伝達(Volume transmission)によると考えられる[5]。
受容体
ドーパミン受容体の活性化によって興奮性の変化やシナプス伝達の修飾が起きる。
ドーパミン受容体にはD1、D2、D3、D4、D5のサブタイプが存在し、全て7回膜貫通構造を持つGタンパク質共役型受容体である。Gs/olfに共役してアデニル酸シクラーゼを活性化するD1様受容体(D1、D5)とGi/oに共役してアデニル酸シクラーゼを抑制するD2様受容体(D2、D3、D4)に大きく分類される。線条体、前頭前野、海馬、側坐核などにおいて、神経細胞の興奮性やシナプス伝達に対して多様な修飾作用を持つ[6][7]。
D1様受容体
D1受容体は線条体などに強く発現しており、D5受容体は辺縁系に発現している。D1受容体欠損マウスを用いてリガンド結合解析を行うと、D1様受容体リガンドの結合の大部分が無くなり、残りのD5受容体由来と考えられる結合が海馬等に見られる[8]。D1とD5を薬理学に明確に区別することはできないが、D5受容体はD1受容体よりもドーパミンに対する親和性が高い。
D1様受容体の活性化によって、Gs/olfのみならずGqを介したフォスフォリパーゼC(PLC)の活性化も生じる。Gqの活性化にはD5受容体又はD1/D2へテロ二量体の関与が示唆されている[9]。カリウム、カルシウムチャネルの機能を修飾し、線条体投射ニューロンのUp state(膜電位の浅い状態)における活動電位発火を促進する[10]。しかし、ナトリウム電流に対して抑制作用を持つことも報告されている[7][10][11]。グルタミン酸、GABAシナプスにおいてシナプス前性の抑制、増強の両作用を持ち[7][12]、興奮性シナプス伝達の長期可塑性の形成に寄与する[6]。
D2様受容体
D2、D4受容体は線条体、大脳皮質、辺縁系などに強く発現している。D3受容体は主に中脳―皮質・辺縁系に発現しており、線条体での発現は弱い[8]。アデニル酸シクラーゼの抑制以外に、Gβγを介してイオンチャネルの修飾とPLCの活性化を生じる[9]。シナプス伝達に対して主に抑制的に働き、線条体ニューロンのup stateの興奮性を下げる[7][10]。また、興奮性シナプス伝達の長期抑圧の形成に重要な役割を果たす[6][11]。
D2受容体にはD2L(ロングフォーム)とD2S(ショートフォーム)のスプライスバリアントが存在する。D2LとD2Sは分布や機能が異なることが示されており、D2Sはドーパミン細胞に発現する抑制性の自己受容体として機能する[13]。D3受容体も自己受容体として機能することが示唆されており[9]、D4受容体もドーパミン神経系に何らかの抑制的働きを持つことが示唆されている[14]。
ドーパミントランスポーター
細胞外に放出されたドーパミンは細胞膜上のドーパミントランスポーター(Dopamine transporter, DAT)によって細胞内に取り込まれる。ノルアドレナリンやセロトニンのトランスポーターと同様にイオンの電気化学的勾配によって駆動される12回膜貫通構造を持つトランスポーターで、ドーパミン、Na+、Cl-を1:2:1の比で輸送する。ドーパミン神経や腸管、肺、膵臓、腎臓、リンパ球などに発現している[15]。
DATはシナプス直下ではなくシナプス周辺に主に発現しているため、シナプスにおけるドーパミン濃度よりもその周辺の細胞外液における濃度調節に重要と考えられている[5][15]。DAT欠損マウスではドーパミンの基底濃度が上昇しており、一過性の濃度上昇からの回復が100-300倍遅くなっている[15][16]。コカインやアンフェタミンなどの精神刺激薬(Psychostimulants)はDATを主要なターゲットとし、ドーパミン取込の阻害又は逆輸送によるドーパミン放出を引き起こす。ラットやマウスにこれらの薬物を投与すると多動になる。DAT欠損マウスは野生型マウスよりも多動で、中枢刺激薬を投与しても行動量が変化しない[16]。
ドーパミン神経系
中枢におけるドーパミン神経はしばしば4つの主要経路に分類される。
黒質と腹側被蓋野からの線維投射は必ずしもこれらの経路に限られるのではなく、黒質から皮質、辺縁系に投射する線維や腹側被蓋野から線条体に投射する線維も存在する[1]。
大脳皮質に対する投射の中では、前頭前野に対する投射が良く知られており、その機能に関して豊富な知見があるが、他の皮質領域に対する投射も存在する[17]。これら以外に間脳A11から脊髄に投射する下行性のドーパミン神経も存在し[18]、嗅球や網膜ではドーパミンが局所的に産生、放出される[19][20]。
中枢神経機能
運動機能
黒質-線条体路が運動調節に重要な役割を果たすことが広く知られている。パーキンソン病では黒質のドーパミン細胞の変性による線条体ドーパミン量の低下が生じ、静止時振戦、筋固縮、無動などの運動機能の障害が生じる[21]。腹側被蓋野から主な投射を受ける側坐核もドーパミンによる運動調節に寄与する[22]。
一般に実験動物において、細胞外ドーパミン濃度を上昇させる精神刺激薬やドーパミン受容体アゴニストは活動量を増加させ、ドーパミン受容体アンタゴニストは活動量を低下させる。線条体には主にD1受容体とD2受容体が発現しており、D2受容体欠損マウスでは活動量の低下が見られるが、D1受容体欠損マウスでは活動量が上昇することもある[8][14]。D1様受容体アンタゴニストは活動量の低下を起こすが、この効果はD1受容体欠損マウスでは抑制されている。また、D1受容体欠損マウスは発育不全を示すが、その原因の一部は運動機能の異常にあると考えられる[14]。
D5受容体欠損マウスでもD1様受容体アゴニストや精神刺激薬の効果が低下するため、D5受容体も運動調節に寄与する[14]。大脳皮質運動野にも中脳からドーパミン神経の投射がある[17]。この経路の機能の詳細は不明であるが、運動学習に関与することが示唆されている[23]。
認知機能
ドーパミンは学習・記憶、注意、実行機能などの認知機能を調節することが示されており、特に作業記憶に対する寄与に関して多くの知見が存在する[24]。
主にサルを用いた研究によって作業記憶課題中に前頭前野のドーパミンレベルが上昇し、前頭前野に対するドーパミン神経毒の注入、D1様受容体の遮断や過剰な活性化によって課題遂行が阻害されることが示されている[25][26]。前頭前野のみならず線条体のドーパミン系も作業記憶に関与することが示されており、パーキンソン病患者では作業記憶等の認知機能の障害が見られる[24][25]。
海馬に対するドーパミン神経毒や受容体アゴニストの注入によって、空間記憶の保持や作業記憶課題が変化する[6]。D1受容体欠損マウスでは恐怖記憶の消去や空間学習の障害が生じる[14]。
報酬
中脳-皮質・辺縁系路が報酬に対する応答を司る報酬系として機能し、特に側坐核が重要な役割を果たすことが知られている[27]。依存性薬物は全てこれらのドーパミン神経系に標的を持ち、ドーパミン濃度を上昇させる[28]。この神経系は嫌悪刺激に対する反応にも寄与すると考えられており[27]、腹側被蓋野に対する入力の違いによって報酬と嫌悪が分かれることが光遺伝学的手法によって示されている[29]。また、黒質-線条体路も報酬に関与することが示されている[30]。
神経内分泌
視床下部の隆起漏斗路のドーパミン神経系は下垂体からのプロラクチン放出を抑制する[31]。この神経系ではドーパミンは毛細血管近傍に放出されて門脈を介して下垂体前葉に到達する。ドーパミンはD2受容体を介してプロラクチン分泌細胞胞内のCa2+濃度を低下させてプロラクチン分泌を抑制する。さらに、プロラクチン遺伝子の発現を抑制し、プロラクチン分泌細胞の分裂を抑制すると考えられている。抗精神病薬などのD2遮断作用を持つ薬物は高プロラクチン血症を生じさせる。視床下部から下垂体に直接投射するドーパミン神経も存在する。
視覚
網膜においてドーパミンはアマクリン細胞と間網状細胞(Interplexiform cell)から放出され、視細胞から神経節細胞へのシグナル伝達とその側方調節の両者の修飾に関与する[20]。ドーパミンはD1様受容体を介して水平細胞のギャップジャンクションのカップリングを抑制することにより、受容野のサイズを減少させる。網膜の視細胞では、サーカディアンリズムの形成に関与するメラトニンが産生される。メラトニンはドーパミン系に対して拮抗的に作用し、D4受容体によってその生合成が抑制される[20]。D4受容体欠損マウスでは光によるCAMP産生の調節と明順応時の網膜電位に顕著な障害が生じる[32]。
ドーパミンと精神疾患
統合失調症及び精神病性障害にドーパミン神経系の異常が関与することが示唆されている[33]。このドーパミン仮説は、これらの疾患、障害の治療薬である抗精神病薬にD2受容体の遮断作用があることから提唱されたものであるが、現在でもその直接的な証拠はない。ドーパミントランスポーターを主な標的とし、ドーパミン濃度を上昇させる精神刺激薬によって薬物性の精神病性症状が生じることもこの仮説を支持する証拠とされている。しかし、精神刺激薬によって生じる精神症状や行動異常は疾患の症状と必ずしも同一ではなく、精神刺激薬の標的もドーパミン神経系に限定したものではない。他にドーパミン仮説を支持する証拠として、統合失調症患者においてドーパミンの放出やドーパミン前駆物質ドーパの取込の増加などが示されている[33]。
ドーパミンはうつ病にも関与することが示唆されているが、これも確実な証拠はない[34]。パーキンソン病でうつ症状や不安が生じるため、ドーパミン系の機能不全がこれらの情動異常に関与する可能性がある。しかし、パーキンソン病の標準的治療薬であるドーパミン前駆物質レボドーパを投与しても、これらの症状は必ずしも改善しない[35]。抗うつ薬はセロトニン神経系やノルアドレナリン神経系を主な標的とするが、ドーパミン系にも変化を生じさせる[12][36]。精神刺激薬のメチルフェニデートがうつ病治療に用いられていたが現在は適応外である。また、ドーパミン取込阻害作用のあるブプロピオンが抗うつ薬として用いられるが、日本では未承認である。メチルフェニデートは注意欠陥多動障害(Attention-deficit hyperactivity disorder、ADHD)の治療に用いられるが、この一見矛盾した治療効果のメカニズムの詳細は未だ明らかではない[37]。
関連項目
参考文献
- ↑ 1.0 1.1
Björklund, A., & Dunnett, S.B. (2007).
Dopamine neuron systems in the brain: an update. Trends in neurosciences, 30(5), 194-202. [PubMed:17408759] [WorldCat] [DOI] - ↑
Wimalasena, K. (2011).
Vesicular monoamine transporters: structure-function, pharmacology, and medicinal chemistry. Medicinal research reviews, 31(4), 483-519. [PubMed:20135628] [PMC] [WorldCat] [DOI] - ↑
Shih, J.C., Chen, K., & Ridd, M.J. (1999).
Monoamine oxidase: from genes to behavior. Annual review of neuroscience, 22, 197-217. [PubMed:10202537] [PMC] [WorldCat] [DOI] - ↑ 4.0 4.1
Rice, M.E., Patel, J.C., & Cragg, S.J. (2011).
Dopamine release in the basal ganglia. Neuroscience, 198, 112-37. [PubMed:21939738] [PMC] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2
Zoli, M., Torri, C., Ferrari, R., Jansson, A., Zini, I., Fuxe, K., & Agnati, L.F. (1998).
The emergence of the volume transmission concept. Brain research. Brain research reviews, 26(2-3), 136-47. [PubMed:9651506] - ↑ 6.0 6.1 6.2 6.3
Jay, T.M. (2003).
Dopamine: a potential substrate for synaptic plasticity and memory mechanisms. Progress in neurobiology, 69(6), 375-90. [PubMed:12880632] [WorldCat] - ↑ 7.0 7.1 7.2 7.3
Tritsch, N.X., & Sabatini, B.L. (2012).
Dopaminergic modulation of synaptic transmission in cortex and striatum. Neuron, 76(1), 33-50. [PubMed:23040805] [PMC] [WorldCat] [DOI] - ↑ 8.0 8.1 8.2 M.K. Horne, J. Drago, J. Nunan
The use of dopamine receptor knockout mice to understand brain dopamine neurotransmission and sprouting in the nigrostriatal pathway.
Handbook of Chemical Neuroanatomy 21, Dopamine
Edited by A. S.B. Dunnett, M. Bentivoglio, A. Björklund, & T. Hökfelt:2005
http://dx.doi.org/10.1016/S0924-8196(05)80007-7 - ↑ 9.0 9.1 9.2
Beaulieu, J.M., & Gainetdinov, R.R. (2011).
The physiology, signaling, and pharmacology of dopamine receptors. Pharmacological reviews, 63(1), 182-217. [PubMed:21303898] [WorldCat] [DOI] - ↑ 10.0 10.1 10.2
Surmeier, D.J., Carrillo-Reid, L., & Bargas, J. (2011).
Dopaminergic modulation of striatal neurons, circuits, and assemblies. Neuroscience, 198, 3-18. [PubMed:21906660] [PMC] [WorldCat] [DOI] - ↑ 11.0 11.1
Calabresi, P., Pisani, A., Centonze, D., & Bernardi, G. (1997).
Synaptic plasticity and physiological interactions between dopamine and glutamate in the striatum. Neuroscience and biobehavioral reviews, 21(4), 519-23. [PubMed:9195611] [WorldCat] - ↑ 12.0 12.1
Kobayashi, K., Haneda, E., Higuchi, M., Suhara, T., & Suzuki, H. (2012).
Chronic fluoxetine selectively upregulates dopamine D₁-like receptors in the hippocampus. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology, 37(6), 1500-8. [PubMed:22278095] [PMC] [WorldCat] [DOI] - ↑
De Mei, C., Ramos, M., Iitaka, C., & Borrelli, E. (2009).
Getting specialized: presynaptic and postsynaptic dopamine D2 receptors. Current opinion in pharmacology, 9(1), 53-8. [PubMed:19138563] [PMC] [WorldCat] [DOI] - ↑ 14.0 14.1 14.2 14.3 14.4
Holmes, A., Lachowicz, J.E., & Sibley, D.R. (2004).
Phenotypic analysis of dopamine receptor knockout mice; recent insights into the functional specificity of dopamine receptor subtypes. Neuropharmacology, 47(8), 1117-34. [PubMed:15567422] [WorldCat] [DOI] - ↑ 15.0 15.1 15.2
Sotnikova, T.D., Beaulieu, J.M., Gainetdinov, R.R., & Caron, M.G. (2006).
Molecular biology, pharmacology and functional role of the plasma membrane dopamine transporter. CNS & neurological disorders drug targets, 5(1), 45-56. [PubMed:16613553] [WorldCat] - ↑ 16.0 16.1
Giros, B., Jaber, M., Jones, S.R., Wightman, R.M., & Caron, M.G. (1996).
Hyperlocomotion and indifference to cocaine and amphetamine in mice lacking the dopamine transporter. Nature, 379(6566), 606-12. [PubMed:8628395] [WorldCat] [DOI] - ↑ 17.0 17.1
Luft, A.R., & Schwarz, S. (2009).
Dopaminergic signals in primary motor cortex. International journal of developmental neuroscience : the official journal of the International Society for Developmental Neuroscience, 27(5), 415-21. [PubMed:19446627] [WorldCat] [DOI] - ↑
Pappas, S.S., Tiernan, C.T., Behrouz, B., Jordan, C.L., Breedlove, S.M., Goudreau, J.L., & Lookingland, K.J. (2010).
Neonatal androgen-dependent sex differences in lumbar spinal cord dopamine concentrations and the number of A11 diencephalospinal dopamine neurons. The Journal of comparative neurology, 518(13), 2423-36. [PubMed:20503420] [PMC] [WorldCat] [DOI] - ↑
Cave, J.W., & Baker, H. (2009).
Dopamine systems in the forebrain. Advances in experimental medicine and biology, 651, 15-35. [PubMed:19731547] [PMC] [WorldCat] [DOI] - ↑ 20.0 20.1 20.2
Brandies, R., & Yehuda, S. (2008).
The possible role of retinal dopaminergic system in visual performance. Neuroscience and biobehavioral reviews, 32(4), 611-56. [PubMed:18061262] [WorldCat] [DOI] - ↑
Dauer, W., & Przedborski, S. (2003).
Parkinson's disease: mechanisms and models. Neuron, 39(6), 889-909. [PubMed:12971891] [WorldCat] [DOI] - ↑
David, H.N., Ansseau, M., & Abraini, J.H. (2005).
Dopamine-glutamate reciprocal modulation of release and motor responses in the rat caudate-putamen and nucleus accumbens of "intact" animals. Brain research. Brain research reviews, 50(2), 336-60. [PubMed:16278019] [DOI] - ↑
Hosp, J.A., Pekanovic, A., Rioult-Pedotti, M.S., & Luft, A.R. (2011).
Dopaminergic projections from midbrain to primary motor cortex mediate motor skill learning. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(7), 2481-7. [PubMed:21325515] [PMC] [WorldCat] [DOI] - ↑ 24.0 24.1 T.W. Robbins
Role of cortical and striatal dopamine in cognitive function.
Handbook of Chemical Neuroanatomy 21, Dopamine
Edited by A. S.B. Dunnett, M. Bentivoglio, A. Björklund, & T. Hökfelt:2005
http://dx.doi.org/10.1016/S0924-8196(05)80011-9 - ↑ 25.0 25.1
Marié, R.M., & Defer, G.L. (2003).
Working memory and dopamine: clinical and experimental clues. Current opinion in neurology, 16 Suppl 2, S29-35. [PubMed:15129848] [WorldCat] - ↑
Khan, Z.U., & Muly, E.C. (2011).
Molecular mechanisms of working memory. Behavioural brain research, 219(2), 329-41. [PubMed:21232555] [WorldCat] [DOI] - ↑ 27.0 27.1
Carlezon, W.A., & Thomas, M.J. (2009).
Biological substrates of reward and aversion: a nucleus accumbens activity hypothesis. Neuropharmacology, 56 Suppl 1, 122-32. [PubMed:18675281] [PMC] [WorldCat] [DOI] - ↑
Lüscher, C., & Ungless, M.A. (2006).
The mechanistic classification of addictive drugs. PLoS medicine, 3(11), e437. [PubMed:17105338] [PMC] [WorldCat] [DOI] - ↑
Lammel, S., Lim, B.K., Ran, C., Huang, K.W., Betley, M.J., Tye, K.M., ..., & Malenka, R.C. (2012).
Input-specific control of reward and aversion in the ventral tegmental area. Nature, 491(7423), 212-7. [PubMed:23064228] [PMC] [WorldCat] [DOI] - ↑
Wise, R.A. (2009).
Roles for nigrostriatal--not just mesocorticolimbic--dopamine in reward and addiction. Trends in neurosciences, 32(10), 517-24. [PubMed:19758714] [PMC] [WorldCat] [DOI] - ↑
Ben-Jonathan, N., & Hnasko, R. (2001).
Dopamine as a prolactin (PRL) inhibitor. Endocrine reviews, 22(6), 724-63. [PubMed:11739329] [WorldCat] [DOI] - ↑
Nir, I., Harrison, J.M., Haque, R., Low, M.J., Grandy, D.K., Rubinstein, M., & Iuvone, P.M. (2002).
Dysfunctional light-evoked regulation of cAMP in photoreceptors and abnormal retinal adaptation in mice lacking dopamine D4 receptors. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(6), 2063-73. [PubMed:11896146] [PMC] [WorldCat] - ↑ 33.0 33.1
Moncrieff, J. (2009).
A critique of the dopamine hypothesis of schizophrenia and psychosis. Harvard review of psychiatry, 17(3), 214-25. [PubMed:19499420] [WorldCat] [DOI] - ↑
Opmeer, E.M., Kortekaas, R., & Aleman, A. (2010).
Depression and the role of genes involved in dopamine metabolism and signalling. Progress in neurobiology, 92(2), 112-33. [PubMed:20558238] [WorldCat] [DOI] - ↑
Eskow Jaunarajs, K.L., Angoa-Perez, M., Kuhn, D.M., & Bishop, C. (2011).
Potential mechanisms underlying anxiety and depression in Parkinson's disease: consequences of l-DOPA treatment. Neuroscience and biobehavioral reviews, 35(3), 556-64. [PubMed:20615430] [PMC] [WorldCat] [DOI] - ↑
D'Aquila, P.S., Collu, M., Gessa, G.L., & Serra, G. (2000).
The role of dopamine in the mechanism of action of antidepressant drugs. European journal of pharmacology, 405(1-3), 365-73. [PubMed:11033341] [WorldCat] [DOI] - ↑
Del Campo, N., Chamberlain, S.R., Sahakian, B.J., & Robbins, T.W. (2011).
The roles of dopamine and noradrenaline in the pathophysiology and treatment of attention-deficit/hyperactivity disorder. Biological psychiatry, 69(12), e145-57. [PubMed:21550021] [WorldCat] [DOI]