「脊髄の発生」の版間の差分
細 (→ニューロンの発生) |
細 (→ニューロンの発生) |
||
| 21行目: | 21行目: | ||
== ニューロンの発生 == | == ニューロンの発生 == | ||
[[image:脊髄図2.jpg|thumb|350px|'''図2.脊髄神経管のパターニングとニューロンサブタイプ'''<br>(A) 脳室帯における前駆細胞ドメインの形成と各ドメインから派生するニューロンサブタイプ<br>(B) 前駆細胞ドメインに発現する転写因子。<br>RP: [[蓋板]]、FP: [[底板]]、pd: [[progenitor domain]]、p0-3: XXXX、pIL: XXXX、pMN: XXXX、dl1-6: XXX、V0-3: XXXX、MN: 運動ニューロン、[[[Wnt | [[image:脊髄図2.jpg|thumb|350px|'''図2.脊髄神経管のパターニングとニューロンサブタイプ'''<br>(A) 脳室帯における前駆細胞ドメインの形成と各ドメインから派生するニューロンサブタイプ<br>(B) 前駆細胞ドメインに発現する転写因子。<br>RP: [[蓋板]]、FP: [[底板]]、pd: [[progenitor domain]]、p0-3: XXXX、pIL: XXXX、pMN: XXXX、dl1-6: XXX、V0-3: XXXX、MN: 運動ニューロン、[[[Wnt]]: [[wingless-type MMTV integration site family]]、[[BMP]]: [[骨形成因子]]、[[Shh]]: [[ソニックヘッジホッグ]]、[[PAX]]: [[Paired box]]、[[Irx]]: [[iroquois homeobox]]、[[Dbx]]: [[developing brain homeobox]]、[[Nkx2]]: [[NK2 homeobox]]、[[Nkx6]]: [[NK6 homeobox]]]] | ||
脳室帯の腹側領域からは[[運動ニューロン]]と[[介在ニューロン]]が発生し、脳室帯の背側領域からは介在ニューロンが発生する。これらのニューロンには機能が異なるサブタイプが存在する<ref name=ref1><pubmed>21729788</pubmed></ref>(図2)。は、脳室帯には、底板から[[分泌]]される[[ソニックヘッジホッグ]]([[Shh]])<ref name=ref2><pubmed>8500163</pubmed></ref>の濃度勾配が形成され、その情報にしたがって、様々な転写因子が決められた場所に発現する。たとえば、SHHは脳室帯の細胞に[[Nkx2.2]]、Olig2、Nkx6.1、Nkx6.2の発現を誘導し、[[PAX6|Pax6]]、[[Irx3]]、[[Dbx1]]、[[Dbx2]]の発現を抑制する<ref name=ref3><pubmed>10830170</pubmed></ref> <ref name=ref4><pubmed>20066087</pubmed></ref>。対になって発現する遺伝子間には相互抑制作用が働き、発現境界により区分される[[前駆細胞]]ドメイン(progenitor domain)が形成される<ref name=ref3 />(図2)。各ドメインにおける転写因子の発現の組み合わせが、ニューロンに個性を与える。一方、神経管の背側領域のニューロンのサブタイプ決定には、蓋板から分泌される[[骨形成因子]] ([[BMP]])や[[WNT|Wnt]]タンパク質の濃度勾配が関与し、決められた前駆細胞ドメインから、異なる種類のニューロンが生みだされる(図3)<ref name=ref5><pubmed>22821665</pubmed></ref>。また、神経管の中間領域の前駆細胞の特異化には、神経管に隣接する[[体節]]から分泌される[[レチノイン酸]]の作用も重要である<ref name=ref6><pubmed>10399918</pubmed></ref>。 | 脳室帯の腹側領域からは[[運動ニューロン]]と[[介在ニューロン]]が発生し、脳室帯の背側領域からは介在ニューロンが発生する。これらのニューロンには機能が異なるサブタイプが存在する<ref name=ref1><pubmed>21729788</pubmed></ref>(図2)。は、脳室帯には、底板から[[分泌]]される[[ソニックヘッジホッグ]]([[Shh]])<ref name=ref2><pubmed>8500163</pubmed></ref>の濃度勾配が形成され、その情報にしたがって、様々な転写因子が決められた場所に発現する。たとえば、SHHは脳室帯の細胞に[[Nkx2.2]]、Olig2、Nkx6.1、Nkx6.2の発現を誘導し、[[PAX6|Pax6]]、[[Irx3]]、[[Dbx1]]、[[Dbx2]]の発現を抑制する<ref name=ref3><pubmed>10830170</pubmed></ref> <ref name=ref4><pubmed>20066087</pubmed></ref>。対になって発現する遺伝子間には相互抑制作用が働き、発現境界により区分される[[前駆細胞]]ドメイン(progenitor domain)が形成される<ref name=ref3 />(図2)。各ドメインにおける転写因子の発現の組み合わせが、ニューロンに個性を与える。一方、神経管の背側領域のニューロンのサブタイプ決定には、蓋板から分泌される[[骨形成因子]] ([[BMP]])や[[WNT|Wnt]]タンパク質の濃度勾配が関与し、決められた前駆細胞ドメインから、異なる種類のニューロンが生みだされる(図3)<ref name=ref5><pubmed>22821665</pubmed></ref>。また、神経管の中間領域の前駆細胞の特異化には、神経管に隣接する[[体節]]から分泌される[[レチノイン酸]]の作用も重要である<ref name=ref6><pubmed>10399918</pubmed></ref>。 | ||
2013年8月10日 (土) 12:07時点における版
高橋 将文
自治医科大学 分子病態治療研究センター 細胞生物研究部
DOI XXXX/XXXX 原稿受付日:2013年7月28日 原稿完成日:2013年月日
担当編集委員:大隅 典子(東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)
英語名:spinal cord development
脊髄(spinal cord)は中枢神経系を構成する情報処理器官であり、発生初期に見られる神経板から形成される。神経板は神経管を形成した後、脳室帯に存在する未分化な神経上皮細胞から運動ニューロンや介在ニューロンが発生する。ニューロン産生が終わると、次に、脳室帯の未分化細胞からグリア細胞(オリゴデンドロサイト、アストロサイト)が発生する。細胞分化が進むと、脳室帯の外側には細胞体に富む外套層が形成され、外套層の外側には神経線維が集合する辺縁層が形成される。
脊髄原基の構造
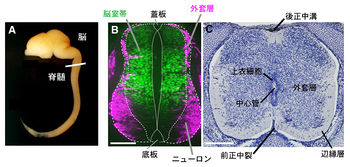
脊髄の原基はシート状の神経板である。神経板はダイナミックな形態変化を経て神経管を形成する。神経管は頭部から尾部にかけて1本の管であり(図1)、脊髄は神経管の後方領域から形成される。神経管の内腔に接する脳室帯(ventricular zone)は脳室面側と基底膜側に細長い突起を伸ばす神経上皮細胞から構成され、偽重層上皮構造を有している。神経管の最腹側領域の底板(floor plate)および最背側領域の蓋板(alar plate)を構成する神経上皮細胞は、ほとんど増殖しない。それら以外の領域の神経上皮細胞は、盛んに増殖する。このような領域では、神経上皮細胞は核のエレベーター運動を行いながら、脳室面側で分裂し、生じた2つの娘細胞のうちの片方がニューロンへ分化する。分化したニューロンは基底膜側へ移動し、脳室帯の外側に積み重なることで外套層(mantle layer)が形成される。外套層が形成されても、脳室帯の細胞は基底膜まで長い突起を伸ばしており、神経上皮細胞は放射状グリア細胞と呼ばれるようになる。
胎児期後期には、外套層と脊髄表面との間に細胞体が粗な辺縁層が(marginal zone)が形成される(図1)。脳室帯の細胞は、ニューロン産生を終了すると、次にオリゴデンドロサイトやアストロサイトといったグリア細胞を生み出す。これらの細胞は脳室帯を離れ、外套層や辺縁層に配置される。外套層は細胞体が豊富な灰白質となる。辺縁層には、外套層ニューロンの軸索や脳から下行するニューロンの軸索が集まり、白質が形成される。脊髄腹側の正中には前正中裂(anterior median fissure)、背側の正中には後正中溝(posterior median sulcus)が形成される(図1)。神経管の内腔は、神経管の中心に位置し、中心管へ変化する。脳室帯の細胞は、中心管を構成する上衣細胞(ependymal cell)として生涯にわたり維持される(図1)。
ニューロンの発生
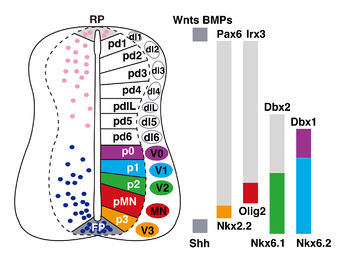
(A) 脳室帯における前駆細胞ドメインの形成と各ドメインから派生するニューロンサブタイプ
(B) 前駆細胞ドメインに発現する転写因子。
RP: 蓋板、FP: 底板、pd: progenitor domain、p0-3: XXXX、pIL: XXXX、pMN: XXXX、dl1-6: XXX、V0-3: XXXX、MN: 運動ニューロン、[[[Wnt]]: wingless-type MMTV integration site family、BMP: 骨形成因子、Shh: ソニックヘッジホッグ、PAX: Paired box、Irx: iroquois homeobox、Dbx: developing brain homeobox、Nkx2: NK2 homeobox、Nkx6: NK6 homeobox
脳室帯の腹側領域からは運動ニューロンと介在ニューロンが発生し、脳室帯の背側領域からは介在ニューロンが発生する。これらのニューロンには機能が異なるサブタイプが存在する[1](図2)。は、脳室帯には、底板から分泌されるソニックヘッジホッグ(Shh)[2]の濃度勾配が形成され、その情報にしたがって、様々な転写因子が決められた場所に発現する。たとえば、SHHは脳室帯の細胞にNkx2.2、Olig2、Nkx6.1、Nkx6.2の発現を誘導し、Pax6、Irx3、Dbx1、Dbx2の発現を抑制する[3] [4]。対になって発現する遺伝子間には相互抑制作用が働き、発現境界により区分される前駆細胞ドメイン(progenitor domain)が形成される[3](図2)。各ドメインにおける転写因子の発現の組み合わせが、ニューロンに個性を与える。一方、神経管の背側領域のニューロンのサブタイプ決定には、蓋板から分泌される骨形成因子 (BMP)やWntタンパク質の濃度勾配が関与し、決められた前駆細胞ドメインから、異なる種類のニューロンが生みだされる(図3)[5]。また、神経管の中間領域の前駆細胞の特異化には、神経管に隣接する体節から分泌されるレチノイン酸の作用も重要である[6]。
グリア細胞の発生
脊髄神経管の放射状グリア細胞は、ニューロン産生を終えると、グリア細胞を産生するようになる。脊髄の大部分のオリゴデンドロサイトは、運動ニューロンの産生を終了したOlig2発現ドメインの細胞から発生する[7](図2)。また、時期を遅くして、オリゴデンドロサイトは背側の限られた前駆細胞ドメインからも生み出される[8]。
これら産生されたオリゴデンドロサイトは移動し、脊髄内に広く分布する。一方、アストロサイトは全ての前駆細胞ドメインから発生する。アストロサイトは、灰白質に存在する原形質アストロサイトと、白質に存在する線維性アストロサイトに分類される。脊髄腹側領域の異なる前駆細胞ドメインからは、異なるマーカー遺伝子の発現で区別可能な線維性アストロサイトサブタイプが発生する[9]。脊髄では、アストロサイトの産生は発生後期から生後初期まで続く。アストロサイトは放射状グリア細胞の非対称分裂により産生されると考えられるが、放射状グリア細胞から中間増殖細胞を経由してアストロサイトを生み出す機構の存在も示唆されている[10]。各ドメインから生み出されたアストロサイトは、放射状方向に移動し、生後においてもほとんど背腹方向に移動しないことが遺伝的細胞標識マウスを用いた実験で明らかにされている[11]。
灰白質•白質の分化
脊髄の外套層は細胞体が集まった灰白質を構成し、境界溝によって運動制御に関わる基板(basal plate)と感覚制御に関わる翼板(alar plate)に分けられる。基板の腹側領域には運動ニューロンの集合体である前角が形成され、運動ニューロンカラム(前柱)が形成される。運動ニューロンの神経束は、腹側より出力し、前根となる。異なる前後軸レベルにおいて、カラムには特徴的な組織構築が認められる。前肢(brachial)と腰(Lumber)のレベルには、内側細胞柱(medial motor column)と外側細胞柱(lateral motor column)からなる前柱が存在し、前者は体幹部の骨格筋を、後者は四肢の骨格筋を支配している。四肢への投射が存在しない胸(thoracic)のレベルでは、内側細胞柱のみからなる前柱が存在する。内側細胞柱と外側細胞柱の運動ニューロンでは、LIMホメオボックス転写因子の特徴的な発現の組み合わせが認められる[12]。
また、運動ニューロンカラムにおけるHox遺伝子群の発現パターンは、前後軸に沿って異なっており[13]、Hox遺伝子群は、カラムの個性決定や運動ニューロンの投射様式を制御している[14]。
また基板に存在する介在ニューロンサブタイプには、運動ニューロンと直接接続し局所回路を形成するものや、脊髄の反対側に投射し運動の左右調節に関与するものなど、その機能が明らかにされつつある。一方、翼板の背側領域には、介在ニューロンが集合した後角が形成される。末梢の感覚ニューロンの軸索束は後根を形成し、脊髄に入力した後、後角ニューロンとシナプスを形成する。中間灰白質には側角が形成され、末梢の交感神経系に投射するニューロンが集合する。
関連項目
参考文献
- ↑
Alaynick, W.A., Jessell, T.M., & Pfaff, S.L. (2011).
SnapShot: spinal cord development. Cell, 146(1), 178-178.e1. [PubMed:21729788] [PMC] [WorldCat] [DOI] - ↑
Yamada, T., Pfaff, S.L., Edlund, T., & Jessell, T.M. (1993).
Control of cell pattern in the neural tube: motor neuron induction by diffusible factors from notochord and floor plate. Cell, 73(4), 673-86. [PubMed:8500163] [WorldCat] [DOI] - ↑ 3.0 3.1
Briscoe, J., Pierani, A., Jessell, T.M., & Ericson, J. (2000).
A homeodomain protein code specifies progenitor cell identity and neuronal fate in the ventral neural tube. Cell, 101(4), 435-45. [PubMed:10830170] [WorldCat] [DOI] - ↑
Ribes, V., & Briscoe, J. (2009).
Establishing and interpreting graded Sonic Hedgehog signaling during vertebrate neural tube patterning: the role of negative feedback. Cold Spring Harbor perspectives in biology, 1(2), a002014. [PubMed:20066087] [PMC] [WorldCat] [DOI] - ↑
Le Dréau, G., & Martí, E. (2012).
Dorsal-ventral patterning of the neural tube: a tale of three signals. Developmental neurobiology, 72(12), 1471-81. [PubMed:22821665] [WorldCat] [DOI] - ↑
Pierani, A., Brenner-Morton, S., Chiang, C., & Jessell, T.M. (1999).
A sonic hedgehog-independent, retinoid-activated pathway of neurogenesis in the ventral spinal cord. Cell, 97(7), 903-15. [PubMed:10399918] [WorldCat] [DOI] - ↑
Rowitch, D.H., & Kriegstein, A.R. (2010).
Developmental genetics of vertebrate glial-cell specification. Nature, 468(7321), 214-22. [PubMed:21068830] [WorldCat] [DOI] - ↑
Vallstedt, A., Klos, J.M., & Ericson, J. (2005).
Multiple dorsoventral origins of oligodendrocyte generation in the spinal cord and hindbrain. Neuron, 45(1), 55-67. [PubMed:15629702] [WorldCat] [DOI] - ↑
Hochstim, C., Deneen, B., Lukaszewicz, A., Zhou, Q., & Anderson, D.J. (2008).
Identification of positionally distinct astrocyte subtypes whose identities are specified by a homeodomain code. Cell, 133(3), 510-22. [PubMed:18455991] [PMC] [WorldCat] [DOI] - ↑
Tien, A.C., Tsai, H.H., Molofsky, A.V., McMahon, M., Foo, L.C., Kaul, A., ..., & Rowitch, D.H. (2012).
Regulated temporal-spatial astrocyte precursor cell proliferation involves BRAF signalling in mammalian spinal cord. Development (Cambridge, England), 139(14), 2477-87. [PubMed:22675209] [PMC] [WorldCat] [DOI] - ↑
Tsai, H.H., Li, H., Fuentealba, L.C., Molofsky, A.V., Taveira-Marques, R., Zhuang, H., ..., & Rowitch, D.H. (2012).
Regional astrocyte allocation regulates CNS synaptogenesis and repair. Science (New York, N.Y.), 337(6092), 358-62. [PubMed:22745251] [PMC] [WorldCat] [DOI] - ↑
Tsuchida, T., Ensini, M., Morton, S.B., Baldassare, M., Edlund, T., Jessell, T.M., & Pfaff, S.L. (1994).
Topographic organization of embryonic motor neurons defined by expression of LIM homeobox genes. Cell, 79(6), 957-70. [PubMed:7528105] [WorldCat] [DOI] - ↑
Dasen, J.S., Liu, J.P., & Jessell, T.M. (2003).
Motor neuron columnar fate imposed by sequential phases of Hox-c activity. Nature, 425(6961), 926-33. [PubMed:14586461] [WorldCat] [DOI] - ↑
Dalla Torre di Sanguinetto, S.A., Dasen, J.S., & Arber, S. (2008).
Transcriptional mechanisms controlling motor neuron diversity and connectivity. Current opinion in neurobiology, 18(1), 36-43. [PubMed:18524570] [WorldCat] [DOI]