「脳の領域化」の版間の差分
細 (→脳の各領域に発現する転写因子) |
|||
| (同じ利用者による、間の1版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/noriakisasai 笹井 紀明]</font><br> | <font size="+1">[http://researchmap.jp/noriakisasai 笹井 紀明]</font><br> | ||
''奈良先端科学技術大学院大学''<br> | ''奈良先端科学技術大学院大学''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2020年7月18日 原稿完成日:2020年9月14日<br> | ||
担当編集委員:[https://researchmap.jp/hiroshikawasaki 河崎 洋志](金沢大学 医学系 脳神経医学教室)<br> | 担当編集委員:[https://researchmap.jp/hiroshikawasaki 河崎 洋志](金沢大学 医学系 脳神経医学教室)<br> | ||
</div> | </div> | ||
英:regionalization of the brain | 英:regionalization of the brain | ||
{{box|text= | {{box|text= 脳が神経系の中枢として機能を発揮するためには、脳を構成する細胞が機能を分担し、それらがネットワークを介して相互作用することが必要である。このうち、脳神経細胞の機能分担は発生の初期から始まっており、各細胞が徐々に特定の機能を獲得するだけでなく、類似の性質を持つ細胞が集団を形成して決まった位置に形成される。このように、集団を形成した脳神経細胞(またはその前駆細胞)が脳の中で特定の位置に形成されることを「脳の領域化」という。}} | ||
==脳の領域化とは== | ==脳の領域化とは== | ||
| 13行目: | 13行目: | ||
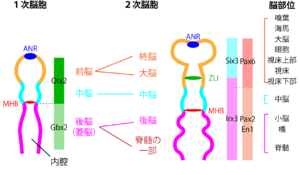
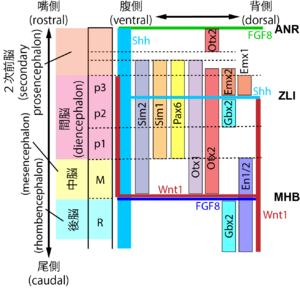
[[ファイル:Sasai Regionalization Fig2.png|サムネイル|'''図2. 前後軸、背腹軸に沿った分泌因子、転写因子の一部の発現領域'''<br>Mはmesencephalon、Rはrhombencephalon。間脳領域はpretectum (視蓋前域; p1), thalamus (視床; p2 ) prethalamus (視床下部; p3)3つの領域に分けられる。<br><ref name=Harada2016><pubmed>27273073</pubmed></ref><ref name=Martinez2013>'''Martínez, S.P., E.; Echevarria, D. (2013)'''<br>Ontogeny of the Vertebrate Nervous System<br>Neurosciences - From Molecule to Behavior: a university textbook. pp 47-61</ref><ref name=Vieira2010><pubmed>19876817</pubmed></ref><ref name><pubmed> 22654731 </pubmed></ref>などを参考にして作成。]] | [[ファイル:Sasai Regionalization Fig2.png|サムネイル|'''図2. 前後軸、背腹軸に沿った分泌因子、転写因子の一部の発現領域'''<br>Mはmesencephalon、Rはrhombencephalon。間脳領域はpretectum (視蓋前域; p1), thalamus (視床; p2 ) prethalamus (視床下部; p3)3つの領域に分けられる。<br><ref name=Harada2016><pubmed>27273073</pubmed></ref><ref name=Martinez2013>'''Martínez, S.P., E.; Echevarria, D. (2013)'''<br>Ontogeny of the Vertebrate Nervous System<br>Neurosciences - From Molecule to Behavior: a university textbook. pp 47-61</ref><ref name=Vieira2010><pubmed>19876817</pubmed></ref><ref name><pubmed> 22654731 </pubmed></ref>などを参考にして作成。]] | ||
脳は、発生初期には均一な[[神経前駆細胞]]の集団だが、発生の進行とともに個々の細胞が特定の性質を獲得し、[[神経細胞|脳神経細胞]]としての役割を持つようになる。この過程で、各機能を持った細胞は集団として特定の位置に形成され、各細胞が同一集団内、または集団を越えて相互作用し、脳が全体として[[中枢神経系|中枢神経]]としての機能を発揮するようになる。この課程で、特定の機能を持った細胞が集団を形成して特定の位置に形成されることを「脳の領域化」という。 | |||
各細胞が特定の機能を獲得したことは、多くの場合、特定の[[転写因子]](多くは[[ホメオボックス型転写因子]]:'''図1'''、'''2'''、'''表''')を発現したことにより同定できる。 | |||
== 初期胚におけるおおまかな脳領域の決定 == | == 初期胚におけるおおまかな脳領域の決定 == | ||
[[脊椎動物]]では、[[wj:原腸形成期|原腸形成期]]に胚の背側に[[神経板]]が出現し、原腸形成期の後半から[[orthodenticle homeobox 2]] ([[otx2]])という転写因子が、頭部神経板領域(将来[[前脳]]・[[中脳]]領域に分化する部分)に発現する<ref name=Acampora1995><pubmed>7588062</pubmed></ref> 。Otx2はほかに[[wj:胚盤葉|胚盤葉]]上層、[[眼]]にも発現しており、それぞれの発現領域に特異的な[[エンハンサー]]領域が存在する <ref name=Kurokawa2004><pubmed>15201223</pubmed></ref> 。一方、後脳には別の転写因子[[Gbx2]]が発現し <ref name=Islam2006><pubmed>17067785</pubmed></ref> 、otx2遺伝子のエンハンサー領域の一部に結合してotx2の発現領域を制限する <ref name=Inoue2012><pubmed>22566684</pubmed></ref> 。 | |||
== 2次オーガナイザー領域の形成 == | == 2次オーガナイザー領域の形成 == | ||
脳のさらなる領域化には、以下の3つの特定の領域([[シグナリングセンター]]として[[分泌因子]]を産生する領域)が存在し、[[線維芽細胞増殖因子]] ([[fibroblast growth factor]]; [[FGF]])や[[ソニック・ヘッジホッグ]]([[Sonic Hedgehog]], [[Shh]])、[[Wnt]]などの分泌因子を発現し、それらが転写因子の発現を誘導することにより脳の領域を決定している。これら分泌因子を発現する領域は、神経誘導を促すオーガナイザーよりも発生学的に後に出現するために、「[[2次オーガナイザー]]」と呼ばれている(なお以下のオーガナイザー領域の日本語名は、英語名を直訳した試訳である)。 | |||
=== 前部神経端 === | === 前部神経端 === | ||
[[前部神経端]]([[Anterior neural ridge]], ANR)は非神経性細胞からなっているが、主に[[FGF8]]を発現しており、転写因子[[BF-1]]の発現を誘導する。BF-1はANRの機能を相補する(ANRがなくてもBF-1が発現したら終脳が正常に発生する)ため、BF-1はANRによって誘導される主要な因子である <ref name=Shimamura1997><pubmed>9226442</pubmed></ref> ('''図1'''、'''2''')。 | |||
=== Zona limitans intrathalamica === | === Zona limitans intrathalamica === | ||
[[Zona limitans intrathalamica]] ([[ZLI]])は、[[前脳]]から発生した[[大脳]]を2つの異なる性質を持つ領域に分ける領域である。大脳部分は[[プロソメア]]という区分に従って3つに分割することができるが、前部から順に、p3, p2, p1と分けられる領域のうち、p2とp3を分けるものがZLIである。ZLIが発現するのはソニック・ヘッジホッグである<ref name=Kiecker2004><pubmed>15494730</pubmed></ref> 。ZLIの前後では、ソニック・ヘッジホッグに対する細胞の反応性が異なり、ZLIよりも前部では[[dlx2]]が、後部では[[irx3]]、[[gbx2]]の発現が誘導される('''図1''')。 | |||
=== | ===中脳/後脳境界 === | ||
[[中脳/後脳境界]]([[midbrain-hindbrain boundary]], [[MHB]]または[[isthmic organiser]], [[IsO]])からは、FGF8や[[Wnt1]]などの分泌因子が分泌され、[[中脳]]や[[小脳]]に発現する転写因子を発現誘導する。MHBにおけるfgf8やwnt1の発現には転写因子[[Lmx1b]]が必要だと言われている<ref name=Guo2007><pubmed>17166916</pubmed></ref> 。FGF8はMHBの前後である中脳と後脳に発現する遺伝子を誘導する一方、Wnt1は細胞の増殖などに関与していると考えられている <ref name=Harada2016><pubmed>27273073</pubmed></ref>('''図1'''、'''2''') 。 | |||
== 脳の各領域に発現する転写因子 == | == 脳の各領域に発現する転写因子 == | ||
上述の2次オーガナイザー領域から分泌されたFGFやWntなどのシグナル因子により、転写因子が脳の特定の領域に発現し、各領域を特徴付けている('''図2''') | 上述の2次オーガナイザー領域から分泌されたFGFやWntなどのシグナル因子により、転写因子が脳の特定の領域に発現し、各領域を特徴付けている('''図2''')。これらの転写因子の[[ノックアウトマウス]]は、一部は脳領域の一部を欠損することになり、脳の発達または成長に大きな影響を及ぼすために胚性致死となることが多い。一方、これらの転写因子は、免疫細胞、内分泌系、腎臓や精巣、肺などにも発現する。したがって、各遺伝子の単純なノックアウトでは、表現型が脳以外の領域にも見られるものがある(Irx3、[[Nkx2.1]]、[[Sim-2]]、[[Lmx1b]]、[[BF2]]など)。これらの例では、脳領域における機能を明らかにするために、脳特異的なノックアウト(条件付き遺伝子ノックアウト:コンディショナルノックアウト)が作成され、解析が進んでいる('''表''')。また一部の転写因子については、その変異がヒトの脳疾患や精神疾患を引き起こすと報告されている('''表''')。 | ||
{| class="wikitable" | {| class="wikitable" | ||
| 46行目: | 43行目: | ||
! 転写因子 遺伝子名 !! 転写因子としてのクラス !! 脳の発生期における発現領域 !! 変異マウスの表現型 !! ヒト疾患との関連 !! 文献 | ! 転写因子 遺伝子名 !! 転写因子としてのクラス !! 脳の発生期における発現領域 !! 変異マウスの表現型 !! ヒト疾患との関連 !! 文献 | ||
|- | |- | ||
! ARX (Aristaless-related Homeobox) | ! [[ARX]] ([[Aristaless-related Homeobox]]) | ||
| ホメオボックス型 || 終脳(背側)、前脳(視床) || 新生仔死亡(マウスの系統による):脳細胞の増殖抑制により、前脳が矮小化。脳領域のみのコンディショナルノックアウトでは、腹側脳領域の異常拡大。|| 精神遅滞、てんかん、など ||<ref name=Bienvenu2002><pubmed>11971879</pubmed></ref><ref name=Kitamura2002><pubmed>12379852</pubmed></ref><ref name=Collombat2003><pubmed>14561778</pubmed></ref><ref name=Lim2019><pubmed>30659230</pubmed></ref><ref name=Friocourt2008><pubmed>18509041</pubmed></ref> | | [[ホメオボックス型]] || 終脳(背側)、前脳(視床) || 新生仔死亡(マウスの系統による):脳細胞の増殖抑制により、前脳が矮小化。脳領域のみのコンディショナルノックアウトでは、腹側脳領域の異常拡大。|| 精神遅滞、てんかん、など ||<ref name=Bienvenu2002><pubmed>11971879</pubmed></ref><ref name=Kitamura2002><pubmed>12379852</pubmed></ref><ref name=Collombat2003><pubmed>14561778</pubmed></ref><ref name=Lim2019><pubmed>30659230</pubmed></ref><ref name=Friocourt2008><pubmed>18509041</pubmed></ref> | ||
|- | |- | ||
! Dlx2 (Distal-less homeobox 2) | ! [[Dlx2]] ([[Distal-less homeobox 2]]) | ||
| ホメオボックス型 || 前脳(脳室帯、脳室下帯) || Dlx1/ | | ホメオボックス型 || 前脳(脳室帯、脳室下帯) || Dlx1/2のダブルノックアウトが新生仔死亡:終脳の神経分化が抑制され、グリア細胞が増加。[[網膜]]の[[神経節細胞]]層が[[アポトーシス]]を起こす。|| Dlx2遺伝子(2番染色体上)を含む領域が[[自閉症]]の発症と相関が高いことが示唆されている ||<ref name=Qiu1995><pubmed>7590232</pubmed></ref><ref name=deMelo2005><pubmed>15604100</pubmed></ref><ref name=Liu2009><pubmed>18728693</pubmed></ref><ref name=Petryniak2007><pubmed>17678855</pubmed></ref> | ||
|- | |- | ||
! Emx1 (Empty Spiracles Homeobox 1) | ! [[Emx1]] ([[Empty Spiracles Homeobox 1]]) | ||
| ホメオボックス型 || 前脳 || | | ホメオボックス型 || 前脳 || 生存可能:[[脳梁]]([[corpus callosum]])欠損 || [[カルマン症候群]]([[Kallmann syndrome]]:[[嗅覚]]低下と性腺機能低下)への関与が示唆されている||<ref name=Yoshida1997><pubmed>9006071</pubmed></ref><ref name=Kim2010><pubmed>20887964</pubmed></ref><ref name=Cecchi2000><pubmed>10906797</pubmed></ref><ref name=Gulisano1996><pubmed>8743751</pubmed></ref> | ||
|- | |- | ||
! Emx2 (Empty Spiracles Homeobox 2) | ! [[Emx2]] ([[Empty Spiracles Homeobox 2]]) | ||
| ホメオボックス型 || 前脳 || 皮質領域の矮小化 || | | ホメオボックス型 || 前脳 || 皮質領域の矮小化 || [[裂脳症]]([[schizencephaly]]) ||<ref name=Hamasaki2004><pubmed>15294144</pubmed></ref><ref name=Brunelli1996><pubmed>8528262</pubmed></ref><ref name=Cecchi2000><pubmed>10906797</pubmed></ref><ref name=Gulisano1996><pubmed>8743751</pubmed></ref> | ||
|- | |- | ||
! En-1 (Engrailed homeobox-1) | ! [[En-1]] ([[Engrailed homeobox-1]]) | ||
| ホメオボックス型 || 中脳と小脳(R1) || | | ホメオボックス型 || 中脳と小脳(R1) || 胚性致死:[[視蓋]]と小脳の発生不全 || [[パーキンソン病]] ||<ref name=Wurst1994><pubmed>7925010</pubmed></ref><ref name=Rekaik2015><pubmed>26459030</pubmed></ref><ref name=Kouwenhoven2016><pubmed>26879466</pubmed></ref> | ||
|- | |- | ||
! En-2 (Engrailed homeobox-2) | ! [[En-2]] ([[Engrailed homeobox-2]]) | ||
| ホメオボックス型 || 中脳、小脳 || 生存可能:神経行動学的、神経化学的異常 || | | ホメオボックス型 || 中脳、小脳 || 生存可能:神経行動学的、神経化学的異常 || [[自閉症スペクトラム障害]]に関与すると示唆されている | ||
||<ref name=Cheh2006><pubmed>16935268</pubmed></ref><ref name=Benayed2005><pubmed>16252243</pubmed></ref><ref name=Genestine2015><pubmed>26220976</pubmed></ref> | ||<ref name=Cheh2006><pubmed>16935268</pubmed></ref><ref name=Benayed2005><pubmed>16252243</pubmed></ref><ref name=Genestine2015><pubmed>26220976</pubmed></ref> | ||
|- | |- | ||
! FEZ/FEZF1/Znf312b (Forebrain Embryonic Zinc-finger 1) | ! [[FEZ]]/[[FEZF1]]/[[Znf312b]] ([[Forebrain Embryonic Zinc-finger 1]]) | ||
| C2H2-type | | [[C2H2-type zincフィンガー]] | ||
| | | 嗅球、前脳、[[外套層]] || FEZF2とのダブルノックアウトにより、視床、大脳の発生が停止 | ||
| カルマン症候群(Kallmann syndrome):嗅覚低下と性腺機能低下 | | カルマン症候群(Kallmann syndrome):嗅覚低下と性腺機能低下 | ||
| <ref name=Hirata2006><pubmed>16971467</pubmed></ref> | | <ref name=Hirata2006><pubmed>16971467</pubmed></ref> | ||
|- | |- | ||
! FoxD1/BF2 (Brain Factor-2) | ! [[FoxD1]]/[[BF2]] ([[Brain Factor-2]]) | ||
| Winged-Helix型 || 前脳 || 新生仔死亡:腎臓の間葉系間質細胞の発生に必要|| | | [[Winged-Helix型]] || 前脳 || 新生仔死亡:腎臓の間葉系間質細胞の発生に必要||胚発生期では、[[視床下部]]前部の神経前駆細胞の分化が抑制される||<ref name=Hatini1996><pubmed>8666231</pubmed></ref><ref name=Newman2018><pubmed> 29679559</pubmed></ref> | ||
|- | |- | ||
! FoxG1/BF-1 (Brain Factor-1) | ! [[FoxG1]]/[[BF-1]] ([[Brain Factor-1]]) | ||
| Winged-Helix型 || 終脳 || 新生仔死亡:終脳の矮小化 || Rett症候群 ||<ref name=Xuan1995><pubmed>7605629</pubmed></ref> | | Winged-Helix型 || 終脳 || 新生仔死亡:終脳の矮小化 || Rett症候群 ||<ref name=Xuan1995><pubmed>7605629</pubmed></ref> | ||
|- | |- | ||
! Gbx2 (Gastrulation Brain Homeobox 2) | ! [[Gbx2]] ([[Gastrulation Brain Homeobox 2]]) | ||
| ホメオボックス型 || 中脳、後脳(R1-R3) || R3領域が矮小化 || 大腸癌(Colon Small Cell | | ホメオボックス型 || 中脳、後脳(R1-R3) || R3領域が矮小化 || 大腸癌(Colon Small Cell Carcinoma)、[[Optiz-G/BBB Syndrome]](オピッツ症候群:脳、顔面、心臓、生殖器などの正中部形成不全) ||<ref name=Wassarman1997><pubmed>9247335</pubmed></ref><ref name=Waters2006><pubmed>16651541</pubmed></ref> | ||
|- | |- | ||
! Irx3 (Iroquois homeobox 3) | ! [[Irx3]] ([[Iroquois homeobox 3]]) | ||
| ホメオボックス型 || | | ホメオボックス型 || 中脳、[[視蓋]]前域、[[視床]] || [[Irx5]]とのダブルノックアウトで心臓の一部(流出部)の形成異常が見られている || 肥満への関与が示唆されている ||<ref name=Bosse1997><pubmed>9486539</pubmed></ref><ref name=Gaborit2012><pubmed>22992950</pubmed></ref><ref name=Gholamalizadeh2019><pubmed>31538128</pubmed></ref><ref name=deAraujo2020><pubmed>32035736</pubmed></ref> | ||
|- | |- | ||
! Lhx2 (LIM/homeobox transcription factor 2) | ! [[Lhx2]] ([[LIM/homeobox transcription factor 2]]) | ||
| LIMホメオボックス型 || 前脳 || | | [[LIMホメオボックス型]] || 前脳 || 眼・前脳の発生、[[嗅神経細胞]]の分化異常 || (報告なし) ||<ref name=Hirota2004><pubmed>15173589</pubmed></ref><ref name=Chou2019><pubmed>29522720</pubmed></ref><ref name=Porter1997><pubmed>9247336</pubmed></ref> | ||
|- | |- | ||
! Lmx1b | ! [[Lmx1b]] | ||
| LIMホメオボックス型 || 中脳、視蓋前域、視床 || Isthmic | | LIMホメオボックス型 || 中脳、視蓋前域、視床 || [[Isthmic Organiser]]の形成が阻害される。分化した[[糸球体上皮細胞]](podocyte)の消滅|| [[ネイル・パテラ症候群]]([[爪膝蓋骨症候群]]:爪の変形や腎臓障害など) ||<ref name=Burghardt2013><pubmed>23990680</pubmed></ref><ref name=Asbreuk2002><pubmed>12498783</pubmed></ref><ref name=Adams2000><pubmed>10751174</pubmed></ref><ref name=Guo2007><pubmed>17166916</pubmed></ref> | ||
|- | |- | ||
! Nkx2.1 | ! [[Nkx2.1]] | ||
| ホメオボックス型 || 視床下部 || | | ホメオボックス型 || 視床下部 || 新生仔死亡:呼吸器官と肺の形成異常。視床下部における[[メラノコルチン]]産生([[Pomc]]陽性)細胞の減少" | ||
| 肺腺癌の重篤化に関わっている ||<ref name=Yuan2000><pubmed>10706142</pubmed></ref><ref name=Winslow2011><pubmed>21471965</pubmed></ref><ref><pubmed>30886014</pubmed></ref> | | 肺腺癌の重篤化に関わっている ||<ref name=Yuan2000><pubmed>10706142</pubmed></ref><ref name=Winslow2011><pubmed>21471965</pubmed></ref><ref><pubmed>30886014</pubmed></ref> | ||
|- | |- | ||
! Nkx6.1 | ! [[Nkx6.1]] | ||
| ホメオボックス型 || 中脳底板 || | | ホメオボックス型 || 中脳底板 || [[膵臓]]のベータ細胞が減少 || Nkx6.1の強制発現ががん細胞の浸潤を防ぐ効果があると報告されている ||<ref name=Sander2000><pubmed>11076772</pubmed></ref><ref name=Taylor2013><pubmed>24035389</pubmed></ref> | ||
|- | |- | ||
! Otx2 (Orthodenticle homeobox 2) | ! [[Otx2]] ([[Orthodenticle homeobox 2]]) | ||
| ホメオボックス型 || 前脳、中脳 || 胚性致死:前脳、中脳欠損 || | | ホメオボックス型 || 前脳、中脳 || 胚性致死:前脳、中脳欠損 || 小眼球、網膜変性、複合[[下垂体ホルモン欠損症]] ||<ref name=Broccoli1999><pubmed>10490025</pubmed></ref><ref name=Vincent2014><pubmed>25293953</pubmed></ref><ref name=Patat2013><pubmed>24167467</pubmed></ref><ref name=Chassaing2012><pubmed>22577225</pubmed></ref><ref name=Acampora1995><pubmed>7588062</pubmed></ref> | ||
|- | |- | ||
! Pax2 (Paired box gene 2) | ! [[Pax2]] ([[Paired box gene 2]]) | ||
| paired box || 中脳、小脳領域、発生途上の眼、耳 || 耳の形成異常、視神経投射異常 ||腎細胞においてPax2の恒常的な発現が糸球体硬化(glomerulosclerosis)を引き起こす"||<ref name=Torres1996><pubmed>8951055</pubmed></ref><ref name=Patek2003><pubmed>12915483</pubmed></ref> | | [[paired box]] || 中脳、小脳領域、発生途上の眼、耳 || 耳の形成異常、視神経投射異常 ||腎細胞においてPax2の恒常的な発現が糸球体硬化(glomerulosclerosis)を引き起こす"||<ref name=Torres1996><pubmed>8951055</pubmed></ref><ref name=Patek2003><pubmed>12915483</pubmed></ref> | ||
|- | |- | ||
! Sim-1 (Single-minded homolog 1) | ! [[Sim-1]] ([[Single-minded homolog 1]]) | ||
| bHLH-PASドメイン || 視床下部 || | | [[bHLH-PASドメイン]] || 視床下部 || 新生仔死亡:[[視索上核]](supraoptic)と[[視床下部室傍核]](paraventricular)の形成不全 || 食欲過剰による肥満 ||<ref name=Tolson2014><pubmed>24773343</pubmed></ref><ref name=Holder2000><pubmed>10587584</pubmed></ref><ref name=Michaud2001><pubmed>11448938</pubmed></ref> | ||
|- | |- | ||
! Sim-2 (Single-minded homolog 2) | ! [[Sim-2]] ([[Single-minded homolog 2]]) | ||
| bHLH-PASドメイン || 視床下部前部 || 新生仔死亡:肺機能不全 || | | bHLH-PASドメイン || 視床下部前部 || 新生仔死亡:肺機能不全 || Sim2遺伝子の増幅により[[ダウン症]]が引き起こされると示唆されている ||<ref name=Goshu2002><pubmed>12024028</pubmed></ref><ref name=Dahmane1995><pubmed>7568099</pubmed></ref><ref name=Goshu2004><pubmed>14988428</pubmed></ref> | ||
|- | |- | ||
! Six3 (Sine Oculis Homeobox 3) | ! [[Six3]] ([[Sine Oculis Homeobox 3]]) | ||
| ホメオボックス型 || 発生初期には神経板、眼球、眼杯、中期以降は眼、耳、中脳、視蓋前側、ZLI(zona limitans | | ホメオボックス型 || 発生初期には神経板、眼球、眼杯、中期以降は眼、耳、中脳、視蓋前側、ZLI(zona limitans intrathalamica)、[[視床外腹側核]](rostral ventral thalamus) || 眼を含む前脳の前部を欠損 || 2型[[全前脳胞症]](Holoprosencephaly) ||<ref name=Wallis1999><pubmed>10369266</pubmed></ref><ref name=Diacou2018><pubmed>30485816</pubmed></ref><ref name=Lagutin2003><pubmed>12569128</pubmed></ref><ref name=Liu2010><pubmed>20890044</pubmed></ref> | ||
|} | |} | ||
[https://www.omim.org OMIM(Online Mendelian Inheritance in Man)]や[https://ghr.nlm.nih.gov NIH Genetics Home Reference]を参考に作成。 | [https://www.omim.org OMIM(Online Mendelian Inheritance in Man)]や[https://ghr.nlm.nih.gov NIH Genetics Home Reference]を参考に作成。 | ||
2022年12月1日 (木) 08:27時点における最新版
笹井 紀明
奈良先端科学技術大学院大学
DOI:10.14931/bsd.9270 原稿受付日:2020年7月18日 原稿完成日:2020年9月14日
担当編集委員:河崎 洋志(金沢大学 医学系 脳神経医学教室)
英:regionalization of the brain
脳が神経系の中枢として機能を発揮するためには、脳を構成する細胞が機能を分担し、それらがネットワークを介して相互作用することが必要である。このうち、脳神経細胞の機能分担は発生の初期から始まっており、各細胞が徐々に特定の機能を獲得するだけでなく、類似の性質を持つ細胞が集団を形成して決まった位置に形成される。このように、集団を形成した脳神経細胞(またはその前駆細胞)が脳の中で特定の位置に形成されることを「脳の領域化」という。
脳の領域化とは
脳は、発生初期には均一な神経前駆細胞の集団だが、発生の進行とともに個々の細胞が特定の性質を獲得し、脳神経細胞としての役割を持つようになる。この過程で、各機能を持った細胞は集団として特定の位置に形成され、各細胞が同一集団内、または集団を越えて相互作用し、脳が全体として中枢神経としての機能を発揮するようになる。この課程で、特定の機能を持った細胞が集団を形成して特定の位置に形成されることを「脳の領域化」という。
各細胞が特定の機能を獲得したことは、多くの場合、特定の転写因子(多くはホメオボックス型転写因子:図1、2、表)を発現したことにより同定できる。
初期胚におけるおおまかな脳領域の決定
脊椎動物では、原腸形成期に胚の背側に神経板が出現し、原腸形成期の後半からorthodenticle homeobox 2 (otx2)という転写因子が、頭部神経板領域(将来前脳・中脳領域に分化する部分)に発現する[6] 。Otx2はほかに胚盤葉上層、眼にも発現しており、それぞれの発現領域に特異的なエンハンサー領域が存在する [7] 。一方、後脳には別の転写因子Gbx2が発現し [8] 、otx2遺伝子のエンハンサー領域の一部に結合してotx2の発現領域を制限する [9] 。
2次オーガナイザー領域の形成
脳のさらなる領域化には、以下の3つの特定の領域(シグナリングセンターとして分泌因子を産生する領域)が存在し、線維芽細胞増殖因子 (fibroblast growth factor; FGF)やソニック・ヘッジホッグ(Sonic Hedgehog, Shh)、Wntなどの分泌因子を発現し、それらが転写因子の発現を誘導することにより脳の領域を決定している。これら分泌因子を発現する領域は、神経誘導を促すオーガナイザーよりも発生学的に後に出現するために、「2次オーガナイザー」と呼ばれている(なお以下のオーガナイザー領域の日本語名は、英語名を直訳した試訳である)。
前部神経端
前部神経端(Anterior neural ridge, ANR)は非神経性細胞からなっているが、主にFGF8を発現しており、転写因子BF-1の発現を誘導する。BF-1はANRの機能を相補する(ANRがなくてもBF-1が発現したら終脳が正常に発生する)ため、BF-1はANRによって誘導される主要な因子である [10] (図1、2)。
Zona limitans intrathalamica
Zona limitans intrathalamica (ZLI)は、前脳から発生した大脳を2つの異なる性質を持つ領域に分ける領域である。大脳部分はプロソメアという区分に従って3つに分割することができるが、前部から順に、p3, p2, p1と分けられる領域のうち、p2とp3を分けるものがZLIである。ZLIが発現するのはソニック・ヘッジホッグである[11] 。ZLIの前後では、ソニック・ヘッジホッグに対する細胞の反応性が異なり、ZLIよりも前部ではdlx2が、後部ではirx3、gbx2の発現が誘導される(図1)。
中脳/後脳境界
中脳/後脳境界(midbrain-hindbrain boundary, MHBまたはisthmic organiser, IsO)からは、FGF8やWnt1などの分泌因子が分泌され、中脳や小脳に発現する転写因子を発現誘導する。MHBにおけるfgf8やwnt1の発現には転写因子Lmx1bが必要だと言われている[12] 。FGF8はMHBの前後である中脳と後脳に発現する遺伝子を誘導する一方、Wnt1は細胞の増殖などに関与していると考えられている [2](図1、2) 。
脳の各領域に発現する転写因子
上述の2次オーガナイザー領域から分泌されたFGFやWntなどのシグナル因子により、転写因子が脳の特定の領域に発現し、各領域を特徴付けている(図2)。これらの転写因子のノックアウトマウスは、一部は脳領域の一部を欠損することになり、脳の発達または成長に大きな影響を及ぼすために胚性致死となることが多い。一方、これらの転写因子は、免疫細胞、内分泌系、腎臓や精巣、肺などにも発現する。したがって、各遺伝子の単純なノックアウトでは、表現型が脳以外の領域にも見られるものがある(Irx3、Nkx2.1、Sim-2、Lmx1b、BF2など)。これらの例では、脳領域における機能を明らかにするために、脳特異的なノックアウト(条件付き遺伝子ノックアウト:コンディショナルノックアウト)が作成され、解析が進んでいる(表)。また一部の転写因子については、その変異がヒトの脳疾患や精神疾患を引き起こすと報告されている(表)。
| 転写因子 遺伝子名 | 転写因子としてのクラス | 脳の発生期における発現領域 | 変異マウスの表現型 | ヒト疾患との関連 | 文献 |
|---|---|---|---|---|---|
| ARX (Aristaless-related Homeobox) | ホメオボックス型 | 終脳(背側)、前脳(視床) | 新生仔死亡(マウスの系統による):脳細胞の増殖抑制により、前脳が矮小化。脳領域のみのコンディショナルノックアウトでは、腹側脳領域の異常拡大。 | 精神遅滞、てんかん、など | [13][14][15][16][17] |
| Dlx2 (Distal-less homeobox 2) | ホメオボックス型 | 前脳(脳室帯、脳室下帯) | Dlx1/2のダブルノックアウトが新生仔死亡:終脳の神経分化が抑制され、グリア細胞が増加。網膜の神経節細胞層がアポトーシスを起こす。 | Dlx2遺伝子(2番染色体上)を含む領域が自閉症の発症と相関が高いことが示唆されている | [18][19][20][21] |
| Emx1 (Empty Spiracles Homeobox 1) | ホメオボックス型 | 前脳 | 生存可能:脳梁(corpus callosum)欠損 | カルマン症候群(Kallmann syndrome:嗅覚低下と性腺機能低下)への関与が示唆されている | [22][23][24][25] |
| Emx2 (Empty Spiracles Homeobox 2) | ホメオボックス型 | 前脳 | 皮質領域の矮小化 | 裂脳症(schizencephaly) | [26][27][24][25] |
| En-1 (Engrailed homeobox-1) | ホメオボックス型 | 中脳と小脳(R1) | 胚性致死:視蓋と小脳の発生不全 | パーキンソン病 | [28][29][30] |
| En-2 (Engrailed homeobox-2) | ホメオボックス型 | 中脳、小脳 | 生存可能:神経行動学的、神経化学的異常 | 自閉症スペクトラム障害に関与すると示唆されている | [31][32][33] |
| FEZ/FEZF1/Znf312b (Forebrain Embryonic Zinc-finger 1) | C2H2-type zincフィンガー | 嗅球、前脳、外套層 | FEZF2とのダブルノックアウトにより、視床、大脳の発生が停止 | カルマン症候群(Kallmann syndrome):嗅覚低下と性腺機能低下 | [34] |
| FoxD1/BF2 (Brain Factor-2) | Winged-Helix型 | 前脳 | 新生仔死亡:腎臓の間葉系間質細胞の発生に必要 | 胚発生期では、視床下部前部の神経前駆細胞の分化が抑制される | [35][36] |
| FoxG1/BF-1 (Brain Factor-1) | Winged-Helix型 | 終脳 | 新生仔死亡:終脳の矮小化 | Rett症候群 | [37] |
| Gbx2 (Gastrulation Brain Homeobox 2) | ホメオボックス型 | 中脳、後脳(R1-R3) | R3領域が矮小化 | 大腸癌(Colon Small Cell Carcinoma)、Optiz-G/BBB Syndrome(オピッツ症候群:脳、顔面、心臓、生殖器などの正中部形成不全) | [38][39] |
| Irx3 (Iroquois homeobox 3) | ホメオボックス型 | 中脳、視蓋前域、視床 | Irx5とのダブルノックアウトで心臓の一部(流出部)の形成異常が見られている | 肥満への関与が示唆されている | [40][41][42][43] |
| Lhx2 (LIM/homeobox transcription factor 2) | LIMホメオボックス型 | 前脳 | 眼・前脳の発生、嗅神経細胞の分化異常 | (報告なし) | [44][45][46] |
| Lmx1b | LIMホメオボックス型 | 中脳、視蓋前域、視床 | Isthmic Organiserの形成が阻害される。分化した糸球体上皮細胞(podocyte)の消滅 | ネイル・パテラ症候群(爪膝蓋骨症候群:爪の変形や腎臓障害など) | [47][48][49][12] |
| Nkx2.1 | ホメオボックス型 | 視床下部 | 新生仔死亡:呼吸器官と肺の形成異常。視床下部におけるメラノコルチン産生(Pomc陽性)細胞の減少" | 肺腺癌の重篤化に関わっている | [50][51][52] |
| Nkx6.1 | ホメオボックス型 | 中脳底板 | 膵臓のベータ細胞が減少 | Nkx6.1の強制発現ががん細胞の浸潤を防ぐ効果があると報告されている | [53][54] |
| Otx2 (Orthodenticle homeobox 2) | ホメオボックス型 | 前脳、中脳 | 胚性致死:前脳、中脳欠損 | 小眼球、網膜変性、複合下垂体ホルモン欠損症 | [55][56][57][58][6] |
| Pax2 (Paired box gene 2) | paired box | 中脳、小脳領域、発生途上の眼、耳 | 耳の形成異常、視神経投射異常 | 腎細胞においてPax2の恒常的な発現が糸球体硬化(glomerulosclerosis)を引き起こす" | [59][60] |
| Sim-1 (Single-minded homolog 1) | bHLH-PASドメイン | 視床下部 | 新生仔死亡:視索上核(supraoptic)と視床下部室傍核(paraventricular)の形成不全 | 食欲過剰による肥満 | [61][62][63] |
| Sim-2 (Single-minded homolog 2) | bHLH-PASドメイン | 視床下部前部 | 新生仔死亡:肺機能不全 | Sim2遺伝子の増幅によりダウン症が引き起こされると示唆されている | [64][65][66] |
| Six3 (Sine Oculis Homeobox 3) | ホメオボックス型 | 発生初期には神経板、眼球、眼杯、中期以降は眼、耳、中脳、視蓋前側、ZLI(zona limitans intrathalamica)、視床外腹側核(rostral ventral thalamus) | 眼を含む前脳の前部を欠損 | 2型全前脳胞症(Holoprosencephaly) | [67][68][69][70] |
OMIM(Online Mendelian Inheritance in Man)やNIH Genetics Home Referenceを参考に作成。
関連項目
参考文献
- ↑ Scott F. Gilbert & Michael J. F. Baressi. (2016)
Developmental Biology, Eleventh Edition
Sinauer Associates Inc. - ↑ 2.0 2.1
Harada, H., Sato, T., & Nakamura, H. (2016).
Fgf8 signaling for development of the midbrain and hindbrain. Development, growth & differentiation, 58(5), 437-45. [PubMed:27273073] [WorldCat] [DOI] - ↑ Martínez, S.P., E.; Echevarria, D. (2013)
Ontogeny of the Vertebrate Nervous System
Neurosciences - From Molecule to Behavior: a university textbook. pp 47-61 - ↑
Vieira, C., Pombero, A., García-Lopez, R., Gimeno, L., Echevarria, D., & Martínez, S. (2010).
Molecular mechanisms controlling brain development: an overview of neuroepithelial secondary organizers. The International journal of developmental biology, 54(1), 7-20. [PubMed:19876817] [WorldCat] [DOI] - ↑
Martinez-Ferre, A., & Martinez, S. (2012).
Molecular regionalization of the diencephalon. Frontiers in neuroscience, 6, 73. [PubMed:22654731] [PMC] [WorldCat] [DOI] - ↑ 6.0 6.1
Acampora, D., Mazan, S., Lallemand, Y., Avantaggiato, V., Maury, M., Simeone, A., & Brûlet, P. (1995).
Forebrain and midbrain regions are deleted in Otx2-/- mutants due to a defective anterior neuroectoderm specification during gastrulation. Development (Cambridge, England), 121(10), 3279-90. [PubMed:7588062] [WorldCat] - ↑
Kurokawa, D., Takasaki, N., Kiyonari, H., Nakayama, R., Kimura-Yoshida, C., Matsuo, I., & Aizawa, S. (2004).
Regulation of Otx2 expression and its functions in mouse epiblast and anterior neuroectoderm. Development (Cambridge, England), 131(14), 3307-17. [PubMed:15201223] [WorldCat] [DOI] - ↑
Islam, M.E., Kikuta, H., Inoue, F., Kanai, M., Kawakami, A., Parvin, M.S., ..., & Yamasu, K. (2006).
Three enhancer regions regulate gbx2 gene expression in the isthmic region during zebrafish development. Mechanisms of development, 123(12), 907-24. [PubMed:17067785] [WorldCat] [DOI] - ↑
Inoue, F., Kurokawa, D., Takahashi, M., & Aizawa, S. (2012).
Gbx2 directly restricts Otx2 expression to forebrain and midbrain, competing with class III POU factors. Molecular and cellular biology, 32(13), 2618-27. [PubMed:22566684] [PMC] [WorldCat] [DOI] - ↑
Shimamura, K., & Rubenstein, J.L. (1997).
Inductive interactions direct early regionalization of the mouse forebrain. Development (Cambridge, England), 124(14), 2709-18. [PubMed:9226442] [WorldCat] - ↑
Kiecker, C., & Lumsden, A. (2004).
Hedgehog signaling from the ZLI regulates diencephalic regional identity. Nature neuroscience, 7(11), 1242-9. [PubMed:15494730] [WorldCat] [DOI] - ↑ 12.0 12.1
Guo, C., Qiu, H.Y., Huang, Y., Chen, H., Yang, R.Q., Chen, S.D., ..., & Ding, Y.Q. (2007).
Lmx1b is essential for Fgf8 and Wnt1 expression in the isthmic organizer during tectum and cerebellum development in mice. Development (Cambridge, England), 134(2), 317-25. [PubMed:17166916] [WorldCat] [DOI] - ↑
Bienvenu, T., Poirier, K., Friocourt, G., Bahi, N., Beaumont, D., Fauchereau, F., ..., & Chelly, J. (2002).
ARX, a novel Prd-class-homeobox gene highly expressed in the telencephalon, is mutated in X-linked mental retardation. Human molecular genetics, 11(8), 981-91. [PubMed:11971879] [WorldCat] [DOI] - ↑
Kitamura, K., Yanazawa, M., Sugiyama, N., Miura, H., Iizuka-Kogo, A., Kusaka, M., ..., & Morohashi, K. (2002).
Mutation of ARX causes abnormal development of forebrain and testes in mice and X-linked lissencephaly with abnormal genitalia in humans. Nature genetics, 32(3), 359-69. [PubMed:12379852] [WorldCat] [DOI] - ↑
Collombat, P., Mansouri, A., Hecksher-Sorensen, J., Serup, P., Krull, J., Gradwohl, G., & Gruss, P. (2003).
Opposing actions of Arx and Pax4 in endocrine pancreas development. Genes & development, 17(20), 2591-603. [PubMed:14561778] [PMC] [WorldCat] [DOI] - ↑
Lim, Y., Cho, I.T., Shi, X., Grinspan, J.B., Cho, G., & Golden, J.A. (2019).
Arx Expression Suppresses Ventralization of the Developing Dorsal Forebrain. Scientific reports, 9(1), 226. [PubMed:30659230] [PMC] [WorldCat] [DOI] - ↑
Friocourt, G., Kanatani, S., Tabata, H., Yozu, M., Takahashi, T., Antypa, M., ..., & Parnavelas, J.G. (2008).
Cell-autonomous roles of ARX in cell proliferation and neuronal migration during corticogenesis. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(22), 5794-805. [PubMed:18509041] [PMC] [WorldCat] [DOI] - ↑
Qiu, M., Bulfone, A., Martinez, S., Meneses, J.J., Shimamura, K., Pedersen, R.A., & Rubenstein, J.L. (1995).
Null mutation of Dlx-2 results in abnormal morphogenesis of proximal first and second branchial arch derivatives and abnormal differentiation in the forebrain. Genes & development, 9(20), 2523-38. [PubMed:7590232] [WorldCat] [DOI] - ↑
de Melo, J., Du, G., Fonseca, M., Gillespie, L.A., Turk, W.J., Rubenstein, J.L., & Eisenstat, D.D. (2005).
Dlx1 and Dlx2 function is necessary for terminal differentiation and survival of late-born retinal ganglion cells in the developing mouse retina. Development (Cambridge, England), 132(2), 311-22. [PubMed:15604100] [WorldCat] [DOI] - ↑
Liu, X., Novosedlik, N., Wang, A., Hudson, M.L., Cohen, I.L., Chudley, A.E., ..., & Holden, J.J. (2009).
The DLX1and DLX2 genes and susceptibility to autism spectrum disorders. European journal of human genetics : EJHG, 17(2), 228-35. [PubMed:18728693] [PMC] [WorldCat] [DOI] - ↑
Petryniak, M.A., Potter, G.B., Rowitch, D.H., & Rubenstein, J.L. (2007).
Dlx1 and Dlx2 control neuronal versus oligodendroglial cell fate acquisition in the developing forebrain. Neuron, 55(3), 417-33. [PubMed:17678855] [PMC] [WorldCat] [DOI] - ↑
Yoshida, M., Suda, Y., Matsuo, I., Miyamoto, N., Takeda, N., Kuratani, S., & Aizawa, S. (1997).
Emx1 and Emx2 functions in development of dorsal telencephalon. Development (Cambridge, England), 124(1), 101-11. [PubMed:9006071] [WorldCat] - ↑
Kim, H.G., Ahn, J.W., Kurth, I., Ullmann, R., Kim, H.T., Kulharya, A., ..., & Layman, L.C. (2010).
WDR11, a WD protein that interacts with transcription factor EMX1, is mutated in idiopathic hypogonadotropic hypogonadism and Kallmann syndrome. American journal of human genetics, 87(4), 465-79. [PubMed:20887964] [PMC] [WorldCat] [DOI] - ↑ 24.0 24.1
Cecchi, C., & Boncinelli, E. (2000).
Emx homeogenes and mouse brain development. Trends in neurosciences, 23(8), 347-52. [PubMed:10906797] [WorldCat] [DOI] - ↑ 25.0 25.1
Gulisano, M., Broccoli, V., Pardini, C., & Boncinelli, E. (1996).
Emx1 and Emx2 show different patterns of expression during proliferation and differentiation of the developing cerebral cortex in the mouse. The European journal of neuroscience, 8(5), 1037-50. [PubMed:8743751] [WorldCat] [DOI] - ↑
Hamasaki, T., Leingärtner, A., Ringstedt, T., & O'Leary, D.D. (2004).
EMX2 regulates sizes and positioning of the primary sensory and motor areas in neocortex by direct specification of cortical progenitors. Neuron, 43(3), 359-72. [PubMed:15294144] [WorldCat] [DOI] - ↑
Brunelli, S., Faiella, A., Capra, V., Nigro, V., Simeone, A., Cama, A., & Boncinelli, E. (1996).
Germline mutations in the homeobox gene EMX2 in patients with severe schizencephaly. Nature genetics, 12(1), 94-6. [PubMed:8528262] [WorldCat] [DOI] - ↑
Wurst, W., Auerbach, A.B., & Joyner, A.L. (1994).
Multiple developmental defects in Engrailed-1 mutant mice: an early mid-hindbrain deletion and patterning defects in forelimbs and sternum. Development (Cambridge, England), 120(7), 2065-75. [PubMed:7925010] [WorldCat] - ↑
Rekaik, H., Blaudin de Thé, F.X., Prochiantz, A., Fuchs, J., & Joshi, R.L. (2015).
Dissecting the role of Engrailed in adult dopaminergic neurons--Insights into Parkinson disease pathogenesis. FEBS letters, 589(24 Pt A), 3786-94. [PubMed:26459030] [PMC] [WorldCat] [DOI] - ↑
Kouwenhoven, W.M., Veenvliet, J.V., van Hooft, J.A., van der Heide, L.P., & Smidt, M.P. (2016).
Engrailed 1 shapes the dopaminergic and serotonergic landscape through proper isthmic organizer maintenance and function. Biology open, 5(3), 279-88. [PubMed:26879466] [PMC] [WorldCat] [DOI] - ↑
Cheh, M.A., Millonig, J.H., Roselli, L.M., Ming, X., Jacobsen, E., Kamdar, S., & Wagner, G.C. (2006).
En2 knockout mice display neurobehavioral and neurochemical alterations relevant to autism spectrum disorder. Brain research, 1116(1), 166-76. [PubMed:16935268] [WorldCat] [DOI] - ↑
Benayed, R., Gharani, N., Rossman, I., Mancuso, V., Lazar, G., Kamdar, S., ..., & Millonig, J.H. (2005).
Support for the homeobox transcription factor gene ENGRAILED 2 as an autism spectrum disorder susceptibility locus. American journal of human genetics, 77(5), 851-68. [PubMed:16252243] [PMC] [WorldCat] [DOI] - ↑
Genestine, M., Lin, L., Durens, M., Yan, Y., Jiang, Y., Prem, S., ..., & DiCicco-Bloom, E. (2015).
Engrailed-2 (En2) deletion produces multiple neurodevelopmental defects in monoamine systems, forebrain structures and neurogenesis and behavior. Human molecular genetics, 24(20), 5805-27. [PubMed:26220976] [PMC] [WorldCat] [DOI] - ↑
Hirata, T., Nakazawa, M., Muraoka, O., Nakayama, R., Suda, Y., & Hibi, M. (2006).
Zinc-finger genes Fez and Fez-like function in the establishment of diencephalon subdivisions. Development (Cambridge, England), 133(20), 3993-4004. [PubMed:16971467] [WorldCat] [DOI] - ↑
Hatini, V., Huh, S.O., Herzlinger, D., Soares, V.C., & Lai, E. (1996).
Essential role of stromal mesenchyme in kidney morphogenesis revealed by targeted disruption of Winged Helix transcription factor BF-2. Genes & development, 10(12), 1467-78. [PubMed:8666231] [WorldCat] [DOI] - ↑
Newman, E.A., Kim, D.W., Wan, J., Wang, J., Qian, J., & Blackshaw, S. (2018).
Foxd1 is required for terminal differentiation of anterior hypothalamic neuronal subtypes. Developmental biology, 439(2), 102-111. [PubMed:29679559] [PMC] [WorldCat] [DOI] - ↑
Xuan, S., Baptista, C.A., Balas, G., Tao, W., Soares, V.C., & Lai, E. (1995).
Winged helix transcription factor BF-1 is essential for the development of the cerebral hemispheres. Neuron, 14(6), 1141-52. [PubMed:7605629] [WorldCat] [DOI] - ↑
Wassarman, K.M., Lewandoski, M., Campbell, K., Joyner, A.L., Rubenstein, J.L., Martinez, S., & Martin, G.R. (1997).
Specification of the anterior hindbrain and establishment of a normal mid/hindbrain organizer is dependent on Gbx2 gene function. Development (Cambridge, England), 124(15), 2923-34. [PubMed:9247335] [WorldCat] - ↑
Waters, S.T., & Lewandoski, M. (2006).
A threshold requirement for Gbx2 levels in hindbrain development. Development (Cambridge, England), 133(10), 1991-2000. [PubMed:16651541] [WorldCat] [DOI] - ↑
Bosse, A., Zülch, A., Becker, M.B., Torres, M., Gómez-Skarmeta, J.L., Modolell, J., & Gruss, P. (1997).
Identification of the vertebrate Iroquois homeobox gene family with overlapping expression during early development of the nervous system. Mechanisms of development, 69(1-2), 169-81. [PubMed:9486539] [WorldCat] [DOI] - ↑
Gaborit, N., Sakuma, R., Wylie, J.N., Kim, K.H., Zhang, S.S., Hui, C.C., & Bruneau, B.G. (2012).
Cooperative and antagonistic roles for Irx3 and Irx5 in cardiac morphogenesis and postnatal physiology. Development (Cambridge, England), 139(21), 4007-19. [PubMed:22992950] [PMC] [WorldCat] [DOI] - ↑
Gholamalizadeh, M., Jarrahi, A.M., Akbari, M.E., Rezaei, S., Doaei, S., Mokhtari, Z., & Torki, A. (2019).
The possible mechanisms of the effects of IRX3 gene on body weight: an overview. Archives of medical sciences. Atherosclerotic diseases, 4, e225-e230. [PubMed:31538128] [PMC] [WorldCat] [DOI] - ↑
de Araújo, T.M., & Velloso, L.A. (2020).
Hypothalamic IRX3: A New Player in the Development of Obesity. Trends in endocrinology and metabolism: TEM, 31(5), 368-377. [PubMed:32035736] [WorldCat] [DOI] - ↑
Hirota, J., & Mombaerts, P. (2004).
The LIM-homeodomain protein Lhx2 is required for complete development of mouse olfactory sensory neurons. Proceedings of the National Academy of Sciences of the United States of America, 101(23), 8751-5. [PubMed:15173589] [PMC] [WorldCat] [DOI] - ↑
Chou, S.J., & Tole, S. (2019).
Lhx2, an evolutionarily conserved, multifunctional regulator of forebrain development. Brain research, 1705, 1-14. [PubMed:29522720] [WorldCat] [DOI] - ↑
Porter, F.D., Drago, J., Xu, Y., Cheema, S.S., Wassif, C., Huang, S.P., ..., & Westphal, H. (1997).
Lhx2, a LIM homeobox gene, is required for eye, forebrain, and definitive erythrocyte development. Development (Cambridge, England), 124(15), 2935-44. [PubMed:9247336] [WorldCat] - ↑
Burghardt, T., Kastner, J., Suleiman, H., Rivera-Milla, E., Stepanova, N., Lottaz, C., ..., & Witzgall, R. (2013).
LMX1B is essential for the maintenance of differentiated podocytes in adult kidneys. Journal of the American Society of Nephrology : JASN, 24(11), 1830-48. [PubMed:23990680] [PMC] [WorldCat] [DOI] - ↑
Asbreuk, C.H., Vogelaar, C.F., Hellemons, A., Smidt, M.P., & Burbach, J.P. (2002).
CNS expression pattern of Lmx1b and coexpression with ptx genes suggest functional cooperativity in the development of forebrain motor control systems. Molecular and cellular neurosciences, 21(3), 410-20. [PubMed:12498783] [WorldCat] [DOI] - ↑
Adams, K.A., Maida, J.M., Golden, J.A., & Riddle, R.D. (2000).
The transcription factor Lmx1b maintains Wnt1 expression within the isthmic organizer. Development (Cambridge, England), 127(9), 1857-67. [PubMed:10751174] [WorldCat] - ↑
Yuan, B., Li, C., Kimura, S., Engelhardt, R.T., Smith, B.R., & Minoo, P. (2000).
Inhibition of distal lung morphogenesis in Nkx2.1(-/-) embryos. Developmental dynamics : an official publication of the American Association of Anatomists, 217(2), 180-90. [PubMed:10706142] [WorldCat] [DOI] - ↑
Winslow, M.M., Dayton, T.L., Verhaak, R.G., Kim-Kiselak, C., Snyder, E.L., Feldser, D.M., ..., & Jacks, T. (2011).
Suppression of lung adenocarcinoma progression by Nkx2-1. Nature, 473(7345), 101-4. [PubMed:21471965] [PMC] [WorldCat] [DOI] - ↑
Orquera, D.P., Tavella, M.B., de Souza, F.S.J., Nasif, S., Low, M.J., & Rubinstein, M. (2019).
The Homeodomain Transcription Factor NKX2.1 Is Essential for the Early Specification of Melanocortin Neuron Identity and Activates Pomc Expression in the Developing Hypothalamus. The Journal of neuroscience : the official journal of the Society for Neuroscience, 39(21), 4023-4035. [PubMed:30886014] [PMC] [WorldCat] [DOI] - ↑
Sander, M., Sussel, L., Conners, J., Scheel, D., Kalamaras, J., Dela Cruz, F., ..., & German, M. (2000).
Homeobox gene Nkx6.1 lies downstream of Nkx2.2 in the major pathway of beta-cell formation in the pancreas. Development (Cambridge, England), 127(24), 5533-40. [PubMed:11076772] [WorldCat] - ↑
Taylor, B.L., Liu, F.F., & Sander, M. (2013).
Nkx6.1 is essential for maintaining the functional state of pancreatic beta cells. Cell reports, 4(6), 1262-75. [PubMed:24035389] [PMC] [WorldCat] [DOI] - ↑
Broccoli, V., Boncinelli, E., & Wurst, W. (1999).
The caudal limit of Otx2 expression positions the isthmic organizer. Nature, 401(6749), 164-8. [PubMed:10490025] [WorldCat] [DOI] - ↑
Vincent, A., Forster, N., Maynes, J.T., Paton, T.A., Billingsley, G., Roslin, N.M., ..., & Héon, E. (2014).
OTX2 mutations cause autosomal dominant pattern dystrophy of the retinal pigment epithelium. Journal of medical genetics, 51(12), 797-805. [PubMed:25293953] [WorldCat] [DOI] - ↑
Patat, O., van Ravenswaaij-Arts, C.M., Tantau, J., Corsten-Janssen, N., van Tintelen, J.P., Dijkhuizen, T., ..., & Chassaing, N. (2013).
Otocephaly-Dysgnathia Complex: Description of Four Cases and Confirmation of the Role of OTX2. Molecular syndromology, 4(6), 302-5. [PubMed:24167467] [PMC] [WorldCat] [DOI] - ↑
Chassaing, N., Sorrentino, S., Davis, E.E., Martin-Coignard, D., Iacovelli, A., Paznekas, W., ..., & Jabs, E.W. (2012).
OTX2 mutations contribute to the otocephaly-dysgnathia complex. Journal of medical genetics, 49(6), 373-9. [PubMed:22577225] [WorldCat] [DOI] - ↑
Torres, M., Gómez-Pardo, E., & Gruss, P. (1996).
Pax2 contributes to inner ear patterning and optic nerve trajectory. Development (Cambridge, England), 122(11), 3381-91. [PubMed:8951055] [WorldCat] - ↑
Patek, C.E., Fleming, S., Miles, C.G., Bellamy, C.O., Ladomery, M., Spraggon, L., ..., & Hooper, M.L. (2003).
Murine Denys-Drash syndrome: evidence of podocyte de-differentiation and systemic mediation of glomerulosclerosis. Human molecular genetics, 12(18), 2379-94. [PubMed:12915483] [WorldCat] [DOI] - ↑
Tolson, K.P., Gemelli, T., Meyer, D., Yazdani, U., Kozlitina, J., & Zinn, A.R. (2014).
Inducible neuronal inactivation of Sim1 in adult mice causes hyperphagic obesity. Endocrinology, 155(7), 2436-44. [PubMed:24773343] [PMC] [WorldCat] [DOI] - ↑
Holder, J.L., Butte, N.F., & Zinn, A.R. (2000).
Profound obesity associated with a balanced translocation that disrupts the SIM1 gene. Human molecular genetics, 9(1), 101-8. [PubMed:10587584] [WorldCat] [DOI] - ↑
Michaud, J.L., Boucher, F., Melnyk, A., Gauthier, F., Goshu, E., Lévy, E., ..., & Fan, C.M. (2001).
Sim1 haploinsufficiency causes hyperphagia, obesity and reduction of the paraventricular nucleus of the hypothalamus. Human molecular genetics, 10(14), 1465-73. [PubMed:11448938] [WorldCat] [DOI] - ↑
Goshu, E., Jin, H., Fasnacht, R., Sepenski, M., Michaud, J.L., & Fan, C.M. (2002).
Sim2 mutants have developmental defects not overlapping with those of Sim1 mutants. Molecular and cellular biology, 22(12), 4147-57. [PubMed:12024028] [PMC] [WorldCat] [DOI] - ↑
Dahmane, N., Charron, G., Lopes, C., Yaspo, M.L., Maunoury, C., Decorte, L., ..., & Delabar, J.M. (1995).
Down syndrome-critical region contains a gene homologous to Drosophila sim expressed during rat and human central nervous system development. Proceedings of the National Academy of Sciences of the United States of America, 92(20), 9191-5. [PubMed:7568099] [PMC] [WorldCat] [DOI] - ↑
Goshu, E., Jin, H., Lovejoy, J., Marion, J.F., Michaud, J.L., & Fan, C.M. (2004).
Sim2 contributes to neuroendocrine hormone gene expression in the anterior hypothalamus. Molecular endocrinology (Baltimore, Md.), 18(5), 1251-62. [PubMed:14988428] [WorldCat] [DOI] - ↑
Wallis, D.E., Roessler, E., Hehr, U., Nanni, L., Wiltshire, T., Richieri-Costa, A., ..., & Muenke, M. (1999).
Mutations in the homeodomain of the human SIX3 gene cause holoprosencephaly. Nature genetics, 22(2), 196-8. [PubMed:10369266] [WorldCat] [DOI] - ↑
Diacou, R., Zhao, Y., Zheng, D., Cvekl, A., & Liu, W. (2018).
Six3 and Six6 Are Jointly Required for the Maintenance of Multipotent Retinal Progenitors through Both Positive and Negative Regulation. Cell reports, 25(9), 2510-2523.e4. [PubMed:30485816] [PMC] [WorldCat] [DOI] - ↑
Lagutin, O.V., Zhu, C.C., Kobayashi, D., Topczewski, J., Shimamura, K., Puelles, L., ..., & Oliver, G. (2003).
Six3 repression of Wnt signaling in the anterior neuroectoderm is essential for vertebrate forebrain development. Genes & development, 17(3), 368-79. [PubMed:12569128] [PMC] [WorldCat] [DOI] - ↑
Liu, W., Lagutin, O., Swindell, E., Jamrich, M., & Oliver, G. (2010).
Neuroretina specification in mouse embryos requires Six3-mediated suppression of Wnt8b in the anterior neural plate. The Journal of clinical investigation, 120(10), 3568-77. [PubMed:20890044] [PMC] [WorldCat] [DOI]