Myocyte enhancer factor-2
| myocyte enhancer factor-2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
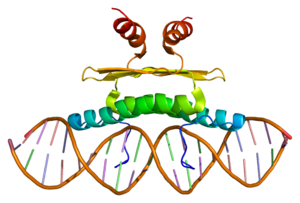 Structure of the MEF2A protein. Based on PyMOL rendering of PDB 1c7u. | |||||||||
| Identifiers | |||||||||
| Symbol | MEF2 | ||||||||
| Pfam | PF09047 | ||||||||
| InterPro | IPR015134 | ||||||||
| |||||||||
英語略:MEF2
MEF2は転写制御因子ファミリーの一つであり、筋細胞および神経細胞で特に高い発現を示す。近年、神経科学の分野ではMEF2は神経細胞の発達・分化や成熟神経細胞におけるシナプス機能の調節に関与していることが明らかになってきた。個体レベルにおいても記憶や学習への関与が示唆されている。
Myocyte enhancer factor-2とは
もともと筋細胞分化に関わる因子として同定された転写因子であり、脊椎動物ではMEF2A, MEF2B, MEF2C, MEF2Dの4つの異なる遺伝子によってコードされるサブタイプが存在する。酵母、線虫、ショウジョウバエなどでは1種のMEF遺伝子が存在し、進化的に広く保存されている。発生期において、骨格筋や心筋の分化、神経堤形成、骨形成や血管形成など多様なイベントに重要な役割を果たしている。また、成体においては免疫系ではT細胞の分化・活性化や神経系ではシナプス機能の維持や調節に関与していることが明らかになってきた[1]。
MEF2はゲノム上の特定のDNA結合配列(MEF2 reguratory element、MRE)に結合して下流の遺伝子の転写活性化を促進する。さらにMEF2は他の転写因子や補因子と多種多様な複合体を形成することにより標的遺伝子の巧妙な発現調節をおこなう。
構造

アミノ酸番号ならびに相同性ははヒトMEF2Aを基準とする。MADSボックス(MADS:オレンジ)、MEF2相同領域(MEF2:緑、転写活性化ドメイン(TAD:水色)を示す。[1]による。Wikipediaより。
約500アミノ酸からなるタンパク質で、N末にはファミリー内で相同性の高い領域(約90アミノ酸)が存在し、二量体形成およびDNA結合活性を担う。このN末部はさらにMCM1-Agamous-Deficiens-Serum response factor(MADS)ボックスと呼ばれる他の転写因子と相同性のある領域とMEF2ファミリー間で保存されているMEF2相同領域に区分できる。一方、C末部分は転写活性化ドメインでありMEFファミリー内および他の遺伝子とは相同性が低い領域である。また核移行シグナル(Nuclear localization signal)もC末に存在する。
MEF2タンパク質はホモ2量体およびヘテロ2量体を形成し、DNA認識配列MRE(コンセンサス配列=[(C/T)TA(A/T)4TA(G/A)])に結合する。またMADS-MEF2ドメインを介して様々な他の転写因子等と活性化シグナル依存的に相互作用する。また、定常状態においてクラスIIaに属するヒストン脱アセチル化酵素(HDACs)と結合することにより、標的遺伝子の転写抑制に関与していることが示されている。
発現
MEF2の発現は発生から成体においてさまざまな器官・細胞に広く認められるが、その発現量は時期や細胞種によってサブタイプ毎に異なる。神経系においてはMEF2Cの発現がもっとも発生初期よりみられ、E11.5において終脳(telencephalon)の腹側部での発現がみとめられる。E13.5になると様々な脳領域において他のサブタイプも発現する[2]。また、成熟脳においてはMEF2A, MEF2CおよびMEF2Dが高い発現を示し、いずれも新皮質、海馬や小脳の神経細胞において発現しているが、各脳部位での発現量はサブタイプ毎に異なる。
機能調節
MEF2はMREに結合して標的遺伝子の転写活性化を引き起こすが、その転写活性はリン酸化・脱リン酸化によって巧妙に制御されている。神経細胞においてはシナプス活動によって活性化されるカルシウム/カルモジュリン依存的キナーゼ(CaMK)やMAPキナーゼ(MAPK)によって活性化されることが示されている。その分子メカニズムとしては、これらのリン酸化酵素によってリン酸化されたMEF2タンパク質が転写活性を増強させるという機構や、また、基底状態においてMEF2と結合して転写抑制をおこなっているHDACのリン酸化による脱離によって転写活性化が引き起こされるという機構等が提唱されている。
さらに、カルシウム依存的な脱リン酸化酵素であるカルシニューリン(PP2B)による制御も報告されている。カルシニューリンは神経活動依存的にMEF2の特定残基のリン酸化修飾(例えばMEF2AのSer408残基)の脱リン酸化することにより転写活性を上昇させる[3]。また、また、MEF2はSUMO化などの翻訳後修飾も受けており、これらの修飾がMEF2の転写活性を調節している可能性が示唆されている[4]。
生物学的および生理的機能
MEF2は筋細胞においては、MyoDなどのbHLH型転写因子と協働して筋分化・維持に関わる多くの遺伝子を調節していることが知られていたが、神経細胞における標的遺伝子は不明であった。Flavellらは神経細胞を用いて活動依存的なMEF2の標的遺伝子をマイクロアレイ法やChIP-chip法などによりゲノムワイドで解析し、数百種類のMEF2標的遺伝子を同定した[5]。これらの中には神経活動によって発現が誘導される前初期遺伝子が多く含まれており、例えば転写因子をコードするc-fos, fosB, egr1等が含まれていた。また、シナプス機能を制御するArcやhomer1a, synGAP、BDNFなどもMEF2の標的遺伝子であった。
神経細胞においてMEF2AおよびMEF2Dを減少させると興奮性シナプスの数が増加し、逆に活性化型MEF2を発現させると興奮性シナプスの数および機能が低下する[6]。同様に、MEF2Cのノックアウトマウスではシナプス数およびシナプス伝達効率は上昇していた[7]。これらの結果より、成熟神経細胞においてMEF2は興奮性のシナプスの数および機能を負に制御する因子としてはたらいていると考えられる。
さらに、活性化型MEF2をマウス海馬や扁桃体に一過性に発現させた場合、記憶や学習に障害がみられることが報告されている[8]。また、MEF2の標的遺伝子の一部は脆弱性X症候群の原因遺伝子産物FMRPによって局所タンパク質翻訳制御を受けることによりシナプス機能調節に関与している可能性が示唆されている[9]。
関連項目
(他ございましたらご指摘下さい)
参考文献
- ↑ 1.0 1.1
Potthoff, M.J., & Olson, E.N. (2007).
MEF2: a central regulator of diverse developmental programs. Development (Cambridge, England), 134(23), 4131-40. [PubMed:17959722] [WorldCat] [DOI] - ↑
Lyons, G.E., Micales, B.K., Schwarz, J., Martin, J.F., & Olson, E.N. (1995).
Expression of mef2 genes in the mouse central nervous system suggests a role in neuronal maturation. The Journal of neuroscience : the official journal of the Society for Neuroscience, 15(8), 5727-38. [PubMed:7643214] [WorldCat] - ↑
McKinsey, T.A., Zhang, C.L., & Olson, E.N. (2002).
MEF2: a calcium-dependent regulator of cell division, differentiation and death. Trends in biochemical sciences, 27(1), 40-7. [PubMed:11796223] [WorldCat] [DOI] - ↑
Shalizi, A., Gaudillière, B., Yuan, Z., Stegmüller, J., Shirogane, T., Ge, Q., ..., & Bonni, A. (2006).
A calcium-regulated MEF2 sumoylation switch controls postsynaptic differentiation. Science (New York, N.Y.), 311(5763), 1012-7. [PubMed:16484498] [WorldCat] [DOI] - ↑
Flavell, S.W., Kim, T.K., Gray, J.M., Harmin, D.A., Hemberg, M., Hong, E.J., ..., & Greenberg, M.E. (2008).
Genome-wide analysis of MEF2 transcriptional program reveals synaptic target genes and neuronal activity-dependent polyadenylation site selection. Neuron, 60(6), 1022-38. [PubMed:19109909] [PMC] [WorldCat] [DOI] - ↑
Flavell, S.W., Cowan, C.W., Kim, T.K., Greer, P.L., Lin, Y., Paradis, S., ..., & Greenberg, M.E. (2006).
Activity-dependent regulation of MEF2 transcription factors suppresses excitatory synapse number. Science (New York, N.Y.), 311(5763), 1008-12. [PubMed:16484497] [WorldCat] [DOI] - ↑
Barbosa, A.C., Kim, M.S., Ertunc, M., Adachi, M., Nelson, E.D., McAnally, J., ..., & Olson, E.N. (2008).
MEF2C, a transcription factor that facilitates learning and memory by negative regulation of synapse numbers and function. Proceedings of the National Academy of Sciences of the United States of America, 105(27), 9391-6. [PubMed:18599438] [PMC] [WorldCat] [DOI] - ↑
Cole, C.J., Mercaldo, V., Restivo, L., Yiu, A.P., Sekeres, M.J., Han, J.H., ..., & Josselyn, S.A. (2012).
MEF2 negatively regulates learning-induced structural plasticity and memory formation. Nature neuroscience, 15(9), 1255-64. [PubMed:22885849] [WorldCat] [DOI] - ↑
Pfeiffer, B.E., Zang, T., Wilkerson, J.R., Taniguchi, M., Maksimova, M.A., Smith, L.N., ..., & Huber, K.M. (2010).
Fragile X mental retardation protein is required for synapse elimination by the activity-dependent transcription factor MEF2. Neuron, 66(2), 191-7. [PubMed:20434996] [PMC] [WorldCat] [DOI]
(執筆者:奥野浩行 担当編集委員:柚崎通介)