イノシトール1,4,5-三リン酸
英:inositol 1,4,5-trisphosphate
略称:Ins(1,4,5)P3、1,4,5-IP3、InsP3、IP3
同義語:イノシトール3リン酸
| 1D-myo-inositol 1,4,5-trisphosphate | |
|---|---|
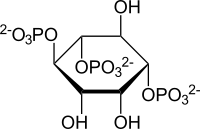 The inositol trisphosphate trianion
| |
[(1R,2S,3R,4R,5S,6R)-2,3,5-trihydroxy-4,6-diphosphonooxycyclohexyl] dihydrogen phosphate | |
別称 IP3; Triphosphoinositol; Inositol 1,4,5-trisphosphate | |
| Identifiers | |
| 85166-31-0 | |
| ChemSpider | 388562 |
| |
| 4222 | |
| Jmol-3D images | Image |
| PubChem | 439456 |
| |
| Properties | |
| Molar mass | 420.096 g/mol |
| 特記なき場合、データは常温(25 °C)・常圧(100 kPa)におけるものである。 | |
古市 貞一
東京理科大学 理工学部 応用生物科学科
DOI:10.14931/bsd.9981 原稿受付日:2022年3月9日 原稿完成日:2022年3月17日
担当編集委員:柚崎 通介(慶應義塾大学 医学部生理学)
イノシトール1,4,5-三リン酸(IP3)は、細胞内二次メッセンジャーとしてはたらく代謝化合物である。IP3は、細胞外からの一次メッセンジャーなどの刺激によってイノシトールリン脂質代謝酵素のホスホリパーゼCが活性化されることで産生される。活性化したPLCは、細胞膜の微量成分であるイノシトールリン脂質の一種のホスファチジルイノシトール4,5-二リン酸の加水分解によってIP3を脂質成分から切り離して細胞質へ遊離する。シグナルとしてのIP3の標的は、IP3受容体である。IP3受容体は、IP3リガンドによって開口する細胞内Ca2+放出チャネルで、細胞内Ca2+貯蔵部位(細胞内カルシウムストア、あるいはカルシウムプール)から細胞質へCa2+放出する。IP3受容体の役割は、シグナルとしては単一の標的しかもたないIP3を受容し、次いで、多くの標的をもつ二次メッセンジャーのCa2+へとシグナルを変換することにある。このようにIP3とCa2+の2種類の二次メッセンジャーが、IP3受容体を介してシグナルを受け継ぐIP3誘導Ca2+放出は、細胞内で複雑なCa2+動態を生み出すことで下流の多種多様なCa2+標的分子の活性を正や負に調節し、発生・代謝・分泌・筋収縮・免疫・神経などの多彩な生命現象に関わる。
イノシトール1,4,5-三リン酸とは
イノシトール1,4,5-三リン酸(Ins(1,4,5)P3、InsP3/IP3の中でイノシトール環1,4,5位にリン酸基が結合した種類を定義した名称。化学構造を参照)がCa2+動員に関わる二次メッセンジャーとして機能することは、1980年代に明らかになった。
まず、細胞刺激によって、
- ホスファチジルイノシトール4,5-二リン酸(phosphatidylinositol 4,5-bisphosphate, PI(4,5)P2あるいはPIP2)の加水分解によるIns(1,4,5)P3産生
- 細胞内ストアからのCa2+動員
が起きることがそれぞれ明らかになった。
この2つの事象1.と2.がリンクしたのは、膜透過処理をした膵腺房細胞において、µM濃度のIns(1,4,5)P3で処理するとミトコンドリアではないATP依存的な細胞内ストアからCa2+放出が特異的に誘導され(Ins(1,2)P2、Ins(1)P、myo-inositolでは誘導されない)、そのCa2+ストアがカルバコールでアセチルコリン受容体刺激をした際に起きるCa2+放出と同じものであることが示されたことによる[1][2] 。
次に、膜透過処理した肝細胞を用いた研究において、αアドレナリン受容体刺激でPIP2の加水分解が起きること、その結果遊離したIns(1,4,5)P3がATP依存的Ca2+ストアからCa2+放出を誘導すること、そして小胞体がそのCa2+ストアとしてはたらくことが示された[3] 。あわせて、多くの細胞や組織が、様々な細胞外刺激によってPIP2を加水分解しイノシトール1,4,5-三リン酸(Ins(1,4,5)P3)を産生するはたらきをもつことが明らかにされていった[1] 。
さらに、Ins(1,4,5)P3に特異的に結合する膜タンパク質が小脳から精製され[4][5][6] 、そのタンパク質をコードする遺伝子がクローニングされた[7][8] 。発現させた組換えタンパク質が、確かにIns(1,4,5)P3に特異的な結合活性(Ins(1,4,5)P3 > Ins(2,4,5)P3 ≥ Ins(1,3,4,5)P4 > Ins(1,2)P2, InsP)[7][9] と、IP3誘導Ca2+放出(IP3-induced Ca2+ release, IICR)活性(Ins(1,4,5)P3 > Ins(2,4,5)P3 > Ins(1,3,4,5)P4)を有したことから[10] 、このタンパク質がIns(1,4,5)P3の受容体としてはたらくのと同時にIICRチャネルの活性をもつという分子実体(Ins(1,4,5)P3受容体/Ca2+放出チャネル)が明らかになった。
これにより、細胞刺激で産生される二次メッセンジャーIns(1,4,5)P3/IP3が細胞内ストアからCa2+放出を誘導する分子機構の理解が進展していった[11][12]。哺乳類のIns(1,4,5)P3/IP3受容体には、Ins(1,4,5)P3結合親和性や発現組織分布に違いのあるIP3R1/IP3R2/IP3R3の3種類が存在することも明らかになった(遺伝子名はそれぞれITPR1/ITPR2/ITPR3)[13] 。
化学構造
(a)はハース投影式(Haworth projection)による環状構造、(b)はin vivoで熱力学的に安定と考えられるイス型の構造で示している[14] 。(c)はIUBNCの提案で、Agranoffの亀の頭・手・足・尾の配置を例えとして、6個の炭素の位置を、2位が亀の頭で、1位が右手となるように、反時計回りに1~6位の順で番号を付ける[15] 。
Ins(1,4,5)P3では、イノシトール環の1,4,5位の炭素にリン酸基(図では○Pで示す位置に-OPO32-)が結合し、2,3,6位の炭素にヒドロキシ基(-OH)が結合している。PIP2では白抜き矢印(⇒)で示すイノシトール環1位のリン酸基とジアシルグリセロールのsn-3位のヒドロキシ基がエステル結合しており、この結合をPLCが加水分解することよってIP3が細胞膜から細胞質へと遊離する。
イノシトール1,4,5-三リン酸(以下IP3あるいはInsP3)はイノシトール環(inositol ring)に3個のリン酸基が結合した代謝化合物である。イノシトール環がもつ6個の炭素(1~6位)のうち、特別に指定されなければ1、4、5位の3個の炭素にリン酸基が結合したイノシトール1,4,5-三リン酸を指す。InsP3/IP3間で他の炭素の位置にリン酸基が結合するものと区別する場合には、1,4,5-IP3(あるいはIns(1,4,5)P3)や、1,3,4-IP3(あるいはIns(1,3,4)P3)などとリン酸基が付く炭素の位置を明記する必要がある。
産生
ホスホリパーゼC(phospholipase C、略称:PLC)によるPIP2の加水分解は、ホスファチジルイノシトール(phosphatidylinositol、PtdInsあるいはPI)/ホスホイノシタイド(phosphoinositide)の代謝回転(turnover)の一種である。これによって、細胞質性(可溶性)のIP3と膜結合性のジアシルグリセロール(sn-1,2-diacylglycerol、DAGあるいはDG)の2種類の二次メッセンジャーが産生される。膜から遊離するIP3は細胞内Ca2+シグナル伝達カスケード[11][16] の、膜成分のDAGはプロテインキナーゼC(protein kinase C、略称:PKC)リン酸化シグナル伝達カスケード[17] の、それぞれ引き金となる。
IP3シグナル産生に関わるPIP2の加水分解は、細胞外からの一次メッセンジャーによる刺激によって、異なるPLCタイプが活性化される経路がある[18] (図2)。
PLC-βタイプによるIP3産生経路
PLC-βタイプの活性化経路[19] (図2➊~➍):古典的神経伝達物質や神経ペプチドなどの一次メッセンジャーが、ヘテロ三量体型Gタンパク質(heterotrimeric G protein; α/β/γサブユニットの複合体)のGαq/11タイプに共役したGタンパク質共役型受容体(G protein-coupled receptor、略称:GPCR;あるいは代謝型受容体〔metabotropic receptor〕とも呼ぶ)(➊)に作用することで、GTP結合型Gαサブユニット(➋)がβγサブユニットと解離し、次いでエフェクター酵素であるPLC-βタイプ(➌)が解離したGTP結合型Gαサブユニット(GTP-Gα)と結合することで活性化され、PIP2の加水分解が起きる(➍)。
PLC-γタイプによるIP3産生経路
PLC-γタイプの活性化経路[20][21] (図2①~④):神経栄養因子、成長因子、サイトカインなどの一次メッセンジャーが、受容体型チロシンキナーゼ(receptor tyrosine kinase、RTK)(①)に作用することで、細胞内ドメインのチロシンキナーゼが活性化されて自己チロシンリン酸化が起き(②)、次いでエフェクター酵素であるPLC-γタイプがRTKのリン酸化チロシン(Y-P)に結合することで(PLC-γはY-Pと特異的に結合するSH2ドメインをもつ)、PLC-γもチロシンリン酸化を受けて活性化され(③)、PIP2の加水分解が起きる(④)。
PIP2の加水分解から先の経路はPLC-βとPLC-γで共通しており(図2の⓹~⓽)、2つの二次メッセンジャーIP3(⓹)とDAG(⓺)が産生される。遊離するIP3はCa2+ストア膜上のIP3R(⓻)を活性化してストア内腔のCa2+を細胞質へ放出させて細胞内Ca2+濃度([Ca2+]i)(⓼)を上昇させる。一方、細胞膜のDAGはPKC(⓽)を活性化する。
その他のPLCタイプによるIP3産生経路
この他に、PLC-β2/3はGタンパク質のβγサブユニットとの結合によって(PLC-β1も弱く結合)[18] 、PLC-δタイプは細胞内Ca2+濃度([Ca2+]i)の増加によって[22] 、PLC-εタイプは低分子量GTPaseのGTP結合型Ras/Rap[23][24] やGTP結合型Rho[25] によって、それぞれ活性化される。PLC-ηの活性化機構は未定であるが、Ca2+感受性が高く、Gβγサブユニットとの結合によって活性化すると推測されている[26] 。PLC-ζは精子に含まれ、Ca2+感受性が高く、受精卵内でのCa2+振動に関与する[27] 。
IP3とイノシトールリン酸の代謝
IP3シグナルの細胞内における時空間的特性には、一次メッセンジャーが作用する細胞膜近傍におけるPI代謝と、その後のイノシトールポリリン酸(inositol polyphosphate)代謝活性が主に寄与する(図3)。産生後のIP3は、主にイノシトールポリリン酸5-ホスファターゼ(inositol polyphosphate 5-phosphatase、INPP5)によるイノシトール環5位の脱リン酸化によってIP2(イノシトール1,4-二リン酸:Ins(1,4)P2)か、IP3 3-キナーゼ(inositol 1,4,5-trisphospate 3-kinase、IP3K)やイノシトールポリリン酸マルチキナーゼ(inositol polyphosphate multikinase、IPMK)による3位のリン酸化によってIP4(イノシトール1,3,4,5-四リン酸, Ins(1,3,4,5)P4)に代謝される。
IP2は、イノシトールモノホスファターゼ(inositol monophosphatase、IMPA)やイノシトールポリリン酸1-ホスファターゼ(inositol polyphosphate 1-phosphatase、INNP1)によってさらに脱リン酸化を受けて、myo-イノシトールまで代謝される。myo-イノシトールは、ホスファチジルイノシトール合成酵素(phosphatidylinositol synthetase、PIS)によって、小胞体膜で合成される中間体リン脂質のCDP-ジアシルグリセロール(CDP-DAG)と結合することで、再びPI合成のサイクルへ組み込まれる。気分安定薬としての薬理作用をもつリチウム(lithium、Li)[28] は、IMPA1やINNP1を阻害し脱リン酸化を抑制するため[29] 、myo-イノシトールの供給が抑制される。結果としてPI合成が低下し、IP3の産生とその下流のIICRへも影響が及ぶと考えられる。
IP4は、INPP5への親和性が高く競合阻害によってIP3の脱リン化を抑制する効果や、IP3受容体へのアゴニスト効果などが知られている。また、IP4は、IMPAによるイノシトール環6位のリン酸化でIP5(イノシトール1,3,4,5,6-五リン酸inositol pentakisphosphate、Ins(1,3,4,5,6)P5)へ、次いでIP5がイノシトール五リン酸2-キナーゼ(inositol 1,3,4,5,6-pentakisphosphate 2-kinase、IP5K)による2位のリン酸化でIP6(イノシトール六リン酸inositol hexakisphosphate、InsP6)へと代謝が進む。IP5とIP6は、さらに高エネルギーリン酸結合をもつイノシトールピロリン酸(inositol pyrophosphate、PP-InsP)を合成する基質となる(5-PP-IP4、5-PP-IP5や1-PP-IP5など)[30][31][32][33][34]。PP-InsPは、クロマチンリモデリングや遺伝子発現、膜輸送、インスリン分泌、成長因子・サイトカイン経路、アポトーシス、ドーパミン放出などに関連する事例が報告されている[30][35][36] 。
IP3/Ca2+シグナル伝達
IP3のシグナル特性
IP3のシグナルとしての直接的な作用点は(基質となる代謝酵素などを除けば)IP3受容体(以下IP3Rと略す)である(図2)[37][4][38] 。すなわち、IP3の第一のシグナル特性は、下流の標的分子がただ一つしかない点である。通常、複数の標的分子をもつ他の二次メッセンジャー(cAMP、cGMP、DAG、Ca2+、NOなど)とは際立ったシグナル特性である。
IICRによって、IP3が媒介する情報がCa2+へと受け継がれる(図2)。すなわち、IP3の第二のシグナル特性は、唯一の標的分子(IP3R)しかないIP3が、二次メッセンジャーのCa2+へ情報を橋渡しすることによって、多種多様な標的分子の活性を正や負に調節する多機能性と、カルモジュリン(calmodulin, CaM)と結合(1つのCaMに4個のCa2+が結合)することでCa2+/CaM依存性の新たな標的分子に作用することが可能となる融通性を有する細胞内Ca2+シグナル伝達の引き金となることである[39] 。IP3Rは、一つの標的しか持たないIP3から、最もユニバーサルなシグナル(universal signal)と称されるCa2+へのシグナル変換装置としてはたらく[40] 。
IP3感受性細胞内Ca2+ストア
IP3感受性の細胞内Ca2+ストアとしてはたらくのは、主に滑面小胞体(smooth endoplasmic reticulum、sER)である[41][38] 。sER膜上にある筋小胞体Ca2+ポンプ(sarcoplasmic reticulum Ca2+ ATPase、SERCA)によって、細胞質内Ca2+が能動輸送によってsER内腔へ取り込まれる(図2)(内腔Ca2+濃度は数100 -µM~数mM)。
IP3RはsER膜に局在するIP3リガンド開口性の細胞内Ca2+放出チャネル(IP3-gated intracellular Ca2+ release channel)としてはたらく[40][7][42] 。4量体の巨大な膜タンパク質複合体を形成し、細胞質側に伸びるN末端側に4つのIP3リガンド結合ドメインをもち[43][9][44] 、IP3結合による構造変化によってC末端側の膜貫通ドメインにあるチャネルポアが開口し[45] 、sER内腔のCa2+を細胞質へと放出する。リガンド結合ドメインにIP3と競合的に結合するIRBITタンパク質が知られており(リン酸化アミノ酸がIP3結合配列と相互作用する)、IP3Rチャネル活性を阻害する[46] 。
IICRによってストア内のCa2+(約400 µM [47] )が枯渇すると、容量依存的Ca2+流入(capacitive Ca2+ entry, CCE)が誘導され、この際Ca2+放出活性化Ca2+電流 (Ca2+ release activated Ca2+ current; ICRAC) が発生する[48] 。CCEは、IICR後のCa2+シグナルの持続性には必須であり、特に電位依存性Ca2+チャネルなどをもたない非興奮性細胞においては、ストアのCa2+容量の減少分を補充する重要な現象である。CCEにはたらくチャネルはストア作動性チャネル(store-operated channel, SOC)やICRACチャネルと呼ばれた[49] 。
その後、ストア内Ca2+レベルをCa2+センサータンパク質のSTIM(STIM1/STIM2の2種類)が検知し、その情報をタンパク質間相互作用によって受容する細胞膜チャネルORAI(ORAI1/ORAI2/ORAI3の3種類)がCa2+流入を引き起こすCCEの分子機構が明らかになった[50][47][51][52][53] 。
IP3誘導Ca2+放出(IICR)の特徴と細胞内シグナル伝達
IICRとCICR
IP3Rを介するIICRは、興奮性と非興奮性を問わず、広範な細胞タイプにおける多彩な生命現象や神経疾患などではたらく細胞内Ca2+シグナル伝達に関与している[54][16][55][56][12] 。
もう一つの細胞内Ca2+放出現象には、リアノジン受容体(ryanodine receptor、略語:RyR;RyR1/RyR2/RyR3の3種類)によるCa2+誘導Ca2+放出(Ca2+-induced Ca2+ release、略語:CICR)がある [13][57][42] 。RyRによるCICRは、Ca2+シグナルの増幅にはたらき、IICRと共同して細胞内Ca2+動態に重要な役割をもつ[11] 。IP3の他に細胞内ストアからのCa2+動員のメッセンジャーとしてはたらく代謝化合物には、cADPリボース(cyclic adenosine diphosphate ribose, cADPR)とニコチン酸アデニンジヌクレオチドリン酸(nicotinic acid adenine dinucleotide phosphate, NAADP)がある。いずれも補助分子を介してCa2+動員を媒介すると考えられている[58][59] 。cADPRはRyRによるCICRを媒介するが、NAADPは2孔型チャネル(two-pore channel, TPC)による酸性オルガネラ(エンドソームやリソソーム)(IICR/CICRとは異なるCa2+ストア)からのCa2+放出を媒介する[60][59][61] 。
シグナルとしての細胞内濃度
IP3シグナルが標的のIP3Rに作用する有効濃度は、細胞・組織やIP3Rのタイプによるが、例えば発現させたIP3結合ドメインのIP3結合親和性(Kd)が10~100 nMオーダー[62][63] であることや、精製したIP3R1タンパク質や発現させたIP3R1タンパク質の単一チャネル記録での開口確率(open probability)から推定されるIP3感受性(kInsP3)が、それぞれ220 nM [64] と100~400 nM [65] との報告から、おおよそsub-micromolarのIP3濃度が十分にIICRを引き起こすシグナル濃度に相当すると考えられる。但し、アフリカツメガエル卵母細胞では、数pMのIP3注入で要素的なIICRが起きるとの報告もあり[66] 、in vitroとin vivoのアッセイ方法、あるいは細胞によって違いがある可能性はある。
細胞内におけるシグナルとしての寿命と局所性
IP3を引き継ぐCa2+は、短寿命で、細胞局所的な(ローカルな)メッセンジャー(short-lived local messenger)である。2族元素でアルカリ土類金属のカルシウムは自然界では豊富に化合物として存在し(地殻中で5番目に多い)、ヒトの体内でも最も多いミネラルである(約99%が骨や歯に存在)。しかし、遊離イオン状態で高濃度のCa2+は細胞毒性が強いため、通常、細胞では厳密なCa2+ホメオスタシス機構によって、細胞内Ca2+濃度([Ca2+]i)は極めて低い(能動的な細胞外へのCa2+排出や細胞内ストアへのCa2+封じ込め、ミトコンドリアへのCa2+取り込み、結合タンパク質による緩衝作用[結合Ca2+(bound Ca2+)の状態]などが[Ca2+]iを低く抑えている)。この機構によって、体液中などの細胞外Ca2+濃度([Ca2+]o)が1~数mMに対して、細胞内の遊離Ca2+(free Ca2+)濃度[Ca2+]iは50~100 nM [47][67] と、約1万倍までに低減される。この堅牢な機構下で、Ca2+が定常レベルを超えて上昇した濃度でシグナルとしてはたらき、[Ca2+]iは発生部位をピークとして、周辺部へ段階的な濃度勾配を示すCa2+微小領域/マイクロドメイン(Ca2+ microdomain)を形成しやすい[68] 。
一方、IP3については、産生されて代謝によって低減するまでの間、シグナルとして機能する。アフリカツメガエル卵母細胞を用いた先駆的な研究によって、IP3は通常サイズの細胞では産生される細胞膜付近から細胞内のほぼ全域まで、シグナルとしての濃度レベルを保って拡散することができる長寿命で広域的な(グルーバルな)メッセンジャー(long-lived global messenger)と提案された。脂質メディエーターであるリゾホスファチジン酸(lysophosphatidic acid, LPA)がGPCRを刺激して数分以内に、卵母細胞内のIP3濃度が10 nMオーダーから数µMオーダーへ増加することが示された[69] 。卵母細胞の抽出液中で測定されたIP3の拡散定数(diffusion coefficient [D])が280 µm2/sに対して遊離Ca2+が13~65 µm2/s(Ca2+を90 nMから1 µMに増加した時のD値)(IP3が4~20倍以上の拡散定数をもつ)、IP3の有効時間が1 sに対して遊離Ca2+は30 µs(IP3が5桁長い有効時間をもつ)(結合Ca2+は1 sとIP3と同等)、また拡散範囲はIP3が24 µmに対して遊離Ca2+は0.1 µm(IP3が3桁広い拡散範囲をもつ)(結合Ca2+は5 µmとIP3の約1/5)であることも示された[70](表1)。
こうした研究報告から、Ca2+と比較して、IP3はグローバルメッセンジャーと考えられてきた。また、マウス神経芽細胞腫株N1E-115では、カルバコールでアセチルコリン受容体を刺激して産生されるIP3の半減期が約9 sとの報告もある[71] 。その後、ヒト神経芽細胞腫株SH-SY5Yを用いたケージドIP3の光解離で誘導されるCa2+パフ(puff)(ストア上に散在するIP3Rチャネルクラスター単位で起きる要素的なCa2+放出[elementary Ca2+ release])では、IP3の拡散定数は≤10 6micro;m2/sec(アフリカツメガエル卵母細胞での遊離Ca2+のDに匹敵)で推定される作用範囲も< 5 µmと、典型的な哺乳類細胞のサイズよりもやや小さいことから、IP3もローカルメッセンジャーとしてはたらくと報告された[72](表1)。
| 拡散定数 | 有効時間 | 拡散範囲 | 文献 | |
|---|---|---|---|---|
| Oocyte Ca2+ | 13-65 mm2/s | 30 ms | 0.1 mm | [70] |
| Oocyte IP3 | 280 mm2/s | 1 s | 24 mm | [70] |
| SH-SY5Y IP3 | ≤10 mm2/s | < 5 mm | [72] |
代謝化合物であるIP3シグナルと、陽イオンであるCa2+シグナルとでは、刺激後に細胞内で発生して、その後低減されるまでのメカニズムが全く異なる。このため、2つの二次メッセンジャーが変換されるIICRにおいて、IP3の代謝活性やCa2+のホメオスタシス制御が細胞によって異なるため、両者のシグナル寿命は細胞によっても異なることになる。加えて、細胞タイプによって活性化状態のIP3Rの局所的な密度やCa2+ストアの細胞内分布パターンに多様性があることも(例えば、アフリカツメガエル卵母細胞はIP3Rが細胞膜直下の小胞体に分布するが、通常の動物細胞では細胞質内のsERネットワークに比較的広く分布する)、時空間的なCa2+動態へ影響する[58][73] 。
ニューロンは神経伝達物質や神経栄養因子などをシナプスなどの特定の細胞部位で受容してPIP2加水分解が起きるため、この場合のIP3シグナルは局所的である。また、シナプス後部‐樹状突起-細胞体、そして核膜近傍に至るまで、IP3Rが局在できるsERネットワークは分布しており、IP3シグナルの持続性に応じた(また、次項で述べるCa2+によるIP3Rの二相性の調節も関係した)時空間的なIICRによるCa2+伝播が、細胞応答や遺伝子発現の制御に関係する知見が得られている[54] 。
IICRの細胞内動態
IICRによる階層的なCa2+動態(Ca2+ blip→Ca2+ puff→Ca2+ wave)を図示している(Parker I et al. [74] と Lock JT et al. [73] を改変)。図中では、放出Ca2+による負の制御で変化する動態は割愛している。(a)は細胞外刺激を受けて細胞膜近傍でPI代謝回転の誘導が開始される段階。(b)は低[IP3]、(c)は中程度[IP3]、(d)は高[IP3]におけるIP3/Ca2+シグナルの動態を図示している。PI代謝回転が起きた細胞膜付近からIP3が細胞内を拡散してできる濃度勾配を青色濃淡で示している。IP3R/Ca2+放出チャネルによってCa2+ストアから放出されるCa2+が細胞内を拡散してできる濃度勾配を赤色濃淡で示している。ギャップ結合(GAP junction, GJ)をもつ細胞間では、IP3は細胞間シグナルとしてもはたらく。図では、Ca2+が細胞内を局所的(local)に、IP3がより細胞内を広域(global)に拡散する様子を示しているが、動態は細胞タイプなどによって多様性があり、IP3がより局所的なメッセンジャーとしてはたらく細胞もある。(b)低[IP3]では、IP3Rチャネルの単独とクラスターを問わず、確率論的にIP3と結合したIP3RチャネルにおいてCa2+ブリップが起きる。(c)中程度[IP3]では、IP3Rチャネルクラスター(アンカーされて不動性)が活性化され、Ca2+パフが起きる。また、IICRによって生じるCa2+は濃度に依存して二相性にIP3Rを制御する:至適[Ca2+]濃度を超えた高[Ca2+]域ではIP3Rを負にフィードバック制御、至適[Ca2+]域であれば(一定レベルのIP3下で)隣接するIP3Rを活性化(正の制御)する。(d)高[IP3]では、正のCa2+制御により(RyRによるCICR様のモードで)、隣接する一連のIP3R集団の連続的な活性化によって細胞内Ca2+波(intracellular Ca2+ wave)が伝播し[75] 、その結果、空間的および速度論的に広域Ca2+シグナルの特性が発揮される[76] 。サイレントIP3Rの活性化も示唆されている。高[IP3]下でのグローバルなCa2+放出には、Ca2+パフの他に、ストアに分散して局在するIP3R(可動性)による時空間的に持続性のあるCa2+上昇が寄与するモデルもある[76] 。
電位依存性Ca2+チャネルや、NMDA型グルタミン酸受容体のようなリガンド開口性Ca2+透過チャネル(ligand-gated Ca2+ permeable channel)などによる細胞外からのCa2+流入(Ca2+ influx)では、細胞膜のチャネルポア付近を起点としてCa2+濃度勾配の局所性が生じ、またCa2+スパイク(Ca2+ spike)などの動態が見られたりする。一方、IP3によって誘導される細胞内からのCa2+放出(Ca2+ release)では、細胞体から神経突起やスパインなどへも連なるCa2+ストア(sER)のネットワーク上にIP3Rが異なった密度で局在するため、局在部を起点としたCa2+濃度の勾配と局所性が生じる。IP3Rのチャネル開口にはIP3と共にCa2+もコアゴニスト(co-agonist)として必要である。
一定のIP3濃度([IP3])下で、IICRにより上昇した[Ca2+]iが至適濃度域(~200 nM)では正に(RyRのようなCICRモードで活性化)、高濃度域(>200 nM)では逆に負にフィードバック調節をする[77][78][79](図4)。この放出Ca2+による二相性の調節も、IICRによる多彩なCa2+動態に関係している(負の調節はCa2+/CaMがIP3Rに結合しチャネル活性を阻害することによる[64] )。ストア上のIP3R/Ca2+放出チャネル(4量体の複合体)は、単独あるいは数個~10数個のクラスターで分布する(クラスターのIP3Rチャネル数は細胞によって異なる)。細胞の種類やニューロンの細胞区画によって多様性はあるであろうが、一般的な動物細胞ではクラスターのIP3Rチャネルは主に細胞膜近傍のストアにアンカーされて動かない定常状態で(核周辺との報告もある)、この他にIP3Rチャネルはクラスター化せずに広く細胞質内のストアに動的な状態で点在しているとの考えがある[76] 。個々のIP3Rチャネルクラスター単位で起きるIICRの要素的な現象をCa2+パフ(Ca2+ puff)と呼ぶ(図4)(RyRによる類似した要素的な現象に心筋細胞で見られるCa2+スパーク[Ca2+ spark]がある)。低[IP3]域では、単独あるいはクラスター中の一部のIP3Rチャネルが確率論的にIICRを起こし、この現象はCa2+ブリップ(Ca2+ blip)と呼ぶ。中程度 [IP3]域では、クラスターを構成するIP3Rチャネルの同調した活性化によって、Ca2+ブリップより大きいCa2+パフが起きる(細胞と刺激の種類によるが、ヒスタミン処理したHeLa細胞では、ブリップのCa2+増幅が~30 nM、寿命が<0.5 s、拡散範囲が<2 µmに対し、パフはそれぞれ~170 nM、~1 s、~4-7 µmと大きい[80] )。上昇した[Ca2+]i域にある近傍IP3Rは、放出Ca2+による正の制御によってCICRモードとなり、さらなる[Ca2+]iの上昇につながる。高[IP3]域では、放出Ca2+による正の制御がさらに近位から遠位へと段階的に伝播し、細胞内に広がるストアネットワーク上のIP3Rチャネルが連続的にCICRモードとなることで(また、低[IP3]では不活性状態(silent)のIP3Rが、高[IP3]で活性化すると示唆されている)、グローバルなCa2+波(Ca2+ wave)などの複雑なCa2+動態が生み出されるモデルが提唱されている[68][76][74] 。
このようにIICRは、要素的なCa2+ブリップそしてCa2+パフから、さらにグローバルなCa2+波までの階層的な事象のシグナル伝達から構成され、細胞によっては、Ca2+振動(Ca2+ oscillation)やCa2+スパイラル(Ca2+ spiral)などの時空間的に多彩な動態が観察される[54][58][68][76][81] 。
細胞内には、nMからmMに至るまで100万倍の範囲で異なったCa2+親和性をもつ多くの標的タンパク質[82] が、局所的に存在している。こうしたCa2+で制御されるタンパク質の活性は、IICRによって生じるCa2+マイクロドメインの時空間的な動態で制御され[82] 、また異なった振幅(AM)や周波数(FM)のパターンをもつCa2+動態[83][84][85][86][87] によっても多様に制御される(例えば、MAPKとCaMKIIを活性化するCa2+振動の周波数域に違いがあり[87]、カルシニューリンとCaMKIIを活性化する周波数域と増加Ca2+総量にも違いがある[85] )。
このように、IICRによる細胞内Ca2+動態の多様性と、標的タンパク質がもつCa2+親和性と細胞内分布の多様性が、多くの細胞機能ではたらく多彩なIP3/Ca2+シグナル伝達に関係している[88][54][82] 。また、CaM結合Ca2+(CaM-bound Ca2+)になることで、遊離Ca2+よりも長寿命シグナルとなり、新たにCa2+/CaM依存性の標的分子へ作用できる適応性や融通性も増すことができる[82] 。
細胞間コミュニケーションシグナル
IP3は、分子量1 kDa以下の電解質イオンや代謝物などを透過するギャップ結合(gap junction)を通過することができ、細胞間を伝播することで細胞間コミュニケーションのシグナルとしてもはたらき、アストロサイトの細胞間Ca2+波の誘導などに関係する[89][75] 。
IP3シグナル関連技術
IP3シグナルの検出
PLC-δのPIP2結合に寄与するPleckstrin homology (PH)ドメインや、IP3受容体のIP3リガンド結合ドメイン[44] を利用して、蛍光タンパク質と融合させた組換えIP3センサーが開発されている(表2)。
| IP3センサー名 | IP3結合領域 | IP3結合の親和性/阻害※1 | 蛍光検出※2 | 文献 |
|---|---|---|---|---|
| GFP-PHD | PLC-δ PH domain | Kd=93 nM | GFP | [90] |
| LIBRA | Rat IP3R1/2/3 IP3BD |
Kd=117.2~491.5 nM | FRET CFP/YFP CFP/Venus |
[91] , [92] |
| Fretino | Human IP3R1 IP3BCD |
Kd=7.6~190 nM | FRET CFP/YFP |
[93] |
| FIRE | Rat IP3R1/2/3 IP3BD |
Kd=31.3~36.4 nM | FRET CFP/YFP |
[94] |
| InsP3 sensor (InsP3R-LBD) | Human IP3R1 IP3BCD |
Kd=3.0~10.1 nM | FRET Cerulean/Venus BRET Sluc/Venus |
[95] |
| IRIS | Mouse IP3R1 IP3BCD |
Kd=47~550 nM | FRET Venus/ECFP HaloTag-TMR/EGFP |
[96] , [97] |
| CFLA-IP3 | Rat IP3R2 IP3BD※2 |
IC50=139.7/352.1 nM for 30/100 nM FLL | FRET Cerulean/FLL | [98] |
※1複数のセンサータイプがもつIP3結合親和性(Kd)/あるいは競合結合阻害濃度(IC50)の範囲
※2 IP3を蛍光検出するための方法、および使用する蛍光タンパク質/蛍光化合物
- PH:Pleckstrin homology (PH)ドメイン、IP3BD:IP3リガンド結合ドメイン(IP3 ligand binding domain)[44] 、IP3BCD:IP3リガンド結合コアドメイン(IP3 ligand binding core domain)[44] 、CFLA:competitive fluorescent ligand assay、FLL:蛍光低親和性リガンド(fluorescent low-affinity ligand)、Sluc:Renilla Super luciferase、FRET:fluorescence resonance energy transfer、BRET:bioluminescence resonance energy transfer
IP3センサーを用いたIP3の検出により、刺激によって増加する細胞内IP3濃度がCa2+振動スパイクが発生する間は持続し、Ca2+の初期放出後にIP3濃度がピークになり、産生と代謝のバランスによりわずかにIP3も振動することなどが示されている[97] 。
IP3シグナルの抑制
マウスIP3R1の高親和性IP3リガンド結合コアドメイン[44][99] を発現させ、細胞質内のIP3を結合で吸収することで、IP3シグナル伝達の抑制を目的とした組換えタンパク質IP3スポンジ(IP3 sponge)[100] と、これを適用したIP3 spongeトランスジェニックマウス[101] が開発されている。
関連項目
参考文献
- ↑ 1.0 1.1
Berridge, M.J., & Irvine, R.F. (1984).
Inositol trisphosphate, a novel second messenger in cellular signal transduction. Nature, 312(5992), 315-21. [PubMed:6095092] [WorldCat] [DOI] - ↑
Streb, H., Irvine, R.F., Berridge, M.J., & Schulz, I. (1983).
Release of Ca2+ from a nonmitochondrial intracellular store in pancreatic acinar cells by inositol-1,4,5-trisphosphate. Nature, 306(5938), 67-9. [PubMed:6605482] [WorldCat] [DOI] - ↑
Burgess, G.M., Godfrey, P.P., McKinney, J.S., Berridge, M.J., Irvine, R.F., & Putney, J.W. (1984).
The second messenger linking receptor activation to internal Ca release in liver. Nature, 309(5963), 63-6. [PubMed:6325926] [WorldCat] [DOI] - ↑ 4.0 4.1
Maeda, N., Niinobe, M., & Mikoshiba, K. (1990).
A cerebellar Purkinje cell marker P400 protein is an inositol 1,4,5-trisphosphate (InsP3) receptor protein. Purification and characterization of InsP3 receptor complex. The EMBO journal, 9(1), 61-7. [PubMed:2153079] [PMC] [WorldCat] - ↑
Supattapone, S., Worley, P.F., Baraban, J.M., & Snyder, S.H. (1988).
Solubilization, purification, and characterization of an inositol trisphosphate receptor. The Journal of biological chemistry, 263(3), 1530-4. [PubMed:2826483] [WorldCat] - ↑
Worley, P.F., Baraban, J.M., Supattapone, S., Wilson, V.S., & Snyder, S.H. (1987).
Characterization of inositol trisphosphate receptor binding in brain. Regulation by pH and calcium. The Journal of biological chemistry, 262(25), 12132-6. [PubMed:3040730] [WorldCat] - ↑ 7.0 7.1 7.2
Furuichi, T., Yoshikawa, S., Miyawaki, A., Wada, K., Maeda, N., & Mikoshiba, K. (1989).
Primary structure and functional expression of the inositol 1,4,5-trisphosphate-binding protein P400. Nature, 342(6245), 32-8. [PubMed:2554142] [WorldCat] [DOI] - ↑
Mignery, G.A., Südhof, T.C., Takei, K., & De Camilli, P. (1989).
Putative receptor for inositol 1,4,5-trisphosphate similar to ryanodine receptor. Nature, 342(6246), 192-5. [PubMed:2554146] [WorldCat] [DOI] - ↑ 9.0 9.1
Miyawaki, A., Furuichi, T., Ryou, Y., Yoshikawa, S., Nakagawa, T., Saitoh, T., & Mikoshiba, K. (1991).
Structure-function relationships of the mouse inositol 1,4,5-trisphosphate receptor. Proceedings of the National Academy of Sciences of the United States of America, 88(11), 4911-5. [PubMed:1647021] [PMC] [WorldCat] [DOI] - ↑
Miyawaki, A., Furuichi, T., Maeda, N., & Mikoshiba, K. (1990).
Expressed cerebellar-type inositol 1,4,5-trisphosphate receptor, P400, has calcium release activity in a fibroblast L cell line. Neuron, 5(1), 11-8. [PubMed:2164403] [WorldCat] [DOI] - ↑ 11.0 11.1 11.2
Berridge, M.J. (1993).
Inositol trisphosphate and calcium signalling. Nature, 361(6410), 315-25. [PubMed:8381210] [WorldCat] [DOI] - ↑ 12.0 12.1
Mikoshiba, K. (2007).
IP3 receptor/Ca2+ channel: from discovery to new signaling concepts. Journal of neurochemistry, 102(5), 1426-1446. [PubMed:17697045] [WorldCat] [DOI] - ↑ 13.0 13.1
Furuichi, T., Kohda, K., Miyawaki, A., & Mikoshiba, K. (1994).
Intracellular channels. Current opinion in neurobiology, 4(3), 294-303. [PubMed:7522674] [WorldCat] [DOI] - ↑
Irvine, R.F. (2016).
A short history of inositol lipids. Journal of lipid research, 57(11), 1987-1994. [PubMed:27623846] [PMC] [WorldCat] [DOI] - ↑
Agranoff, B.W. (2009).
Turtles All the Way: Reflections on myo-Inositol. The Journal of biological chemistry, 284(32), 21121-6. [PubMed:19447884] [PMC] [WorldCat] [DOI] - ↑ 16.0 16.1
Berridge, M.J., & Irvine, R.F. (1989).
Inositol phosphates and cell signalling. Nature, 341(6239), 197-205. [PubMed:2550825] [WorldCat] [DOI] - ↑
Nishizuka, Y. (1988).
The molecular heterogeneity of protein kinase C and its implications for cellular regulation. Nature, 334(6184), 661-5. [PubMed:3045562] [WorldCat] [DOI] - ↑ 18.0 18.1
Rhee, S.G., & Bae, Y.S. (1997).
Regulation of phosphoinositide-specific phospholipase C isozymes. The Journal of biological chemistry, 272(24), 15045-8. [PubMed:9182519] [WorldCat] [DOI] - ↑
Taylor, S.J., Chae, H.Z., Rhee, S.G., & Exton, J.H. (1991).
Activation of the beta 1 isozyme of phospholipase C by alpha subunits of the Gq class of G proteins. Nature, 350(6318), 516-8. [PubMed:1707501] [WorldCat] [DOI] - ↑
Kim, H.K., Kim, J.W., Zilberstein, A., Margolis, B., Kim, J.G., Schlessinger, J., & Rhee, S.G. (1991).
PDGF stimulation of inositol phospholipid hydrolysis requires PLC-gamma 1 phosphorylation on tyrosine residues 783 and 1254. Cell, 65(3), 435-41. [PubMed:1708307] [WorldCat] [DOI] - ↑
Wahl, M.I., Daniel, T.O., & Carpenter, G. (1988).
Antiphosphotyrosine recovery of phospholipase C activity after EGF treatment of A-431 cells. Science (New York, N.Y.), 241(4868), 968-70. [PubMed:2457254] [WorldCat] [DOI] - ↑
Allen, V., Swigart, P., Cheung, R., Cockcroft, S., & Katan, M. (1997).
Regulation of inositol lipid-specific phospholipase cdelta by changes in Ca2+ ion concentrations. The Biochemical journal, 327 ( Pt 2), 545-52. [PubMed:9359428] [PMC] [WorldCat] [DOI] - ↑
Kelley, G.G., Reks, S.E., Ondrako, J.M., & Smrcka, A.V. (2001).
Phospholipase C(epsilon): a novel Ras effector. The EMBO journal, 20(4), 743-54. [PubMed:11179219] [PMC] [WorldCat] [DOI] - ↑
Song, C., Hu, C.D., Masago, M., Kariyai, K., Yamawaki-Kataoka, Y., Shibatohge, M., ..., & Kataoka, T. (2001).
Regulation of a novel human phospholipase C, PLCepsilon, through membrane targeting by Ras. The Journal of biological chemistry, 276(4), 2752-7. [PubMed:11022048] [WorldCat] [DOI] - ↑
Seifert, J.P., Wing, M.R., Snyder, J.T., Gershburg, S., Sondek, J., & Harden, T.K. (2004).
RhoA activates purified phospholipase C-epsilon by a guanine nucleotide-dependent mechanism. The Journal of biological chemistry, 279(46), 47992-7. [PubMed:15322077] [WorldCat] [DOI] - ↑
Nakahara, M., Shimozawa, M., Nakamura, Y., Irino, Y., Morita, M., Kudo, Y., & Fukami, K. (2005).
A novel phospholipase C, PLC(eta)2, is a neuron-specific isozyme. The Journal of biological chemistry, 280(32), 29128-34. [PubMed:15899900] [WorldCat] [DOI] - ↑
Saunders, C.M., Larman, M.G., Parrington, J., Cox, L.J., Royse, J., Blayney, L.M., ..., & Lai, F.A. (2002).
PLC zeta: a sperm-specific trigger of Ca(2+) oscillations in eggs and embryo development. Development (Cambridge, England), 129(15), 3533-44. [PubMed:12117804] [WorldCat] [DOI] - ↑
Harwood, A.J. (2005).
Lithium and bipolar mood disorder: the inositol-depletion hypothesis revisited. Molecular psychiatry, 10(1), 117-26. [PubMed:15558078] [WorldCat] [DOI] - ↑
Dollins, D.E., Xiong, J.P., Endo-Streeter, S., Anderson, D.E., Bansal, V.S., Ponder, J.W., ..., & York, J.D. (2020).
A structural basis for lithium and substrate binding of an inositide phosphatase. The Journal of biological chemistry, 296, 100059. [PubMed:33172890] [PMC] [WorldCat] [DOI] - ↑ 30.0 30.1
Chakraborty, A., Kim, S., & Snyder, S.H. (2011).
Inositol pyrophosphates as mammalian cell signals. Science signaling, 4(188), re1. [PubMed:21878680] [PMC] [WorldCat] [DOI] - ↑
Irvine, R.F., & Schell, M.J. (2001).
Back in the water: the return of the inositol phosphates. Nature reviews. Molecular cell biology, 2(5), 327-38. [PubMed:11331907] [WorldCat] [DOI] - ↑
Laha, D., Portela-Torres, P., Desfougères, Y., & Saiardi, A. (2021).
Inositol phosphate kinases in the eukaryote landscape. Advances in biological regulation, 79, 100782. [PubMed:33422459] [PMC] [WorldCat] [DOI] - ↑
Lee, J.Y., Kim, Y.R., Park, J., & Kim, S. (2012).
Inositol polyphosphate multikinase signaling in the regulation of metabolism. Annals of the New York Academy of Sciences, 1271, 68-74. [PubMed:23050966] [PMC] [WorldCat] [DOI] - ↑
Mulugu, S., Bai, W., Fridy, P.C., Bastidas, R.J., Otto, J.C., Dollins, D.E., ..., & York, J.D. (2007).
A conserved family of enzymes that phosphorylate inositol hexakisphosphate. Science (New York, N.Y.), 316(5821), 106-9. [PubMed:17412958] [WorldCat] [DOI] - ↑
Lee, Y.S., Mulugu, S., York, J.D., & O'Shea, E.K. (2007).
Regulation of a cyclin-CDK-CDK inhibitor complex by inositol pyrophosphates. Science (New York, N.Y.), 316(5821), 109-12. [PubMed:17412959] [PMC] [WorldCat] [DOI] - ↑
Monserrate, J.P., & York, J.D. (2010).
Inositol phosphate synthesis and the nuclear processes they affect. Current opinion in cell biology, 22(3), 365-73. [PubMed:20359876] [WorldCat] [DOI] - ↑
Ferris, C.D., Huganir, R.L., Supattapone, S., & Snyder, S.H. (1989).
Purified inositol 1,4,5-trisphosphate receptor mediates calcium flux in reconstituted lipid vesicles. Nature, 342(6245), 87-9. [PubMed:2554143] [WorldCat] [DOI] - ↑ 38.0 38.1
Ross, C.A., Meldolesi, J., Milner, T.A., Satoh, T., Supattapone, S., & Snyder, S.H. (1989).
Inositol 1,4,5-trisphosphate receptor localized to endoplasmic reticulum in cerebellar Purkinje neurons. Nature, 339(6224), 468-70. [PubMed:2542801] [WorldCat] [DOI] - ↑
Wayman, G.A., Lee, Y.S., Tokumitsu, H., Silva, A.J., Silva, A., & Soderling, T.R. (2008).
Calmodulin-kinases: modulators of neuronal development and plasticity. Neuron, 59(6), 914-31. [PubMed:18817731] [PMC] [WorldCat] [DOI] - ↑ 40.0 40.1
Furuichi, T., & Mikoshiba, K. (1995).
Inositol 1, 4, 5-trisphosphate receptor-mediated Ca2+ signaling in the brain. Journal of neurochemistry, 64(3), 953-60. [PubMed:7861177] [WorldCat] [DOI] - ↑
Otsu, H., Yamamoto, A., Maeda, N., Mikoshiba, K., & Tashiro, Y. (1990).
Immunogold localization of inositol 1, 4, 5-trisphosphate (InsP3) receptor in mouse cerebellar Purkinje cells using three monoclonal antibodies. Cell structure and function, 15(3), 163-73. [PubMed:2168812] [WorldCat] [DOI] - ↑ 42.0 42.1
Woll, K.A., & Van Petegem, F. (2022).
Calcium-release channels: structure and function of IP3 receptors and ryanodine receptors. Physiological reviews, 102(1), 209-268. [PubMed:34280054] [WorldCat] [DOI] - ↑
Bosanac, I., Alattia, J.R., Mal, T.K., Chan, J., Talarico, S., Tong, F.K., ..., & Ikura, M. (2002).
Structure of the inositol 1,4,5-trisphosphate receptor binding core in complex with its ligand. Nature, 420(6916), 696-700. [PubMed:12442173] [WorldCat] [DOI] - ↑ 44.0 44.1 44.2 44.3 44.4
Yoshikawa, F., Morita, M., Monkawa, T., Michikawa, T., Furuichi, T., & Mikoshiba, K. (1996).
Mutational analysis of the ligand binding site of the inositol 1,4,5-trisphosphate receptor. The Journal of biological chemistry, 271(30), 18277-84. [PubMed:8663526] [WorldCat] [DOI] - ↑
Hamada, K., Miyatake, H., Terauchi, A., & Mikoshiba, K. (2017).
IP3-mediated gating mechanism of the IP3 receptor revealed by mutagenesis and X-ray crystallography. Proceedings of the National Academy of Sciences of the United States of America, 114(18), 4661-4666. [PubMed:28416699] [PMC] [WorldCat] [DOI] - ↑
Ando, H., Mizutani, A., Kiefer, H., Tsuzurugi, D., Michikawa, T., & Mikoshiba, K. (2006).
IRBIT suppresses IP3 receptor activity by competing with IP3 for the common binding site on the IP3 receptor. Molecular cell, 22(6), 795-806. [PubMed:16793548] [WorldCat] [DOI] - ↑ 47.0 47.1 47.2
Collins, S.R., & Meyer, T. (2011).
Evolutionary origins of STIM1 and STIM2 within ancient Ca2+ signaling systems. Trends in cell biology, 21(4), 202-11. [PubMed:21288721] [PMC] [WorldCat] [DOI] - ↑
Putney, J.W. (1990).
Capacitative calcium entry revisited. Cell calcium, 11(10), 611-24. [PubMed:1965707] [WorldCat] [DOI] - ↑
Putney, J.W. (2007).
Recent breakthroughs in the molecular mechanism of capacitative calcium entry (with thoughts on how we got here). Cell calcium, 42(2), 103-10. [PubMed:17349691] [PMC] [WorldCat] [DOI] - ↑
Cahalan, M.D. (2009).
STIMulating store-operated Ca(2+) entry. Nature cell biology, 11(6), 669-77. [PubMed:19488056] [PMC] [WorldCat] [DOI] - ↑
Derler, I., Jardin, I., & Romanin, C. (2016).
Molecular mechanisms of STIM/Orai communication. American journal of physiology. Cell physiology, 310(8), C643-62. [PubMed:26825122] [PMC] [WorldCat] [DOI] - ↑
Niemeyer, B.A. (2016).
Changing calcium: CRAC channel (STIM and Orai) expression, splicing, and posttranslational modifiers. American journal of physiology. Cell physiology, 310(9), C701-9. [PubMed:26911279] [WorldCat] [DOI] - ↑
Soboloff, J., Rothberg, B.S., Madesh, M., & Gill, D.L. (2012).
STIM proteins: dynamic calcium signal transducers. Nature reviews. Molecular cell biology, 13(9), 549-65. [PubMed:22914293] [PMC] [WorldCat] [DOI] - ↑ 54.0 54.1 54.2 54.3
Berridge, M.J. (1998).
Neuronal calcium signaling. Neuron, 21(1), 13-26. [PubMed:9697848] [WorldCat] [DOI] - ↑
Hisatsune, C., & Mikoshiba, K. (2017).
IP3 receptor mutations and brain diseases in human and rodents. Journal of neurochemistry, 141(6), 790-807. [PubMed:28211945] [WorldCat] [DOI] - ↑
Matsumoto, M., Nakagawa, T., Inoue, T., Nagata, E., Tanaka, K., Takano, H., ..., & Noda, T. (1996).
Ataxia and epileptic seizures in mice lacking type 1 inositol 1,4,5-trisphosphate receptor. Nature, 379(6561), 168-71. [PubMed:8538767] [WorldCat] [DOI] - ↑
Takeshima, H., Nishimura, S., Matsumoto, T., Ishida, H., Kangawa, K., Minamino, N., ..., & Hirose, T. (1989).
Primary structure and expression from complementary DNA of skeletal muscle ryanodine receptor. Nature, 339(6224), 439-45. [PubMed:2725677] [WorldCat] [DOI] - ↑ 58.0 58.1 58.2
Berridge, M.J., Bootman, M.D., & Roderick, H.L. (2003).
Calcium signalling: dynamics, homeostasis and remodelling. Nature reviews. Molecular cell biology, 4(7), 517-29. [PubMed:12838335] [WorldCat] [DOI] - ↑ 59.0 59.1
Marchant, J.S., Gunaratne, G.S., Cai, X., Slama, J.T., & Patel, S. (2022).
NAADP-binding proteins find their identity. Trends in biochemical sciences, 47(3), 235-249. [PubMed:34810081] [PMC] [WorldCat] [DOI] - ↑
Calcraft, P.J., Ruas, M., Pan, Z., Cheng, X., Arredouani, A., Hao, X., ..., & Zhu, M.X. (2009).
NAADP mobilizes calcium from acidic organelles through two-pore channels. Nature, 459(7246), 596-600. [PubMed:19387438] [PMC] [WorldCat] [DOI] - ↑
Ogunbayo, O.A., Zhu, Y., Rossi, D., Sorrentino, V., Ma, J., Zhu, M.X., & Evans, A.M. (2011).
Cyclic adenosine diphosphate ribose activates ryanodine receptors, whereas NAADP activates two-pore domain channels. The Journal of biological chemistry, 286(11), 9136-40. [PubMed:21216967] [PMC] [WorldCat] [DOI] - ↑
Iwai, M., Michikawa, T., Bosanac, I., Ikura, M., & Mikoshiba, K. (2007).
Molecular basis of the isoform-specific ligand-binding affinity of inositol 1,4,5-trisphosphate receptors. The Journal of biological chemistry, 282(17), 12755-64. [PubMed:17327232] [WorldCat] [DOI] - ↑
Iwai, M., Tateishi, Y., Hattori, M., Mizutani, A., Nakamura, T., Futatsugi, A., ..., & Mikoshiba, K. (2005).
Molecular cloning of mouse type 2 and type 3 inositol 1,4,5-trisphosphate receptors and identification of a novel type 2 receptor splice variant. The Journal of biological chemistry, 280(11), 10305-17. [PubMed:15632133] [WorldCat] [DOI] - ↑ 64.0 64.1
Michikawa, T., Hirota, J., Kawano, S., Hiraoka, M., Yamada, M., Furuichi, T., & Mikoshiba, K. (1999).
Calmodulin mediates calcium-dependent inactivation of the cerebellar type 1 inositol 1,4,5-trisphosphate receptor. Neuron, 23(4), 799-808. [PubMed:10482245] [WorldCat] [DOI] - ↑
Tu, H., Wang, Z., Nosyreva, E., De Smedt, H., & Bezprozvanny, I. (2005).
Functional characterization of mammalian inositol 1,4,5-trisphosphate receptor isoforms. Biophysical journal, 88(2), 1046-55. [PubMed:15533917] [PMC] [WorldCat] [DOI] - ↑
Demuro, A., & Parker, I. (2015).
Picomolar sensitivity to inositol trisphosphate in Xenopus oocytes. Cell calcium, 58(5), 511-7. [PubMed:26344104] [PMC] [WorldCat] [DOI] - ↑
Harraz, O.F., & Altier, C. (2014).
STIM1-mediated bidirectional regulation of Ca(2+) entry through voltage-gated calcium channels (VGCC) and calcium-release activated channels (CRAC). Frontiers in cellular neuroscience, 8, 43. [PubMed:24605083] [PMC] [WorldCat] [DOI] - ↑ 68.0 68.1 68.2
Bootman, M.D., Berridge, M.J., & Lipp, P. (1997).
Cooking with calcium: the recipes for composing global signals from elementary events. Cell, 91(3), 367-73. [PubMed:9363945] [WorldCat] [DOI] - ↑
Luzzi, V., Sims, C.E., Soughayer, J.S., & Allbritton, N.L. (1998).
The physiologic concentration of inositol 1,4,5-trisphosphate in the oocytes of Xenopus laevis. The Journal of biological chemistry, 273(44), 28657-62. [PubMed:9786859] [WorldCat] [DOI] - ↑ 70.0 70.1 70.2
Allbritton, N.L., Meyer, T., & Stryer, L. (1992).
Range of messenger action of calcium ion and inositol 1,4,5-trisphosphate. Science (New York, N.Y.), 258(5089), 1812-5. [PubMed:1465619] [WorldCat] [DOI] - ↑
Wang, S.S., Alousi, A.A., & Thompson, S.H. (1995).
The lifetime of inositol 1,4,5-trisphosphate in single cells. The Journal of general physiology, 105(1), 149-71. [PubMed:7730788] [PMC] [WorldCat] [DOI] - ↑ 72.0 72.1
Dickinson, G.D., Ellefsen, K.L., Dawson, S.P., Pearson, J.E., & Parker, I. (2016).
Hindered cytoplasmic diffusion of inositol trisphosphate restricts its cellular range of action. Science signaling, 9(453), ra108. [PubMed:27919026] [PMC] [WorldCat] [DOI] - ↑ 73.0 73.1
Lock, J.T., Smith, I.F., & Parker, I. (2019).
Spatial-temporal patterning of Ca2+ signals by the subcellular distribution of IP3 and IP3 receptors. Seminars in cell & developmental biology, 94, 3-10. [PubMed:30703557] [PMC] [WorldCat] [DOI] - ↑ 74.0 74.1
Parker, I., Choi, J., & Yao, Y. (1996).
Elementary events of InsP3-induced Ca2+ liberation in Xenopus oocytes: hot spots, puffs and blips. Cell calcium, 20(2), 105-21. [PubMed:8889202] [WorldCat] [DOI] - ↑ 75.0 75.1
Leybaert, L., & Sanderson, M.J. (2012).
Intercellular Ca(2+) waves: mechanisms and function. Physiological reviews, 92(3), 1359-92. [PubMed:22811430] [PMC] [WorldCat] [DOI] - ↑ 76.0 76.1 76.2 76.3 76.4
Lock, J.T., & Parker, I. (2020).
IP3 mediated global Ca2+ signals arise through two temporally and spatially distinct modes of Ca2+ release. eLife, 9. [PubMed:32396066] [PMC] [WorldCat] [DOI] - ↑
Bezprozvanny, I., Watras, J., & Ehrlich, B.E. (1991).
Bell-shaped calcium-response curves of Ins(1,4,5)P3- and calcium-gated channels from endoplasmic reticulum of cerebellum. Nature, 351(6329), 751-4. [PubMed:1648178] [WorldCat] [DOI] - ↑
Iino, M. (1990).
Biphasic Ca2+ dependence of inositol 1,4,5-trisphosphate-induced Ca release in smooth muscle cells of the guinea pig taenia caeci. The Journal of general physiology, 95(6), 1103-22. [PubMed:2373998] [PMC] [WorldCat] [DOI] - ↑
Parker, I., & Ivorra, I. (1990).
Inhibition by Ca2+ of inositol trisphosphate-mediated Ca2+ liberation: a possible mechanism for oscillatory release of Ca2+. Proceedings of the National Academy of Sciences of the United States of America, 87(1), 260-4. [PubMed:2296584] [PMC] [WorldCat] [DOI] - ↑
Bootman, M., Niggli, E., Berridge, M., & Lipp, P. (1997).
Imaging the hierarchical Ca2+ signalling system in HeLa cells. The Journal of physiology, 499 ( Pt 2), 307-14. [PubMed:9080361] [PMC] [WorldCat] [DOI] - ↑
Parker, I., & Yao, Y. (1991).
Regenerative release of calcium from functionally discrete subcellular stores by inositol trisphosphate. Proceedings. Biological sciences, 246(1317), 269-74. [PubMed:1686093] [WorldCat] [DOI] - ↑ 82.0 82.1 82.2 82.3
Clapham, D.E. (2007).
Calcium signaling. Cell, 131(6), 1047-58. [PubMed:18083096] [WorldCat] [DOI] - ↑
Berridge, M.J. (1997).
The AM and FM of calcium signalling. Nature, 386(6627), 759-60. [PubMed:9126727] [WorldCat] [DOI] - ↑
Dolmetsch, R.E., Lewis, R.S., Goodnow, C.C., & Healy, J.I. (1997).
Differential activation of transcription factors induced by Ca2+ response amplitude and duration. Nature, 386(6627), 855-8. [PubMed:9126747] [WorldCat] [DOI] - ↑ 85.0 85.1
Li, L., Stefan, M.I., & Le Novère, N. (2012).
Calcium input frequency, duration and amplitude differentially modulate the relative activation of calcineurin and CaMKII. PloS one, 7(9), e43810. [PubMed:22962589] [PMC] [WorldCat] [DOI] - ↑
Parekh, A.B. (2011).
Decoding cytosolic Ca2+ oscillations. Trends in biochemical sciences, 36(2), 78-87. [PubMed:20810284] [WorldCat] [DOI] - ↑ 87.0 87.1
Smedler, E., & Uhlén, P. (2014).
Frequency decoding of calcium oscillations. Biochimica et biophysica acta, 1840(3), 964-9. [PubMed:24269537] [WorldCat] [DOI] - ↑
Augustine, G.J., Santamaria, F., & Tanaka, K. (2003).
Local calcium signaling in neurons. Neuron, 40(2), 331-46. [PubMed:14556712] [WorldCat] [DOI] - ↑
Decrock, E., Krysko, D.V., Vinken, M., Kaczmarek, A., Crispino, G., Bol, M., ..., & Leybaert, L. (2012).
Transfer of IP₃ through gap junctions is critical, but not sufficient, for the spread of apoptosis. Cell death and differentiation, 19(6), 947-57. [PubMed:22117194] [PMC] [WorldCat] [DOI] - ↑
Hirose, K., Kadowaki, S., Tanabe, M., Takeshima, H., & Iino, M. (1999).
Spatiotemporal dynamics of inositol 1,4,5-trisphosphate that underlies complex Ca2+ mobilization patterns. Science (New York, N.Y.), 284(5419), 1527-30. [PubMed:10348740] [WorldCat] [DOI] - ↑
Tanimura, A., Nezu, A., Morita, T., Turner, R.J., & Tojyo, Y. (2004).
Fluorescent biosensor for quantitative real-time measurements of inositol 1,4,5-trisphosphate in single living cells. The Journal of biological chemistry, 279(37), 38095-8. [PubMed:15272011] [WorldCat] [DOI] - ↑
Tanimura, A., Morita, T., Nezu, A., Shitara, A., Hashimoto, N., & Tojyo, Y. (2009).
Use of Fluorescence Resonance Energy Transfer-based Biosensors for the Quantitative Analysis of Inositol 1,4,5-Trisphosphate Dynamics in Calcium Oscillations. The Journal of biological chemistry, 284(13), 8910-7. [PubMed:19158094] [PMC] [WorldCat] [DOI] - ↑
Sato, M., Ueda, Y., Shibuya, M., & Umezawa, Y. (2005).
Locating inositol 1,4,5-trisphosphate in the nucleus and neuronal dendrites with genetically encoded fluorescent indicators. Analytical chemistry, 77(15), 4751-8. [PubMed:16053285] [WorldCat] [DOI] - ↑
Remus, T.P., Zima, A.V., Bossuyt, J., Bare, D.J., Martin, J.L., Blatter, L.A., ..., & Mignery, G.A. (2006).
Biosensors to measure inositol 1,4,5-trisphosphate concentration in living cells with spatiotemporal resolution. The Journal of biological chemistry, 281(1), 608-16. [PubMed:16249182] [WorldCat] [DOI] - ↑
Gulyás, G., Tóth, J.T., Tóth, D.J., Kurucz, I., Hunyady, L., Balla, T., & Várnai, P. (2015).
Measurement of inositol 1,4,5-trisphosphate in living cells using an improved set of resonance energy transfer-based biosensors. PloS one, 10(5), e0125601. [PubMed:25932648] [PMC] [WorldCat] [DOI] - ↑
Matsu-ura, T., Michikawa, T., Inoue, T., Miyawaki, A., Yoshida, M., & Mikoshiba, K. (2006).
Cytosolic inositol 1,4,5-trisphosphate dynamics during intracellular calcium oscillations in living cells. The Journal of cell biology, 173(5), 755-65. [PubMed:16754959] [PMC] [WorldCat] [DOI] - ↑ 97.0 97.1
Matsu-Ura, T., Shirakawa, H., Suzuki, K.G.N., Miyamoto, A., Sugiura, K., Michikawa, T., ..., & Mikoshiba, K. (2019).
Dual-FRET imaging of IP3 and Ca2+ revealed Ca2+-induced IP3 production maintains long lasting Ca2+ oscillations in fertilized mouse eggs. Scientific reports, 9(1), 4829. [PubMed:30886280] [PMC] [WorldCat] [DOI] - ↑
Oura, T., Murata, K., Morita, T., Nezu, A., Arisawa, M., Shuto, S., & Tanimura, A. (2016).
Highly Sensitive Measurement of Inositol 1,4,5-Trisphosphate by Using a New Fluorescent Ligand and Ligand Binding Domain Combination. Chembiochem : a European journal of chemical biology, 17(16), 1509-12. [PubMed:27251449] [WorldCat] [DOI] - ↑
Yoshikawa, F., Uchiyama, T., Iwasaki, H., Tomomori-Satoh, C., Tanaka, T., Furuichi, T., & Mikoshiba, K. (1999).
High efficient expression of the functional ligand binding site of the inositol 1,4,5-triphosphate receptor in Escherichia coli. Biochemical and biophysical research communications, 257(3), 792-7. [PubMed:10208862] [WorldCat] [DOI] - ↑
Uchiyama, T., Yoshikawa, F., Hishida, A., Furuichi, T., & Mikoshiba, K. (2002).
A novel recombinant hyperaffinity inositol 1,4,5-trisphosphate (IP(3)) absorbent traps IP(3), resulting in specific inhibition of IP(3)-mediated calcium signaling. The Journal of biological chemistry, 277(10), 8106-13. [PubMed:11741904] [WorldCat] [DOI] - ↑
Tanaka, M., Shih, P.Y., Gomi, H., Yoshida, T., Nakai, J., Ando, R., ..., & Itohara, S. (2013).
Astrocytic Ca2+ signals are required for the functional integrity of tripartite synapses. Molecular brain, 6, 6. [PubMed:23356992] [PMC] [WorldCat] [DOI]