TAG-1
増田 知之
筑波大学 医学医療系
DOI:10.14931/bsd.6825 原稿受付日:2016年2月1日 原稿完成日:2016年6月4日
担当編集委員:大隅 典子(東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)
英語名:TAG-1(transiently expressed axonal surface glycoprotein-1)
同義語:SNAP、コンタクチン2(Contactin 2)、TAX-1(ヒト、human TAG-1/axonin-1の略)、アキソニン-1(ニワトリ、axonin-1)、SC2(ニワトリ)
免疫グロブリンスーパーファミリー分子群に属する細胞表面分子である。細胞外領域に6個の免疫グロブリン様ドメインと4個のフィブロネクチンⅢ様ドメインを持ち、グリコシルホスファチジルイノシトール(GPI)によって細胞膜に結合している。特定の神経細胞に発現し、胎生期では伸長中の神経軸索表面に一過性に発現する例が多い。成体期では、小脳顆粒細胞、海馬錐体細胞、有髄神経線維のジャクスタパラノード等に発現がみられる。免疫グロブリンスーパーファミリー分子をはじめとするさまざまな分子と結合し、胎生期の神経系で、軸索伸長・軸索ガイダンス・細胞移動に重要な役割を果たすほか、成体期の神経系でも有髄神経線維の形成において必須な働きを有する。ヒト神経系の自己免疫疾患の関連因子としても知られており、発生から疾患に至るまで、神経系において多様な機能を担っている。
背景・歴史的推移
ラット胎仔脳を抗原として得られたモノクローナル抗体4D7の認識する分子として見出され、SNAP(stage-specific neurite-associated proteins)と呼ばれた[1]。
その後、その抗原分子はラット胎仔の脳・脊髄を用いて同定され、新たにTAG-1(transiently expressed axonal surface glycoprotein-1)と名付けられた[2]。さらにラットでcDNAが単離され、遺伝子配列も明らかとなった[3]。
上記とは独立した系で、アキソニン-1がニワトリで同定された[4]。その後、アキソニン-1は、ラットのTAG-1およびヒトのTAX-1のニワトリホモログであることが明らかとなった[5]。
遺伝子名は、現在、ホモログも含め、以下のような統一名称(CNTN2、Cntn2)となっている。
CNTN2 contactin 2 Homo sapiens (human): Gene ID: 6900
Cntn2 contactin 2 Rattus norvegicus (Norway rat): Gene ID: 25356
Cntn2 contactin 2 Mus musculus (house mouse): Gene ID: 21367
CNTN2 contactin 2 Gallus gallus (chicken): Gene ID: 419825
(註)TAG-1という名称は、厳密にはげっ歯類における分子名であるが、実際には、ヒトやニワトリのホモログに対しても使用することが多い。現在、統一名称として「コンタクチン2」も用いられているが、この名称はまだ馴染みが薄く、単独ではあまり使用されていない。本稿では新名称を用いず、ヒトとニワトリの記述ではそれぞれのホモログ名であるTAX-1とアキソニン-1を使用し、どの動物種を用いた研究成果であるか、一目で判るように工夫した。
分子構造とサブファミリー
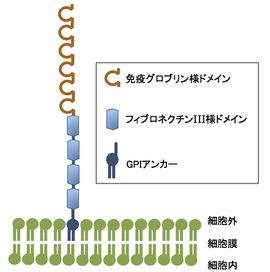
TAG-1は6個の免疫グロブリン様ドメインと4個のフィブロネクチンⅢ様ドメイン、およびグリコシルホスファチジルイノシトール(GPI)で構成され、GPIで細胞膜に結合している。
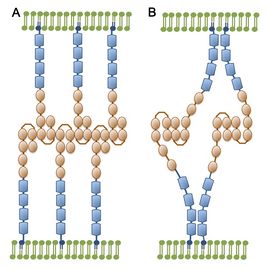
A. アキソニン-1で提唱されているジッパーモード。
B. TAX-1で提唱されている4分子モード。([6]p. 2178 図4より改変)
一次構造(ドメイン構造)
アミノ酸残基数は、ヒト・ラット・マウスで 1040 aa、ニワトリ で1036 aaであり、分子量約135 kDaの糖タンパク質である。
神経系に発現する免疫グロブリンスーパーファミリー分子群のグループⅡ(細胞外領域に複数の免疫グロブリン様ドメインと、複数のフィブロネクチンⅢ様ドメインを持つ群)に属する。
さらにこのグループⅡは、いくつかのサブグループに分けられ、TAG-1はコンタクチン・サブグループに属している。コンタクチン・サブグループは6個の分子で構成され、コンタクチン1~6という新しい名称で呼ばれている。TAG-1の新名称はコンタクチン2である。
TAG-1も含めたコンタクチン・サブグループの6個の分子は,いずれも細胞外領域に6個の免疫グロブリン様ドメインと4個のフィブロネクチンⅢ様ドメインを持ち、グリコシルホスファチジルイノシトール(GPI)によって細胞膜に結合し、膜表面に存在する(図1)。なお、TAG-1には分泌型も存在し、ラット胎仔脳から大量の可溶性TAG-1が検出されている[3]。
立体構造
アキソニン-1のN末端[7]とTAX-1のN末端で[6]、その結晶構造が調べられている。
細胞間の相互作用におけるTAG-1の状態については、以下の2つのモデルが提唱されている(図2)[6]。
アキソニン-1で提唱されているモデルは、ジッパーモードと呼ばれ、2番目と3番目の免疫グロブリン様ドメインに、相互作用する箇所を持つ(図2A)。一方で、TAX-1で提唱されているモデルは、4分子モードと呼ばれ、免疫グロブリン様ドメインだけでなくフィブロネクチンⅢ様ドメインも介して、トランス・シス結合するのが特徴である(図2B)。
発現様式
Allen Brain Atlasで、胎生期および生後発達期のマウス脳(矢状断)におけるin situ hybridization染色像が公開されている。
E11.5
E13.5
E15.5
E18.5
P4
P14
P28
P56
胎生期・生後発達期
特定の神経細胞に発現する。特に伸長中の神経線維(神経軸索)表面に一過性に発現する例が多く、胎生期の脊髄運動ニューロンや脊髄交連性介在ニューロンの神経線維表面に一過性に発現するほか[1]、脊髄後根神経節細胞の神経線維、外側嗅索、前交連、脳梁、小脳皮質分子層などに発現がみられる[1]、[8]。また、生後発達期の小脳では、外顆粒細胞層の内側に一過性の発現がみられる[3]。さらに、アキソニン-1は、ニワトリ胚の網膜視蓋投射系にも発現する[9] [10]。
成体期
げっ歯類の神経系で、小脳顆粒細胞、嗅球僧帽細胞、海馬CA1とCA3の錐体細胞に発現する[11] [12]。また、有髄神経線維のジャクスタパラノード(傍パラノード、juxtaparanode)にも発現がみられる[13]。
生理機能
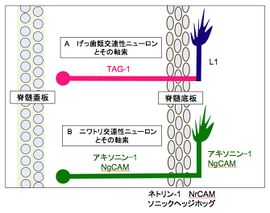
A. げっ歯類胎仔の交連性ニューロン軸索と発現する分子。
B. ニワトリ胚の交連性ニューロン軸索と発現する分子。
([14] p. 179 図2Aより改変)
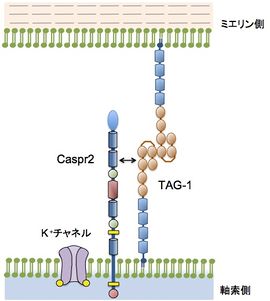
ジャクスタパラノードでは、TAG-1は軸索側とミエリン側の両方に存在し、Caspr2と結合して複合体を作っている(TAG-1同士のトランス結合はジッパーモードの例で示した)。
([15] p. 970 図2Cより改変)
結合タンパク質
TAG-1同士[16]、アキソニン-1同士[17] [18]のホモフィリックな結合が知られている。また、TAX-1と免疫グロブリンスーパーファミリー分子L1の結合[19]、およびアキソニン-1とNgCAM(L1のニワトリホモログ)との結合[18] [20] [21]が報告されている。さらに、TAX-1が免疫グロブリンスーパーファミリー分子F3(コンタクチン1)およびNrCAMと結合することや[19]、アキソニン-1がNrCAMと結合すること[22] [23]もわかっている。
その他に、アキソニン-1は、免疫グロブリンスーパーファミリー分子のNCAM、コンドロイチン硫酸プロテオグリカンのニューロカン・フォスファカン、細胞外マトリックスの構成タンパク質であるテネイシンCとも結合することが知られている[24]。また、TAG-1/TAX-1はアミロイド前駆体タンパク質とも結合する[25]。
胎生期の神経系における機能
脊髄の交連性介在ニューロンの神経軸索は、脊髄底板より分泌されるネトリン-1やソニックヘッジホッグといった軸索誘引因子に誘導され、脊髄の腹側正中部にある底板に向かい、その後、底板を通過して対側へと投射する[26]。
げっ歯類の胎仔では、交連性ニューロンの軸索は、底板に向かう際、その表面にTAG-1を強く発現する。ところが、底板を越えるとTAG-1の発現は無くなり、代わりにL1が発現するようになる(図3A)[2]。
その一方で、ニワトリ胚の脊髄交連性ニューロンの軸索は、底板通過後も変わらずアキソニン-1とNgCAMを発現しており、その発現様式はげっ歯類とやや異なる(図3B)。アキソニン-1は交連性ニューロン軸索の神経束形成とガイダンスに関与するが、伸長には関与していない[23] [27]。また、交連性ニューロンの軸索が底板を通過するためには、この軸索表面のアキソニン-1と底板細胞表面のNrCAMとの相互作用が必要である(図3B)[23] [28] [29]。
胎生期の後根神経節軸索の表面に発現するTAG-1/アキソニン-1は、後根神経節軸索の伸長[3] [30]、神経束形成[30] [31]、ガイダンス[31] [32] [33] [34] [35]のいずれにも関与することが知られている。
後根神経節軸索の伸長は、基質上のTAG-1と軸索上のTAG-1のホモフィリックな結合によってではなく、L1/NgCAM、β1インテグリンとTAG-1のヘテロフィリックな結合によってもたらされる[16] [17] [20]。
脊髄内侵入後の後根神経節軸索(求心性線維)のガイダンスには、軸索表面に発現するアキソニン-1と、脊髄に発現する他の免疫グロブリンスーパーファミリー分子(NgCAM、NrCAM、F11)との接触を介した相互作用が必要である[32]。一方、後根神経節軸索表面のTAG-1/アキソニン-1は、脊索や脊髄腹側部から出る拡散性の軸索反発因子の受容に関与する[31] [33] [34] [35]。さらに、軸索反発因子セマフォリン3Aの受容体複合体(L1/ニューロピリン-1)のエンドサイトーシスを制御することで、TAG-1はセマフォリン3Aに対する後根神経節軸索の反応性も調節している[35] [36]。
胎生期のマウス大脳皮質では、成熟したニューロンの軸索(パイオニア軸索)と未熟なニューロンとの間の相互作用を仲介しており、未熟なニューロンの軸索形成に重要な役割を果たしている[37]。
さまざまな神経細胞の移動にも重要な役割を果たしている。胎生期のマウス大脳皮質では、神経幹細胞は細長い形態をとっているが、TAG-1を欠失させるとその形態は短くなり、核の移動ができなくなる[38]。その結果として、大脳皮質の層形成に異常が生じることが報告されている[38]。また、TAG-1欠損マウス胎仔を用いた解析から、マウス胎仔の延髄尾側部では、表層移動する細胞がTAG-1欠損で移動中に細胞死を起こし、外側網様核が小さくなることが明らかとなった[39]。一方で、基底核原基から大脳皮質に移動する抑制性神経細胞の移動には、TAG-1は関与していないことが示されている[39]。
胎生期のマウス小脳では、小脳顆粒細胞の前駆細胞表面に発現しており、同細胞の未熟な分化を妨げる働きをしている[40]。さらに、アキソニン-1は、ニワトリ小脳顆粒細胞の平行線維のガイダンスに必要であるが、伸長には必要ないことが示されている[41]。
成体期の神経系における機能
有髄神経線維に存在するジャクスタパラノードの軸索側とミエリン側の両方に発現しており、軸索側では、Caspr2とシス結合してヘテロダイマーとなり、ミエリン側のTAG-1とともに複合体を形成している(図4)[13] [42] [43] [44]。この複合体はジャクスタパラノードでのK+チャネルの集積に必要であり[43] [44]、有髄神経線維の形成と維持にTAG-1は重要な役割を担っている。なお、ジャクスタパラノード以外に、シナプスでもTAG-1はCaspr2と共局在している[45]。
その他には、アミロイド前駆体タンパク質APPと相互作用することで,マウスの神経新生を抑制することが知られている[25]。
シグナル伝達系
膜貫通領域を持たないTAG-1であるが、いくつかの細胞内シグナル伝達系との関連が明らかとなっている。胎生期のマウス大脳皮質ニューロンを用いた解析から、TAG-1はSrcファミリーのLynを介して、ニューロンの極性化を制御することがわかっている[37]。同じく胎生期のラット小脳顆粒細胞でも、TAG-1のシグナルはLynを介して細胞内に伝達することがわかっている[46]。
一方で、胎生期のニワトリ後根神経節軸索では、アキソニン-1のシグナルは、SrcファミリーのFynを介して細胞内に伝達するとの報告もある[47]。
遺伝子変異
遺伝子改変マウス
- 2001年に発表されたTAG-1欠損マウス(C57BL/6)
日本の研究グループが作製したマウスで、TAG-1遺伝子の第2〜5エクソンを欠失させている[48]。野生型と比較して、外観および脳組織の構築に大きな異常はみられなかったが、海馬においてアデノシン受容体が増加しており、けいれん発作を起こしやすいなど、神経系に機能的な異常がみられた[48]。
また、坐骨神経線維において、K+チャネルおよびCaspr2の発現量が減少しており、行動実験の結果から記憶と学習に障害があることが判明した[49]。さらに、網膜神経節細胞の軸索では、ミエリンの形成不全もみられている[50]。加えて、嗅球においては僧帽細胞が減少しており、嗅覚行動に異常がみられることが明らかとなった[51]。 - 2003年に発表されたTAG-1欠損マウス(C57BL/6J)
英国の研究グループが作製したマウスで、TAG-1遺伝子の第2〜6エクソンを欠失させている[43]。メンデルの法則通りの頻度で産まれ、見た目は野生型と変わらない。中枢神経系の組織解析では、日本のグループのTAG-1欠損マウス同様、形態的な異常はみられなかった[43]。また、野生型と比較して、代謝機能が低いとの報告がある[52]。
遺伝子変異と神経疾患
TAX-1は第1染色体(1q32)にマッピングされている[53]。
末梢神経の自己免疫疾患である慢性炎症性脱髄性多発ニューロパシー(CIDP)患者の遺伝子を用いたSNP 解析から、TAX-1遺伝子がCIDPの難治性・治療抵抗性に影響を及ぼす遺伝子であることが判明した[54] [55]。
中枢神経の自己免疫疾患である多発性硬化症の患者において、TAX-1は自己抗体の標的タンパク質の1つであることが明らかとなった[56]。また、皮質性振戦・てんかんの原因遺伝子との報告もある[57]。
関連項目
参考文献
- ↑ 1.0 1.1 1.2
Yamamoto, M., Boyer, A.M., Crandall, J.E., Edwards, M., & Tanaka, H. (1986).
Distribution of stage-specific neurite-associated proteins in the developing murine nervous system recognized by a monoclonal antibody. The Journal of neuroscience : the official journal of the Society for Neuroscience, 6(12), 3576-94. [PubMed:3794790] [WorldCat] - ↑ 2.0 2.1
Dodd, J., Morton, S.B., Karagogeos, D., Yamamoto, M., & Jessell, T.M. (1988).
Spatial regulation of axonal glycoprotein expression on subsets of embryonic spinal neurons. Neuron, 1(2), 105-16. [PubMed:3272160] [WorldCat] [DOI] - ↑ 3.0 3.1 3.2 3.3
Furley, A.J., Morton, S.B., Manalo, D., Karagogeos, D., Dodd, J., & Jessell, T.M. (1990).
The axonal glycoprotein TAG-1 is an immunoglobulin superfamily member with neurite outgrowth-promoting activity. Cell, 61(1), 157-70. [PubMed:2317872] [WorldCat] [DOI] - ↑
Zuellig, R.A., Rader, C., Schroeder, A., Kalousek, M.B., Von Bohlen und Halbach, F., Osterwalder, T., ..., & Fritz, A. (1992).
The axonally secreted cell adhesion molecule, axonin-1. Primary structure, immunoglobulin-like and fibronectin-type-III-like domains and glycosyl-phosphatidylinositol anchorage. European journal of biochemistry, 204(2), 453-63. [PubMed:1311675] [WorldCat] [DOI] - ↑
Hasler, T.H., Rader, C., Stoeckli, E.T., Zuellig, R.A., & Sonderegger, P. (1993).
cDNA cloning, structural features, and eucaryotic expression of human TAG-1/axonin-1. European journal of biochemistry, 211(1-2), 329-39. [PubMed:8425542] [WorldCat] [DOI] - ↑ 6.0 6.1 6.2
Mörtl, M., Sonderegger, P., Diederichs, K., & Welte, W. (2007).
The crystal structure of the ligand-binding module of human TAG-1 suggests a new mode of homophilic interaction. Protein science : a publication of the Protein Society, 16(10), 2174-83. [PubMed:17766378] [PMC] [WorldCat] [DOI] - ↑
Freigang, J., Proba, K., Leder, L., Diederichs, K., Sonderegger, P., & Welte, W. (2000).
The crystal structure of the ligand binding module of axonin-1/TAG-1 suggests a zipper mechanism for neural cell adhesion. Cell, 101(4), 425-33. [PubMed:10830169] [WorldCat] [DOI] - ↑
Wolfer, D.P., Henehan-Beatty, A., Stoeckli, E.T., Sonderegger, P., & Lipp, H.P. (1994).
Distribution of TAG-1/axonin-1 in fibre tracts and migratory streams of the developing mouse nervous system. The Journal of comparative neurology, 345(1), 1-32. [PubMed:8089271] [WorldCat] [DOI] - ↑
Morino, P., Buchstaller, A., Giger, R., Sonderegger, P., & Rager, G. (1996).
Differential expression of the mRNAs of the axonal glycoproteins axonin-1 and NgCAM in the developing chick retina. Brain research. Developmental brain research, 91(2), 252-9. [PubMed:8852376] [WorldCat] [DOI] - ↑
Rager, G., Morino, P., Schnitzer, J., & Sonderegger, P. (1996).
Expression of the axonal cell adhesion molecules axonin-1 and Ng-CAM during the development of the chick retinotectal system. The Journal of comparative neurology, 365(4), 594-609. [PubMed:8742305] [WorldCat] [DOI] - ↑
Yoshihara, Y., Kawasaki, M., Tamada, A., Nagata, S., Kagamiyama, H., & Mori, K. (1995).
Overlapping and differential expression of BIG-2, BIG-1, TAG-1, and F3: four members of an axon-associated cell adhesion molecule subgroup of the immunoglobulin superfamily. Journal of neurobiology, 28(1), 51-69. [PubMed:8586965] [WorldCat] [DOI] - ↑
Wolfer, D.P., Giger, R.J., Stagliar, M., Sonderegger, P., & Lipp, H.P. (1998).
Expression of the axon growth-related neural adhesion molecule TAG-1/axonin-1 in the adult mouse brain. Anatomy and embryology, 197(3), 177-85. [PubMed:9543336] [WorldCat] [DOI] - ↑ 13.0 13.1
Traka, M., Dupree, J.L., Popko, B., & Karagogeos, D. (2002).
The neuronal adhesion protein TAG-1 is expressed by Schwann cells and oligodendrocytes and is localized to the juxtaparanodal region of myelinated fibers. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(8), 3016-24. [PubMed:11943804] [PMC] [WorldCat] [DOI] - ↑
Kaprielian, Z., Imondi, R., & Runko, E. (2000).
Axon guidance at the midline of the developing CNS. The Anatomical record, 261(5), 176-97. [PubMed:11058217] [WorldCat] [DOI] - ↑
Poliak, S., & Peles, E. (2003).
The local differentiation of myelinated axons at nodes of Ranvier. Nature reviews. Neuroscience, 4(12), 968-80. [PubMed:14682359] [WorldCat] [DOI] - ↑ 16.0 16.1
Felsenfeld, D.P., Hynes, M.A., Skoler, K.M., Furley, A.J., & Jessell, T.M. (1994).
TAG-1 can mediate homophilic binding, but neurite outgrowth on TAG-1 requires an L1-like molecule and beta 1 integrins. Neuron, 12(3), 675-90. [PubMed:7512353] [WorldCat] [DOI] - ↑ 17.0 17.1
Rader, C., Stoeckli, E.T., Ziegler, U., Osterwalder, T., Kunz, B., & Sonderegger, P. (1993).
Cell-cell adhesion by homophilic interaction of the neuronal recognition molecule axonin-1. European journal of biochemistry, 215(1), 133-41. [PubMed:8344273] [WorldCat] [DOI] - ↑ 18.0 18.1
Kunz, S., Spirig, M., Ginsburg, C., Buchstaller, A., Berger, P., Lanz, R., ..., & Sonderegger, P. (1998).
Neurite fasciculation mediated by complexes of axonin-1 and Ng cell adhesion molecule. The Journal of cell biology, 143(6), 1673-90. [PubMed:9852159] [PMC] [WorldCat] [DOI] - ↑ 19.0 19.1
Pavlou, O., Theodorakis, K., Falk, J., Kutsche, M., Schachner, M., Faivre-Sarrailh, C., & Karagogeos, D. (2002).
Analysis of interactions of the adhesion molecule TAG-1 and its domains with other immunoglobulin superfamily members. Molecular and cellular neurosciences, 20(3), 367-81. [PubMed:12139915] [WorldCat] - ↑ 20.0 20.1
Kuhn, T.B., Stoeckli, E.T., Condrau, M.A., Rathjen, F.G., & Sonderegger, P. (1991).
Neurite outgrowth on immobilized axonin-1 is mediated by a heterophilic interaction with L1(G4). The Journal of cell biology, 115(4), 1113-26. [PubMed:1720120] [PMC] [WorldCat] [DOI] - ↑
Buchstaller, A., Kunz, S., Berger, P., Kunz, B., Ziegler, U., Rader, C., & Sonderegger, P. (1996).
Cell adhesion molecules NgCAM and axonin-1 form heterodimers in the neuronal membrane and cooperate in neurite outgrowth promotion. The Journal of cell biology, 135(6 Pt 1), 1593-607. [PubMed:8978825] [PMC] [WorldCat] [DOI] - ↑
Suter, D.M., Pollerberg, G.E., Buchstaller, A., Giger, R.J., Dreyer, W.J., & Sonderegger, P. (1995).
Binding between the neural cell adhesion molecules axonin-1 and Nr-CAM/Bravo is involved in neuron-glia interaction. The Journal of cell biology, 131(4), 1067-81. [PubMed:7490283] [PMC] [WorldCat] [DOI] - ↑ 23.0 23.1 23.2
Fitzli, D., Stoeckli, E.T., Kunz, S., Siribour, K., Rader, C., Kunz, B., ..., & Sonderegger, P. (2000).
A direct interaction of axonin-1 with NgCAM-related cell adhesion molecule (NrCAM) results in guidance, but not growth of commissural axons. The Journal of cell biology, 149(4), 951-68. [PubMed:10811834] [PMC] [WorldCat] [DOI] - ↑
Milev, P., Maurel, P., Häring, M., Margolis, R.K., & Margolis, R.U. (1996).
TAG-1/axonin-1 is a high-affinity ligand of neurocan, phosphacan/protein-tyrosine phosphatase-zeta/beta, and N-CAM. The Journal of biological chemistry, 271(26), 15716-23. [PubMed:8663515] [WorldCat] [DOI] - ↑ 25.0 25.1
Ma, Q.H., Futagawa, T., Yang, W.L., Jiang, X.D., Zeng, L., Takeda, Y., ..., & Xiao, Z.C. (2008).
A TAG1-APP signalling pathway through Fe65 negatively modulates neurogenesis. Nature cell biology, 10(3), 283-94. [PubMed:18278038] [WorldCat] [DOI] - ↑
Nawabi, H., & Castellani, V. (2011).
Axonal commissures in the central nervous system: how to cross the midline? Cellular and molecular life sciences : CMLS, 68(15), 2539-53. [PubMed:21538161] [WorldCat] [DOI] - ↑
Stoeckli, E.T., & Landmesser, L.T. (1995).
Axonin-1, Nr-CAM, and Ng-CAM play different roles in the in vivo guidance of chick commissural neurons. Neuron, 14(6), 1165-79. [PubMed:7541632] [WorldCat] [DOI] - ↑
Stoeckli, E.T., Sonderegger, P., Pollerberg, G.E., & Landmesser, L.T. (1997).
Interference with axonin-1 and NrCAM interactions unmasks a floor-plate activity inhibitory for commissural axons. Neuron, 18(2), 209-21. [PubMed:9052792] [WorldCat] [DOI] - ↑
Lustig, M., Sakurai, T., & Grumet, M. (1999).
Nr-CAM promotes neurite outgrowth from peripheral ganglia by a mechanism involving axonin-1 as a neuronal receptor. Developmental biology, 209(2), 340-51. [PubMed:10328925] [WorldCat] [DOI] - ↑ 30.0 30.1
Stoeckli, E.T., Kuhn, T.B., Duc, C.O., Ruegg, M.A., & Sonderegger, P. (1991).
The axonally secreted protein axonin-1 is a potent substratum for neurite growth. The Journal of cell biology, 112(3), 449-55. [PubMed:1991792] [PMC] [WorldCat] [DOI] - ↑ 31.0 31.1 31.2
Masuda, T., Okado, N., & Shiga, T. (2000).
The involvement of axonin-1/SC2 in mediating notochord-derived chemorepulsive activities for dorsal root ganglion neurites. Developmental biology, 224(2), 112-21. [PubMed:10926753] [WorldCat] [DOI] - ↑ 32.0 32.1
Perrin, F.E., Rathjen, F.G., & Stoeckli, E.T. (2001).
Distinct subpopulations of sensory afferents require F11 or axonin-1 for growth to their target layers within the spinal cord of the chick. Neuron, 30(3), 707-23. [PubMed:11430805] [WorldCat] [DOI] - ↑ 33.0 33.1
Masuda, T., Tsuji, H., Taniguchi, M., Yagi, T., Tessier-Lavigne, M., Fujisawa, H., ..., & Shiga, T. (2003).
Differential non-target-derived repulsive signals play a critical role in shaping initial axonal growth of dorsal root ganglion neurons. Developmental biology, 254(2), 289-302. [PubMed:12591248] [WorldCat] [DOI] - ↑ 34.0 34.1
Masuda, T., Fukamauchi, F., Takeda, Y., Fujisawa, H., Watanabe, K., Okado, N., & Shiga, T. (2004).
Developmental regulation of notochord-derived repulsion for dorsal root ganglion axons. Molecular and cellular neurosciences, 25(2), 217-27. [PubMed:15019939] [WorldCat] [DOI] - ↑ 35.0 35.1 35.2
Law, C.O., Kirby, R.J., Aghamohammadzadeh, S., & Furley, A.J. (2008).
The neural adhesion molecule TAG-1 modulates responses of sensory axons to diffusible guidance signals. Development (Cambridge, England), 135(14), 2361-71. [PubMed:18550718] [WorldCat] [DOI] - ↑
Dang, P., Smythe, E., & Furley, A.J. (2012).
TAG1 regulates the endocytic trafficking and signaling of the semaphorin3A receptor complex. The Journal of neuroscience : the official journal of the Society for Neuroscience, 32(30), 10370-82. [PubMed:22836270] [PMC] [WorldCat] [DOI] - ↑ 37.0 37.1
Namba, T., Kibe, Y., Funahashi, Y., Nakamuta, S., Takano, T., Ueno, T., ..., & Kaibuchi, K. (2014).
Pioneering axons regulate neuronal polarization in the developing cerebral cortex. Neuron, 81(4), 814-29. [PubMed:24559674] [WorldCat] [DOI] - ↑ 38.0 38.1
Okamoto, M., Namba, T., Shinoda, T., Kondo, T., Watanabe, T., Inoue, Y., ..., & Miyata, T. (2013).
TAG-1-assisted progenitor elongation streamlines nuclear migration to optimize subapical crowding. Nature neuroscience, 16(11), 1556-66. [PubMed:24056697] [WorldCat] [DOI] - ↑ 39.0 39.1
Denaxa, M., Kyriakopoulou, K., Theodorakis, K., Trichas, G., Vidaki, M., Takeda, Y., ..., & Karagogeos, D. (2005).
The adhesion molecule TAG-1 is required for proper migration of the superficial migratory stream in the medulla but not of cortical interneurons. Developmental biology, 288(1), 87-99. [PubMed:16225856] [WorldCat] [DOI] - ↑
Xenaki, D., Martin, I.B., Yoshida, L., Ohyama, K., Gennarini, G., Grumet, M., ..., & Furley, A.J. (2011).
F3/contactin and TAG1 play antagonistic roles in the regulation of sonic hedgehog-induced cerebellar granule neuron progenitor proliferation. Development (Cambridge, England), 138(3), 519-29. [PubMed:21205796] [PMC] [WorldCat] [DOI] - ↑
Baeriswyl, T., & Stoeckli, E.T. (2008).
Axonin-1/TAG-1 is required for pathfinding of granule cell axons in the developing cerebellum. Neural development, 3, 7. [PubMed:18346270] [PMC] [WorldCat] [DOI] - ↑
Poliak, S., Gollan, L., Martinez, R., Custer, A., Einheber, S., Salzer, J.L., ..., & Peles, E. (1999).
Caspr2, a new member of the neurexin superfamily, is localized at the juxtaparanodes of myelinated axons and associates with K+ channels. Neuron, 24(4), 1037-47. [PubMed:10624965] [WorldCat] [DOI] - ↑ 43.0 43.1 43.2 43.3
Poliak, S., Salomon, D., Elhanany, H., Sabanay, H., Kiernan, B., Pevny, L., ..., & Peles, E. (2003).
Juxtaparanodal clustering of Shaker-like K+ channels in myelinated axons depends on Caspr2 and TAG-1. The Journal of cell biology, 162(6), 1149-60. [PubMed:12963709] [PMC] [WorldCat] [DOI] - ↑ 44.0 44.1
Traka, M., Goutebroze, L., Denisenko, N., Bessa, M., Nifli, A., Havaki, S., ..., & Karagogeos, D. (2003).
Association of TAG-1 with Caspr2 is essential for the molecular organization of juxtaparanodal regions of myelinated fibers. The Journal of cell biology, 162(6), 1161-72. [PubMed:12975355] [PMC] [WorldCat] [DOI] - ↑
Bakkaloglu, B., O'Roak, B.J., Louvi, A., Gupta, A.R., Abelson, J.F., Morgan, T.M., ..., & State, M.W. (2008).
Molecular cytogenetic analysis and resequencing of contactin associated protein-like 2 in autism spectrum disorders. American journal of human genetics, 82(1), 165-73. [PubMed:18179895] [PMC] [WorldCat] [DOI] - ↑
Kasahara, K., Watanabe, K., Takeuchi, K., Kaneko, H., Oohira, A., Yamamoto, T., & Sanai, Y. (2000).
Involvement of gangliosides in glycosylphosphatidylinositol-anchored neuronal cell adhesion molecule TAG-1 signaling in lipid rafts. The Journal of biological chemistry, 275(44), 34701-9. [PubMed:10944523] [WorldCat] [DOI] - ↑
Kunz, S., Ziegler, U., Kunz, B., & Sonderegger, P. (1996).
Intracellular signaling is changed after clustering of the neural cell adhesion molecules axonin-1 and NgCAM during neurite fasciculation. The Journal of cell biology, 135(1), 253-67. [PubMed:8858178] [PMC] [WorldCat] [DOI] - ↑ 48.0 48.1
Fukamauchi, F., Aihara, O., Wang, Y.J., Akasaka, K., Takeda, Y., Horie, M., ..., & Iwakura, Y. (2001).
TAG-1-deficient mice have marked elevation of adenosine A1 receptors in the hippocampus. Biochemical and biophysical research communications, 281(1), 220-6. [PubMed:11178983] [WorldCat] [DOI] - ↑
Savvaki, M., Panagiotaropoulos, T., Stamatakis, A., Sargiannidou, I., Karatzioula, P., Watanabe, K., ..., & Kleopa, K.A. (2008).
Impairment of learning and memory in TAG-1 deficient mice associated with shorter CNS internodes and disrupted juxtaparanodes. Molecular and cellular neurosciences, 39(3), 478-90. [PubMed:18760366] [WorldCat] [DOI] - ↑
Chatzopoulou, E., Miguez, A., Savvaki, M., Levasseur, G., Muzerelle, A., Muriel, M.P., ..., & Thomas, J.L. (2008).
Structural requirement of TAG-1 for retinal ganglion cell axons and myelin in the mouse optic nerve. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(30), 7624-36. [PubMed:18650339] [PMC] [WorldCat] [DOI] - ↑
Bastakis, G.G., Savvaki, M., Stamatakis, A., Vidaki, M., & Karagogeos, D. (2015).
Tag1 deficiency results in olfactory dysfunction through impaired migration of mitral cells. Development (Cambridge, England), 142(24), 4318-28. [PubMed:26525675] [WorldCat] [DOI] - ↑
Buchner, D.A., Geisinger, J.M., Glazebrook, P.A., Morgan, M.G., Spiezio, S.H., Kaiyala, K.J., ..., & Nadeau, J.H. (2012).
The juxtaparanodal proteins CNTNAP2 and TAG1 regulate diet-induced obesity. Mammalian genome : official journal of the International Mammalian Genome Society, 23(7-8), 431-42. [PubMed:22752552] [PMC] [WorldCat] [DOI] - ↑
Kenwrick, S., Leversha, M., Rooke, L., Hasler, T., & Sonderegger, P. (1993).
Localization of the human TAX-1 gene to 1q32.1: a region implicated in microcephaly and Van der Woude syndrome. Human molecular genetics, 2(9), 1461-2. [PubMed:8242070] [WorldCat] [DOI] - ↑
Iijima, M., Tomita, M., Morozumi, S., Kawagashira, Y., Nakamura, T., Koike, H., ..., & Sobue, G. (2009).
Single nucleotide polymorphism of TAG-1 influences IVIg responsiveness of Japanese patients with CIDP. Neurology, 73(17), 1348-52. [PubMed:19776380] [WorldCat] [DOI] - ↑
Iijima, M., Koike, H., Katsuno, M., & Sobue, G. (2011).
Polymorphism of transient axonal glycoprotein-1 in chronic inflammatory demyelinating polyneuropathy. Journal of the peripheral nervous system : JPNS, 16 Suppl 1, 52-5. [PubMed:21696500] [WorldCat] [DOI] - ↑
Derfuss, T., Parikh, K., Velhin, S., Braun, M., Mathey, E., Krumbholz, M., ..., & Meinl, E. (2009).
Contactin-2/TAG-1-directed autoimmunity is identified in multiple sclerosis patients and mediates gray matter pathology in animals. Proceedings of the National Academy of Sciences of the United States of America, 106(20), 8302-7. [PubMed:19416878] [PMC] [WorldCat] [DOI] - ↑
Stogmann, E., Reinthaler, E., Eltawil, S., El Etribi, M.A., Hemeda, M., El Nahhas, N., ..., & Zimprich, A. (2013).
Autosomal recessive cortical myoclonic tremor and epilepsy: association with a mutation in the potassium channel associated gene CNTN2. Brain : a journal of neurology, 136(Pt 4), 1155-60. [PubMed:23518707] [WorldCat] [DOI]