「ROCK」の版間の差分
細編集の要約なし |
|||
| (2人の利用者による、間の7版が非表示) | |||
| 4行目: | 4行目: | ||
''<sup>2</sup> 長崎大学創薬研究教育センター''<br> | ''<sup>2</sup> 長崎大学創薬研究教育センター''<br> | ||
<sup>*</sup> equally contributed to this work<br> | <sup>*</sup> equally contributed to this work<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2016年4月21日 原稿完成日:2016年6月22日<br> | ||
担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | 担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | ||
</div> | </div> | ||
| 10行目: | 10行目: | ||
同義語:Rho-associated coiled-coil-containing protein kinase、Rhoキナーゼ (Rho-kinase, ROK) | 同義語:Rho-associated coiled-coil-containing protein kinase、Rhoキナーゼ (Rho-kinase, ROK) | ||
{{box|text= ROCKは活性型の低分子量GTP結合タンパク質Rhoにより活性化される分子量約160 kDaのセリン・スレオニンタンパク質リン酸化酵素であり、哺乳類にはROCK-IとROCK- | {{box|text= ROCKは活性型の低分子量GTP結合タンパク質Rhoにより活性化される分子量約160 kDaのセリン・スレオニンタンパク質リン酸化酵素であり、哺乳類にはROCK-IとROCK-IIの2つのアイソフォームが存在する。ROCKはミオシン軽鎖とミオシン軽鎖脱リン酸化酵素のリン酸化を介してミオシン軽鎖を活性型構造に変化させる。さらに、LIMキナーゼのリン酸化を介してアクチン脱重合因子であるコフィリンを不活化し、アクチン脱重合を抑制する。これらの作用が協調して、Rho依存的なアクトミオシン束の形成を促す。その他にもROCKは数多くの基質をリン酸化して、細胞運動、細胞極性、細胞接着、細胞分裂、アポトーシス、転写制御など多様な生命機能に関わる<ref name=ref1><pubmed>12778124</pubmed></ref> <ref name=ref2><pubmed>20803696</pubmed></ref>。神経系においても、発生・発達期における神経管形成、神経突起伸展制御、シナプス形成に加え、成体でのシナプス可塑性に至るまで幅広い役割を担う。}} | ||
{{GNF_Protein_box | {{GNF_Protein_box | ||
| 57行目: | 57行目: | ||
1985年に[[RhoA]]が新規の[[低分子量GTP結合タンパク質]]として同定されて以来、[[Rho]]を選択的に不活化する[[ボツリヌス菌]]由来の菌体外酵素[[ボツリヌス毒素#C3型|C3]]や、Rhoの[[活性化変異体]]や[[不活性化変異体]]を用いた解析により、[[アクチン]][[細胞骨格]]の再編成におけるRhoの重要性が示された<ref name=ref3><pubmed>12478284</pubmed></ref>。しかし当時はRhoの標的タンパク質は同定されておらず、Rhoの下流の細胞内情報伝達系は不明であった。GTP結合型(活性型)RhoAとの選択的結合を指標とした[[yeast two hybrid法]]、[[アフィニティー・クロマトグラフィー]]、[[リガンドオーバーレイ法]]などにより、Rho標的タンパク質が次々に同定された<ref name=ref4><pubmed>8889802</pubmed></ref> <ref name=ref5><pubmed>21235928</pubmed></ref>。 | 1985年に[[RhoA]]が新規の[[低分子量GTP結合タンパク質]]として同定されて以来、[[Rho]]を選択的に不活化する[[ボツリヌス菌]]由来の菌体外酵素[[ボツリヌス毒素#C3型|C3]]や、Rhoの[[活性化変異体]]や[[不活性化変異体]]を用いた解析により、[[アクチン]][[細胞骨格]]の再編成におけるRhoの重要性が示された<ref name=ref3><pubmed>12478284</pubmed></ref>。しかし当時はRhoの標的タンパク質は同定されておらず、Rhoの下流の細胞内情報伝達系は不明であった。GTP結合型(活性型)RhoAとの選択的結合を指標とした[[yeast two hybrid法]]、[[アフィニティー・クロマトグラフィー]]、[[リガンドオーバーレイ法]]などにより、Rho標的タンパク質が次々に同定された<ref name=ref4><pubmed>8889802</pubmed></ref> <ref name=ref5><pubmed>21235928</pubmed></ref>。 | ||
Rho-associated coiled-coil-containing protein | Rho-associated coiled-coil-containing protein kinase(ROCK)は、このように同定されたRho標的タンパク質の一つであり、活性型Rhoにより活性化される[[セリン]]・[[スレオニン]][[タンパク質リン酸化酵素]]である<ref name=ref6><pubmed>7493923</pubmed></ref> <ref name=ref7><pubmed>8641286</pubmed></ref> <ref name=ref8><pubmed>8617235</pubmed></ref>。 | ||
==ファミリー== | ==ファミリー== | ||
| 63行目: | 63行目: | ||
== 構造および活性化機構 == | == 構造および活性化機構 == | ||
[[ファイル: | [[ファイル:ROCK1.jpg|300px|サムネイル|右|'''図1. マウスのROCKアイソフォームのドメイン構造''']] | ||
どちらのアイソフォームもN末端側からキナーゼ領域、[[コイルド・コイル]]領域、Rho結合領域、[[PHドメイン|PH]]([[プレックスリン相同ドメイン|プレックスリン相同]] | |||
どちらのアイソフォームもN末端側からキナーゼ領域、[[コイルド・コイル]]領域、Rho結合領域、[[PHドメイン|PH]]([[プレックスリン相同ドメイン|プレックスリン相同]])領域、高システイン領域を有する(図1)。 | |||
ROCKのC末端領域にはROCKのキナーゼ活性を抑制する自己阻害領域が存在し、活性型RhoがROCKのRho結合領域に結合することでこの抑制が解除され、ROCKのキナーゼ活性が亢進する<ref name=ref16><pubmed>12954645</pubmed></ref>。ROCKはN末端領域同士で二量体を形成し、この二量体形成はROCKのキナーゼ活性に必須であると考えられている<ref name=ref17><pubmed>16249185</pubmed></ref> <ref name=ref18><pubmed>16531242</pubmed></ref>。 | |||
== 発現 == | == 発現 == | ||
| 71行目: | 74行目: | ||
==機能== | ==機能== | ||
=== 基質タンパク質 === | === 基質タンパク質 === | ||
ROCKは[[ミオシン軽鎖脱リン酸化酵素]](myosin light chain phosphatase; MLCP)をリン酸化してその酵素活性を抑制し、[[ミオシン軽鎖]](myosin light chain; | ROCKは[[ミオシン軽鎖脱リン酸化酵素]](myosin light chain phosphatase; MLCP)をリン酸化してその酵素活性を抑制し、[[ミオシン軽鎖]](myosin light chain; MLC)のリン酸化とそれによる活性型構造への変化を促す。またROCKはミオシン軽鎖を直接リン酸化し活性化することも知られる<ref name=ref9><pubmed>8662509</pubmed></ref> <ref name=ref10><pubmed>9353125</pubmed></ref>。 | ||
さらにROCKはリン酸化によりLIMキナーゼを活性化し、LIMキナーゼはアクチン脱重合因子[[コフィリン]]のリン酸化を促す<ref name=ref11><pubmed>10436159</pubmed></ref>。このリン酸化によりコフィリンは不活化されアクチン脱重合が阻害される。これらの作用が協調することで、ROCKはRho依存的な[[アクトミオシン]]束の形成に寄与し、細胞に収縮力を与える。その他、[[アデュシン]]、[[ERMタンパク質]]([[エズリン]]、[[ラディキシン]]、[[モイエシン]])、I型[[Na+-H+交換体|Na<sup>+</sup>-H<sup>+</sup>交換体]]、[[中間径フィラメント]]([[ビメンチン]]、[[グリア線維性酸性タンパク質]], [[ニューロフィラメント]])、[[微小管]]結合タンパク質([[MAP2]], [[タウタンパク質]])、[[コラプシン反応媒介タンパク質2]]([[CRMP2]])、[[Par3]]などがROCKの基質の候補分子として同定されている<ref name=ref1 /> <ref name=ref2 /> <ref name=ref12><pubmed>17901255</pubmed></ref>。特にROCKによる[[CRMP2]]リン酸化が[[微小管]]制御を介し[[エフリンA5]]による神経突起退縮を促すこと<ref name=ref13><pubmed>16260611</pubmed></ref>、ROCKによるPar3リン酸化が遊走細胞の[[前後軸]]形成を促すこと<ref name=ref14><pubmed>18267089</pubmed></ref>などが示されている。 | さらにROCKはリン酸化によりLIMキナーゼを活性化し、LIMキナーゼはアクチン脱重合因子[[コフィリン]]のリン酸化を促す<ref name=ref11><pubmed>10436159</pubmed></ref>。このリン酸化によりコフィリンは不活化されアクチン脱重合が阻害される。これらの作用が協調することで、ROCKはRho依存的な[[アクトミオシン]]束の形成に寄与し、細胞に収縮力を与える。その他、[[アデュシン]]、[[ERMタンパク質]]([[エズリン]]、[[ラディキシン]]、[[モイエシン]])、I型[[Na+-H+交換体|Na<sup>+</sup>-H<sup>+</sup>交換体]]、[[中間径フィラメント]]([[ビメンチン]]、[[グリア線維性酸性タンパク質]], [[ニューロフィラメント]])、[[微小管]]結合タンパク質([[MAP2]], [[タウタンパク質]])、[[コラプシン反応媒介タンパク質2]]([[CRMP2]])、[[Par3]]などがROCKの基質の候補分子として同定されている<ref name=ref1 /> <ref name=ref2 /> <ref name=ref12><pubmed>17901255</pubmed></ref>。特にROCKによる[[CRMP2]]リン酸化が[[微小管]]制御を介し[[エフリンA5]]による神経突起退縮を促すこと<ref name=ref13><pubmed>16260611</pubmed></ref>、ROCKによるPar3リン酸化が遊走細胞の[[前後軸]]形成を促すこと<ref name=ref14><pubmed>18267089</pubmed></ref>などが示されている。 | ||
===神経系での機能=== | ===神経系での機能=== | ||
====神経管形成==== | ====神経管形成==== | ||
[[神経管]]は外胚葉に由来する[[神経板]]が背側方向に閉鎖することで形成されるが、この過程には神経板を構成する[[神経上皮細胞]]の頂端側での[[アクトミオシン]]収縮力が必要である。神経上皮細胞の頂端側で見られるミオシン軽鎖のリン酸化がROCK-IとROCK-IIの阻害薬である[[ | [[神経管]]は外胚葉に由来する[[神経板]]が背側方向に閉鎖することで形成されるが、この過程には神経板を構成する[[神経上皮細胞]]の頂端側での[[アクトミオシン]]収縮力が必要である。神経上皮細胞の頂端側で見られるミオシン軽鎖のリン酸化がROCK-IとROCK-IIの阻害薬である[[Y-27632]]<ref name=ref10 />により消失すること<ref name=ref21 />、さらにY-27632や[[ミオシンII]]の特異的[[阻害薬]]である[[ブレビスタチン]]がトリやマウスの胚の神経管閉鎖を阻害することが示された<ref name=ref21><pubmed>26040287</pubmed></ref> <ref name=ref22><pubmed>11532918</pubmed></ref>。以上の結果は、ROCKによるアクトミオシン収縮が神経管閉鎖に重要であることを示唆している。さらなる研究により、[[アダプタータンパク質]][[Shroom3]]により神経管内腔側(神経上皮細胞の頂端側に相当する)にROCKが局在化し、さらに[[PDZ-RhoGEF]]により活性化されたRhoがROCKを活性化することが示されている<ref name=ref23><pubmed>18339671</pubmed></ref> <ref name=ref24><pubmed>22632972</pubmed></ref>。 | ||
====神経突起の伸展==== | ====神経突起の伸展==== | ||
[[ファイル:rock2.jpg|300px|サムネイル|右|'''図2. 神経突起伸展開始制御におけるRho-ROCKシグナル経路の関与''']] | |||
[[ファイル:ROCK3.jpg|300px|サムネイル|右|'''図3. EphAによる軸索退縮へのRho-ROCKシグナル経路の関与''']] | |||
神経突起の形成と伸展は、突起先端の[[成長円錐]]でのアクチン細胞骨格の再編成と、それに引き続く微小管の配向、安定化から成る。成長円錐は高い運動性を持った扇形の構造であり、[[軸索ガイダンス]]因子による軸索の伸長や退縮、さらに軸索伸長の方向の制御に深く関わる(''詳細は[[成長円錐]]の項目参照'')。 | 神経突起の形成と伸展は、突起先端の[[成長円錐]]でのアクチン細胞骨格の再編成と、それに引き続く微小管の配向、安定化から成る。成長円錐は高い運動性を持った扇形の構造であり、[[軸索ガイダンス]]因子による軸索の伸長や退縮、さらに軸索伸長の方向の制御に深く関わる(''詳細は[[成長円錐]]の項目参照'')。 | ||
ROCK阻害薬Y-27632やミオシン阻害薬ブレビスタチンを用いた実験から、[[アメフラシ]]の成長円錐でのアクチン動態やアクトミオシン束の形成にROCKによる[[ミオシン]]活性化が重要であることが示されている<ref name=ref25><pubmed>14659092</pubmed></ref> <ref name=ref26><pubmed>16501565</pubmed></ref>。さらに、[[げっ歯類]]の[[初代培養神経]]細胞では、神経突起の伸展がROCK阻害薬Y-27632により促進し、ROCKの活性化変異体により抑制されることから、ROCKの活性化が神経突起の伸展を抑制することが明らかとなった<ref name=ref27><pubmed>15630019</pubmed></ref>。小脳顆粒細胞ではROCKが神経突起の伸展の開始を抑制し神経突起の数を決定すること、その過程にRho-ROCK- | ROCK阻害薬Y-27632やミオシン阻害薬ブレビスタチンを用いた実験から、[[アメフラシ]]の成長円錐でのアクチン動態やアクトミオシン束の形成にROCKによる[[ミオシン]]活性化が重要であることが示されている<ref name=ref25><pubmed>14659092</pubmed></ref> <ref name=ref26><pubmed>16501565</pubmed></ref>。さらに、[[げっ歯類]]の[[初代培養神経]]細胞では、神経突起の伸展がROCK阻害薬Y-27632により促進し、ROCKの活性化変異体により抑制されることから、ROCKの活性化が神経突起の伸展を抑制することが明らかとなった<ref name=ref27><pubmed>15630019</pubmed></ref>。小脳顆粒細胞ではROCKが神経突起の伸展の開始を抑制し神経突起の数を決定すること、その過程にRho-ROCK-LIMキナーゼ経路によるアクチン脱重合抑制が重要であることが示された(図2)<ref name=ref28><pubmed>10839361</pubmed></ref>。さらにROCKは軸索ガイダンス因子であるエフリンA5による軸索退縮に重要である(図3)。エフリンA5はEphAに結合し、Rhoグアニンヌクレオチド交換因子GEFである[[エフェキシン]]を介してRhoを活性化する<ref name=ref29><pubmed>11336673</pubmed></ref>。Rhoにより活性化されたROCKは、アクトミオシン束を形成するとともに、CRMP-2による微小管重合を抑制する<ref name=ref13 />。[[CRMP-2]]は[[チュブリン]]二量体に結合して微小管形成を促進するタンパク質であり、ROCKによるリン酸化はその機能を抑制する。また、RhoAの活性化変異体やリゾホスファチジン酸(LPA)によるRhoの活性化は、樹状突起の複雑さを減少させる<ref name=ref30><pubmed>10884317</pubmed></ref>。この樹状突起の単純化は、ROCK阻害薬Y-27632で抑制され、ROCKの活性化変異体により[[模倣]]されることから、Rho-ROCK経路は樹状突起の枝分かれを抑制すると考えられている。 | ||
[[軸索再生]]においてもROCKは抑制的に働く。[[脊髄損傷]]後の軸索再生は、[[myelin-associated glycoprotein]]([[MAG]])、[[Nogo-A]] | [[軸索再生]]においてもROCKは抑制的に働く。[[脊髄損傷]]後の軸索再生は、[[myelin-associated glycoprotein]]([[MAG]])、[[Nogo-A]]、[[コンドロイチン硫酸プロテオグリカン]]([[CSPGs]])、[[oligodendrocyte myelin glycoprotein]]([[OMgp]])などの[[ミエリン]]および[[オリゴデンドロサイト]]由来の軸索伸展抑制因子により阻害される。これらの抑制因子の作用はROCK阻害薬Y-27632により抑制される<ref name=ref31><pubmed>25374504</pubmed></ref>。さらにROCK-II欠損マウス由来の後根神経節細胞では、Nogo-22やCSPGsによる軸索伸展抑制作用が減弱することから<ref name=ref32><pubmed>19955379</pubmed></ref>、これらの軸索伸展抑制因子の作用にはROCK-IIが必須である。興味深いことに、ROCKII欠損マウスでは、脊髄損傷後の軸索再生が促進されることも報告されており<ref name=ref32 />、脊髄損傷の治療薬としてのROCK阻害薬の可能性が検討されている<ref name=ref33><pubmed>23298675</pubmed></ref>。 | ||
====シナプス形成とシナプス可塑性==== | ====シナプス形成とシナプス可塑性==== | ||
2016年6月22日 (水) 21:37時点における最新版
篠原 亮太1*、出口 雄一2*、古屋敷 智之1
1 神戸大学大学院医学研究科薬理学分野
2 長崎大学創薬研究教育センター
* equally contributed to this work
DOI:10.14931/bsd.7077 原稿受付日:2016年4月21日 原稿完成日:2016年6月22日
担当編集委員:柚崎 通介(慶應義塾大学 医学部生理学)
同義語:Rho-associated coiled-coil-containing protein kinase、Rhoキナーゼ (Rho-kinase, ROK)
ROCKは活性型の低分子量GTP結合タンパク質Rhoにより活性化される分子量約160 kDaのセリン・スレオニンタンパク質リン酸化酵素であり、哺乳類にはROCK-IとROCK-IIの2つのアイソフォームが存在する。ROCKはミオシン軽鎖とミオシン軽鎖脱リン酸化酵素のリン酸化を介してミオシン軽鎖を活性型構造に変化させる。さらに、LIMキナーゼのリン酸化を介してアクチン脱重合因子であるコフィリンを不活化し、アクチン脱重合を抑制する。これらの作用が協調して、Rho依存的なアクトミオシン束の形成を促す。その他にもROCKは数多くの基質をリン酸化して、細胞運動、細胞極性、細胞接着、細胞分裂、アポトーシス、転写制御など多様な生命機能に関わる[1] [2]。神経系においても、発生・発達期における神経管形成、神経突起伸展制御、シナプス形成に加え、成体でのシナプス可塑性に至るまで幅広い役割を担う。
はじめに
1985年にRhoAが新規の低分子量GTP結合タンパク質として同定されて以来、Rhoを選択的に不活化するボツリヌス菌由来の菌体外酵素C3や、Rhoの活性化変異体や不活性化変異体を用いた解析により、アクチン細胞骨格の再編成におけるRhoの重要性が示された[3]。しかし当時はRhoの標的タンパク質は同定されておらず、Rhoの下流の細胞内情報伝達系は不明であった。GTP結合型(活性型)RhoAとの選択的結合を指標としたyeast two hybrid法、アフィニティー・クロマトグラフィー、リガンドオーバーレイ法などにより、Rho標的タンパク質が次々に同定された[4] [5]。
Rho-associated coiled-coil-containing protein kinase(ROCK)は、このように同定されたRho標的タンパク質の一つであり、活性型Rhoにより活性化されるセリン・スレオニンタンパク質リン酸化酵素である[6] [7] [8]。
ファミリー
マウスには1354アミノ酸のROCK-I(ROKβ, p160ROCK)と1388アミノ酸のROCK-II(ROKα, Rho-kinase)の2つのアイソフォームが存在する。ROCK-IとROCK-IIはアミノ酸配列全体で65%の相同性を有しており、キナーゼ領域では約92%の相同性を示す[9]。
構造および活性化機構
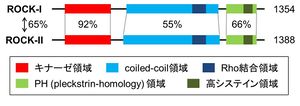
どちらのアイソフォームもN末端側からキナーゼ領域、コイルド・コイル領域、Rho結合領域、PH(プレックスリン相同)領域、高システイン領域を有する(図1)。
ROCKのC末端領域にはROCKのキナーゼ活性を抑制する自己阻害領域が存在し、活性型RhoがROCKのRho結合領域に結合することでこの抑制が解除され、ROCKのキナーゼ活性が亢進する[10]。ROCKはN末端領域同士で二量体を形成し、この二量体形成はROCKのキナーゼ活性に必須であると考えられている[11] [12]。
発現
ESTデータベースを用いた解析から、数多くの臓器ではROCK-IとROCK-IIの両方が発現している。しかし、ROCK-Iは脾臓、胸腺、精巣、血液などに発現が高く、ROCK-IIは脳、大腸、心臓などに高発現していることが報告されている[13]。平滑筋細胞において、ROCK-Iは細胞膜や細胞膜近傍の小胞に、ROCK-IIは中心体に局在することが報告されており、同一細胞内においてもアイソフォーム間での細胞内局在の違いが示唆されている20。脳内では、ROCK-Iは主にグリア細胞や血管に発現し、ROCK-IIは主に神経細胞に発現している。ROCK-IIについては、神経細胞の成長円錐、軸索、シナプス前終末、スパインでの局在が免疫電子顕微鏡法により確認されている[14]。
機能
基質タンパク質
ROCKはミオシン軽鎖脱リン酸化酵素(myosin light chain phosphatase; MLCP)をリン酸化してその酵素活性を抑制し、ミオシン軽鎖(myosin light chain; MLC)のリン酸化とそれによる活性型構造への変化を促す。またROCKはミオシン軽鎖を直接リン酸化し活性化することも知られる[15] [16]。
さらにROCKはリン酸化によりLIMキナーゼを活性化し、LIMキナーゼはアクチン脱重合因子コフィリンのリン酸化を促す[17]。このリン酸化によりコフィリンは不活化されアクチン脱重合が阻害される。これらの作用が協調することで、ROCKはRho依存的なアクトミオシン束の形成に寄与し、細胞に収縮力を与える。その他、アデュシン、ERMタンパク質(エズリン、ラディキシン、モイエシン)、I型Na+-H+交換体、中間径フィラメント(ビメンチン、グリア線維性酸性タンパク質, ニューロフィラメント)、微小管結合タンパク質(MAP2, タウタンパク質)、コラプシン反応媒介タンパク質2(CRMP2)、Par3などがROCKの基質の候補分子として同定されている[1] [2] [18]。特にROCKによるCRMP2リン酸化が微小管制御を介しエフリンA5による神経突起退縮を促すこと[19]、ROCKによるPar3リン酸化が遊走細胞の前後軸形成を促すこと[20]などが示されている。
神経系での機能
神経管形成
神経管は外胚葉に由来する神経板が背側方向に閉鎖することで形成されるが、この過程には神経板を構成する神経上皮細胞の頂端側でのアクトミオシン収縮力が必要である。神経上皮細胞の頂端側で見られるミオシン軽鎖のリン酸化がROCK-IとROCK-IIの阻害薬であるY-27632[16]により消失すること[21]、さらにY-27632やミオシンIIの特異的阻害薬であるブレビスタチンがトリやマウスの胚の神経管閉鎖を阻害することが示された[21] [22]。以上の結果は、ROCKによるアクトミオシン収縮が神経管閉鎖に重要であることを示唆している。さらなる研究により、アダプタータンパク質Shroom3により神経管内腔側(神経上皮細胞の頂端側に相当する)にROCKが局在化し、さらにPDZ-RhoGEFにより活性化されたRhoがROCKを活性化することが示されている[23] [24]。
神経突起の伸展
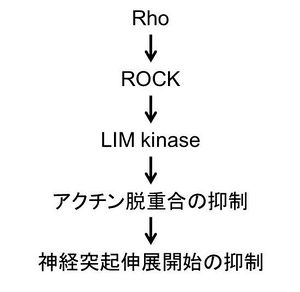
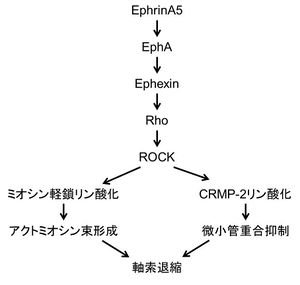
神経突起の形成と伸展は、突起先端の成長円錐でのアクチン細胞骨格の再編成と、それに引き続く微小管の配向、安定化から成る。成長円錐は高い運動性を持った扇形の構造であり、軸索ガイダンス因子による軸索の伸長や退縮、さらに軸索伸長の方向の制御に深く関わる(詳細は成長円錐の項目参照)。
ROCK阻害薬Y-27632やミオシン阻害薬ブレビスタチンを用いた実験から、アメフラシの成長円錐でのアクチン動態やアクトミオシン束の形成にROCKによるミオシン活性化が重要であることが示されている[25] [26]。さらに、げっ歯類の初代培養神経細胞では、神経突起の伸展がROCK阻害薬Y-27632により促進し、ROCKの活性化変異体により抑制されることから、ROCKの活性化が神経突起の伸展を抑制することが明らかとなった[27]。小脳顆粒細胞ではROCKが神経突起の伸展の開始を抑制し神経突起の数を決定すること、その過程にRho-ROCK-LIMキナーゼ経路によるアクチン脱重合抑制が重要であることが示された(図2)[28]。さらにROCKは軸索ガイダンス因子であるエフリンA5による軸索退縮に重要である(図3)。エフリンA5はEphAに結合し、Rhoグアニンヌクレオチド交換因子GEFであるエフェキシンを介してRhoを活性化する[29]。Rhoにより活性化されたROCKは、アクトミオシン束を形成するとともに、CRMP-2による微小管重合を抑制する[19]。CRMP-2はチュブリン二量体に結合して微小管形成を促進するタンパク質であり、ROCKによるリン酸化はその機能を抑制する。また、RhoAの活性化変異体やリゾホスファチジン酸(LPA)によるRhoの活性化は、樹状突起の複雑さを減少させる[30]。この樹状突起の単純化は、ROCK阻害薬Y-27632で抑制され、ROCKの活性化変異体により模倣されることから、Rho-ROCK経路は樹状突起の枝分かれを抑制すると考えられている。
軸索再生においてもROCKは抑制的に働く。脊髄損傷後の軸索再生は、myelin-associated glycoprotein(MAG)、Nogo-A、コンドロイチン硫酸プロテオグリカン(CSPGs)、oligodendrocyte myelin glycoprotein(OMgp)などのミエリンおよびオリゴデンドロサイト由来の軸索伸展抑制因子により阻害される。これらの抑制因子の作用はROCK阻害薬Y-27632により抑制される[31]。さらにROCK-II欠損マウス由来の後根神経節細胞では、Nogo-22やCSPGsによる軸索伸展抑制作用が減弱することから[32]、これらの軸索伸展抑制因子の作用にはROCK-IIが必須である。興味深いことに、ROCKII欠損マウスでは、脊髄損傷後の軸索再生が促進されることも報告されており[32]、脊髄損傷の治療薬としてのROCK阻害薬の可能性が検討されている[33]。
シナプス形成とシナプス可塑性
樹状突起スパインは、神経細胞の樹状突起から突き出たアクチン細胞骨格に富む小さな突起であり、中枢神経系の主な興奮性シナプス入力部位である。スパインの形態変化はアクチン再構築に依存することから、ROCKの関与について興味が持たれてきた。スライス培養した海馬CA1の錐体神経細胞では、ROCK阻害薬Y-27632によりスパインの長さが増大し、スパインの運動性が亢進する[34]。海馬初代培養神経細胞では、ミオシンIIB阻害薬ブレビスタチンの処理やRNA干渉法によるミオシンIIbの発現抑制もスパインの長さの増大とスパインの運動性の亢進を引き起こす[35]。これらの結果から、ROCKはミオシンIIbを活性化してスパインの安定化を促すと考えられている。
海馬スライスのCA1錐体神経細胞での実験では、スパインの大きさとAMPA型グルタミン酸受容体を介したシナプス後電流が相関する[36]。さらにスパインは長期増強(long-term potentiation)に伴い増大し、長期抑圧(long-term depression)に伴い縮小することから、シナプス可塑性におけるスパインの形態変化の意義が示唆されてきた[37] [38]。グルタミン酸受容体の局所的な活性化によりスパインの増大が誘導されるが、このスパイン増大の初期相がRhoの活性阻害や発現抑制、ROCK阻害薬Glycyl-H-1152により抑制されることが示された。さらに、グルタミン酸受容体活性化によるスパインでのRhoAの活性化はCaMKII阻害薬で減弱した。これらの結果から、グルタミン酸受容体はCaMKIIを介してRho-ROCK経路を活性化しスパイン増大を誘導すると考えられている[39]。
このRho-ROCK経路の役割に合致し、ROCK-II欠損マウスでは海馬のシャッファー側枝とCA1錐体細胞の間のグルタミン酸作動性シナプス伝達の長期増強が減弱している[40]。海馬スライス培養では、シナプス活動やNMDA受容体刺激はROCK依存的にスパインにおけるミオシン軽鎖リン酸化を誘導する。さらにシャッファー側枝-CA1シナプスでのシナプス伝達の長期増強がミオシンIIbの発現抑制やミオシンII阻害薬ブレビスタチンの処理により減弱する[41]。これらの結果は、グルタミン酸受容体による長期増強にRho-ROCK経路を介したアクトミオシン束形成が重要であることを示唆している。
神経活動に影響を与えるその他のROCKの働きも示唆されているが、その詳細については不明な点が多い。例えば、脳幹スライス培養を用いた実験では、ROCK阻害薬H1152によりシナプス前終末のアクティブゾーンへのシナプス小胞のドッキングが抑制される[42]。リゾホスファチジン酸 (LPA)により活性化したROCKがT型カルシウムチャネルをリン酸化し、Cav3.1を抑制し、Cav3.2を促進することも報告されている[43]。
記憶・学習におけるROCKの役割についても報告されている。恐怖条件づけ直前の外側扁桃体へのROCK阻害薬Y-27632の局所注入では、短期記憶は保持されるものの長期記憶の形成が阻害される[44]。モリス水迷路試験を用いた研究では、学習後の海馬へのROCK阻害薬Y-27632の局所注入が空間記憶の保持を低下させることが報告されている[45]。しかし、記憶・学習を担うシナプス可塑性やそれに伴うスパインの形態変化にROCKが関与するかについては今後の課題である。
関連項目
参考文献
- ↑ 1.0 1.1
Riento, K., & Ridley, A.J. (2003).
Rocks: multifunctional kinases in cell behaviour. Nature reviews. Molecular cell biology, 4(6), 446-56. [PubMed:12778124] [WorldCat] [DOI] - ↑ 2.0 2.1
Amano, M., Nakayama, M., & Kaibuchi, K. (2010).
Rho-kinase/ROCK: A key regulator of the cytoskeleton and cell polarity. Cytoskeleton (Hoboken, N.J.), 67(9), 545-54. [PubMed:20803696] [PMC] [WorldCat] [DOI] - ↑
Etienne-Manneville, S., & Hall, A. (2002).
Rho GTPases in cell biology. Nature, 420(6916), 629-35. [PubMed:12478284] [WorldCat] [DOI] - ↑
Narumiya, S. (1996).
The small GTPase Rho: cellular functions and signal transduction. Journal of biochemistry, 120(2), 215-28. [PubMed:8889802] [WorldCat] [DOI] - ↑
Amano, M., Fukata, Y., & Kaibuchi, K. (1998).
Regulation of Cytoskeleton and Cell Adhesions by the Small GTPase Rho and Its Targets. Trends in cardiovascular medicine, 8(4), 162-8. [PubMed:21235928] [WorldCat] [DOI] - ↑
Leung, T., Manser, E., Tan, L., & Lim, L. (1995).
A novel serine/threonine kinase binding the Ras-related RhoA GTPase which translocates the kinase to peripheral membranes. The Journal of biological chemistry, 270(49), 29051-4. [PubMed:7493923] [WorldCat] [DOI] - ↑
Matsui, T., Amano, M., Yamamoto, T., Chihara, K., Nakafuku, M., Ito, M., ..., & Kaibuchi, K. (1996).
Rho-associated kinase, a novel serine/threonine kinase, as a putative target for small GTP binding protein Rho. The EMBO journal, 15(9), 2208-16. [PubMed:8641286] [PMC] [WorldCat] - ↑
Ishizaki, T., Maekawa, M., Fujisawa, K., Okawa, K., Iwamatsu, A., Fujita, A., ..., & Narumiya, S. (1996).
The small GTP-binding protein Rho binds to and activates a 160 kDa Ser/Thr protein kinase homologous to myotonic dystrophy kinase. The EMBO journal, 15(8), 1885-93. [PubMed:8617235] [PMC] [WorldCat] - ↑
Nakagawa, O., Fujisawa, K., Ishizaki, T., Saito, Y., Nakao, K., & Narumiya, S. (1996).
ROCK-I and ROCK-II, two isoforms of Rho-associated coiled-coil forming protein serine/threonine kinase in mice. FEBS letters, 392(2), 189-93. [PubMed:8772201] [WorldCat] [DOI] - ↑
Shimizu, T., Ihara, K., Maesaki, R., Amano, M., Kaibuchi, K., & Hakoshima, T. (2003).
Parallel coiled-coil association of the RhoA-binding domain in Rho-kinase. The Journal of biological chemistry, 278(46), 46046-51. [PubMed:12954645] [WorldCat] [DOI] - ↑
Jacobs, M., Hayakawa, K., Swenson, L., Bellon, S., Fleming, M., Taslimi, P., & Doran, J. (2006).
The structure of dimeric ROCK I reveals the mechanism for ligand selectivity. The Journal of biological chemistry, 281(1), 260-8. [PubMed:16249185] [WorldCat] [DOI] - ↑
Yamaguchi, H., Kasa, M., Amano, M., Kaibuchi, K., & Hakoshima, T. (2006).
Molecular mechanism for the regulation of rho-kinase by dimerization and its inhibition by fasudil. Structure (London, England : 1993), 14(3), 589-600. [PubMed:16531242] [WorldCat] [DOI] - ↑
Julian, L., & Olson, M.F. (2014).
Rho-associated coiled-coil containing kinases (ROCK): structure, regulation, and functions. Small GTPases, 5, e29846. [PubMed:25010901] [PMC] [WorldCat] [DOI] - ↑
Iizuka, M., Kimura, K., Wang, S., Kato, K., Amano, M., Kaibuchi, K., & Mizoguchi, A. (2012).
Distinct distribution and localization of Rho-kinase in mouse epithelial, muscle and neural tissues. Cell structure and function, 37(2), 155-75. [PubMed:22986902] [WorldCat] [DOI] - ↑
Kimura, K., Ito, M., Amano, M., Chihara, K., Fukata, Y., Nakafuku, M., ..., & Kaibuchi, K. (1996).
Regulation of myosin phosphatase by Rho and Rho-associated kinase (Rho-kinase) Science (New York, N.Y.), 273(5272), 245-8. [PubMed:8662509] [WorldCat] [DOI] - ↑ 16.0 16.1
Uehata, M., Ishizaki, T., Satoh, H., Ono, T., Kawahara, T., Morishita, T., ..., & Narumiya, S. (1997).
Calcium sensitization of smooth muscle mediated by a Rho-associated protein kinase in hypertension. Nature, 389(6654), 990-4. [PubMed:9353125] [WorldCat] [DOI] - ↑
Maekawa, M., Ishizaki, T., Boku, S., Watanabe, N., Fujita, A., Iwamatsu, A., ..., & Narumiya, S. (1999).
Signaling from Rho to the actin cytoskeleton through protein kinases ROCK and LIM-kinase. Science (New York, N.Y.), 285(5429), 895-8. [PubMed:10436159] [WorldCat] [DOI] - ↑
Schmandke, A., Schmandke, A., & Strittmatter, S.M. (2007).
ROCK and Rho: biochemistry and neuronal functions of Rho-associated protein kinases. The Neuroscientist : a review journal bringing neurobiology, neurology and psychiatry, 13(5), 454-69. [PubMed:17901255] [PMC] [WorldCat] [DOI] - ↑ 19.0 19.1
Arimura, N., Ménager, C., Kawano, Y., Yoshimura, T., Kawabata, S., Hattori, A., ..., & Kaibuchi, K. (2005).
Phosphorylation by Rho kinase regulates CRMP-2 activity in growth cones. Molecular and cellular biology, 25(22), 9973-84. [PubMed:16260611] [PMC] [WorldCat] [DOI] - ↑
Nakayama, M., Goto, T.M., Sugimoto, M., Nishimura, T., Shinagawa, T., Ohno, S., ..., & Kaibuchi, K. (2008).
Rho-kinase phosphorylates PAR-3 and disrupts PAR complex formation. Developmental cell, 14(2), 205-15. [PubMed:18267089] [WorldCat] [DOI] - ↑ 21.0 21.1
Escuin, S., Vernay, B., Savery, D., Gurniak, C.B., Witke, W., Greene, N.D., & Copp, A.J. (2015).
Rho-kinase-dependent actin turnover and actomyosin disassembly are necessary for mouse spinal neural tube closure. Journal of cell science, 128(14), 2468-81. [PubMed:26040287] [PMC] [WorldCat] [DOI] - ↑
Wei, L., Roberts, W., Wang, L., Yamada, M., Zhang, S., Zhao, Z., ..., & Imanaka-Yoshida, K. (2001).
Rho kinases play an obligatory role in vertebrate embryonic organogenesis. Development (Cambridge, England), 128(15), 2953-62. [PubMed:11532918] [WorldCat] - ↑
Nishimura, T., & Takeichi, M. (2008).
Shroom3-mediated recruitment of Rho kinases to the apical cell junctions regulates epithelial and neuroepithelial planar remodeling. Development (Cambridge, England), 135(8), 1493-502. [PubMed:18339671] [WorldCat] [DOI] - ↑
Nishimura, T., Honda, H., & Takeichi, M. (2012).
Planar cell polarity links axes of spatial dynamics in neural-tube closure. Cell, 149(5), 1084-97. [PubMed:22632972] [WorldCat] [DOI] - ↑
Zhang, X.F., Schaefer, A.W., Burnette, D.T., Schoonderwoert, V.T., & Forscher, P. (2003).
Rho-dependent contractile responses in the neuronal growth cone are independent of classical peripheral retrograde actin flow. Neuron, 40(5), 931-44. [PubMed:14659092] [WorldCat] [DOI] - ↑
Medeiros, N.A., Burnette, D.T., & Forscher, P. (2006).
Myosin II functions in actin-bundle turnover in neuronal growth cones. Nature cell biology, 8(3), 215-26. [PubMed:16501565] [WorldCat] [DOI] - ↑
Govek, E.E., Newey, S.E., & Van Aelst, L. (2005).
The role of the Rho GTPases in neuronal development. Genes & development, 19(1), 1-49. [PubMed:15630019] [WorldCat] [DOI] - ↑
Bito, H., Furuyashiki, T., Ishihara, H., Shibasaki, Y., Ohashi, K., Mizuno, K., ..., & Narumiya, S. (2000).
A critical role for a Rho-associated kinase, p160ROCK, in determining axon outgrowth in mammalian CNS neurons. Neuron, 26(2), 431-41. [PubMed:10839361] [WorldCat] [DOI] - ↑
Shamah, S.M., Lin, M.Z., Goldberg, J.L., Estrach, S., Sahin, M., Hu, L., ..., & Greenberg, M.E. (2001).
EphA receptors regulate growth cone dynamics through the novel guanine nucleotide exchange factor ephexin. Cell, 105(2), 233-44. [PubMed:11336673] [WorldCat] [DOI] - ↑
Nakayama, A.Y., Harms, M.B., & Luo, L. (2000).
Small GTPases Rac and Rho in the maintenance of dendritic spines and branches in hippocampal pyramidal neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 20(14), 5329-38. [PubMed:10884317] [PMC] [WorldCat] - ↑
Fujita, Y., & Yamashita, T. (2014).
Axon growth inhibition by RhoA/ROCK in the central nervous system. Frontiers in neuroscience, 8, 338. [PubMed:25374504] [PMC] [WorldCat] [DOI] - ↑ 32.0 32.1
Duffy, P., Schmandke, A., Schmandke, A., Sigworth, J., Narumiya, S., Cafferty, W.B., & Strittmatter, S.M. (2009).
Rho-associated kinase II (ROCKII) limits axonal growth after trauma within the adult mouse spinal cord. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(48), 15266-76. [PubMed:19955379] [PMC] [WorldCat] [DOI] - ↑
Forgione, N., & Fehlings, M.G. (2013).
Rho-ROCK inhibition in the treatment of spinal cord injury. World neurosurgery, 82(3-4), e535-9. [PubMed:23298675] [WorldCat] [DOI] - ↑
Tashiro, A., & Yuste, R. (2004).
Regulation of dendritic spine motility and stability by Rac1 and Rho kinase: evidence for two forms of spine motility. Molecular and cellular neurosciences, 26(3), 429-40. [PubMed:15234347] [WorldCat] [DOI] - ↑
Ryu, J., Liu, L., Wong, T.P., Wu, D.C., Burette, A., Weinberg, R., ..., & Sheng, M. (2006).
A critical role for myosin IIb in dendritic spine morphology and synaptic function. Neuron, 49(2), 175-82. [PubMed:16423692] [WorldCat] [DOI] - ↑
Matsuzaki, M., Ellis-Davies, G.C., Nemoto, T., Miyashita, Y., Iino, M., & Kasai, H. (2001).
Dendritic spine geometry is critical for AMPA receptor expression in hippocampal CA1 pyramidal neurons. Nature neuroscience, 4(11), 1086-92. [PubMed:11687814] [PMC] [WorldCat] [DOI] - ↑
Matsuzaki, M., Honkura, N., Ellis-Davies, G.C., & Kasai, H. (2004).
Structural basis of long-term potentiation in single dendritic spines. Nature, 429(6993), 761-6. [PubMed:15190253] [PMC] [WorldCat] [DOI] - ↑
Okamoto, K., Nagai, T., Miyawaki, A., & Hayashi, Y. (2004).
Rapid and persistent modulation of actin dynamics regulates postsynaptic reorganization underlying bidirectional plasticity. Nature neuroscience, 7(10), 1104-12. [PubMed:15361876] [WorldCat] [DOI] - ↑
Murakoshi, H., Wang, H., & Yasuda, R. (2011).
Local, persistent activation of Rho GTPases during plasticity of single dendritic spines. Nature, 472(7341), 100-4. [PubMed:21423166] [PMC] [WorldCat] [DOI] - ↑
Zhou, Z., Meng, Y., Asrar, S., Todorovski, Z., & Jia, Z. (2009).
A critical role of Rho-kinase ROCK2 in the regulation of spine and synaptic function. Neuropharmacology, 56(1), 81-9. [PubMed:18718479] [WorldCat] [DOI] - ↑
Rex, C.S., Gavin, C.F., Rubio, M.D., Kramar, E.A., Chen, L.Y., Jia, Y., ..., & Rumbaugh, G. (2010).
Myosin IIb regulates actin dynamics during synaptic plasticity and memory formation. Neuron, 67(4), 603-17. [PubMed:20797537] [PMC] [WorldCat] [DOI] - ↑
González-Forero, D., Montero, F., García-Morales, V., Domínguez, G., Gómez-Pérez, L., García-Verdugo, J.M., & Moreno-López, B. (2012).
Endogenous Rho-kinase signaling maintains synaptic strength by stabilizing the size of the readily releasable pool of synaptic vesicles. The Journal of neuroscience : the official journal of the Society for Neuroscience, 32(1), 68-84. [PubMed:22219271] [PMC] [WorldCat] [DOI] - ↑
Iftinca, M., Hamid, J., Chen, L., Varela, D., Tadayonnejad, R., Altier, C., ..., & Zamponi, G.W. (2007).
Regulation of T-type calcium channels by Rho-associated kinase. Nature neuroscience, 10(7), 854-60. [PubMed:17558400] [WorldCat] [DOI] - ↑
Lamprecht, R., Farb, C.R., & LeDoux, J.E. (2002).
Fear memory formation involves p190 RhoGAP and ROCK proteins through a GRB2-mediated complex. Neuron, 36(4), 727-38. [PubMed:12441060] [WorldCat] [DOI] - ↑
Dash, P.K., Orsi, S.A., Moody, M., & Moore, A.N. (2004).
A role for hippocampal Rho-ROCK pathway in long-term spatial memory. Biochemical and biophysical research communications, 322(3), 893-8. [PubMed:15336547] [WorldCat] [DOI]