「メチル化CpG結合タンパク質2」の版間の差分
細 →疾患との関わり |
|||
| (同じ利用者による、間の17版が非表示) | |||
| 1行目: | 1行目: | ||
辻村啓太 | <div align="right"> | ||
元名古屋大学大学院理学研究科附属ニューロサイエンス研究センター・脳機能発達制御学グループ | <font size="+1">[https://researchmap.jp/tjmrkit 辻村啓太]</font><br> | ||
''元名古屋大学大学院理学研究科附属ニューロサイエンス研究センター・脳機能発達制御学グループ''<br> | |||
''レット症候群支援機構、MECP2重複症候群家族会''<br> | |||
DOI:<selfdoi /> 原稿受付日:2025年9月1日 原稿完成日:2025年9月XXX日<br> | |||
担当編集委員:[http://researchmap.jp/tadafumikato 加藤 忠史](順天堂大学大学院医学研究科 精神・行動科学/医学部精神医学講座)<br> | |||
</div> | |||
英:methyl-CpG binding protein 2<br> | |||
略称:MeCP2 | 略称:MeCP2 | ||
| 10行目: | 12行目: | ||
== メチル化CpG結合タンパク質2とは == | == メチル化CpG結合タンパク質2とは == | ||
メチル化CpG結合タンパク質2 (MeCP2)は、1992年に[[wj:エイドリアン・バード|Bird]]らによって[[哺乳類]]の[[メチル化]]された[[DNA]]に強い親和性を持って結合するタンパク質として初めて同定され<ref name=Lewis1992><pubmed>1606614</pubmed></ref>、その後の研究により、メチル化された標的遺伝子に結合し、その発現を抑制することが報告された<ref name=Nan1997><pubmed>9038338</pubmed></ref>。一方で1999年、[[wj :フーダ・ゾービ|Huda Zhoghbi]]らのグループにより進行性の神経症状と[[発達遅延]]を特徴とする重度の神経発達症である[[レット症候群]]の女児患者が[[X染色体]]に存在するMECP2遺伝子に変異を有することが示され、原因遺伝子であることが明らかとなった<ref name=Amir1999><pubmed>10508514</pubmed></ref>。2005年には重度の精神遅滞と進行性の神経症状を呈する複数の男児患者らにおいてMECP2遺伝子の重複が見出され、MECP2遺伝子の重複がレット症候群とは異なる神経発達症、[[MECP2重複症候群]]を引き起こすことが判った<ref name=VanEsch2005><pubmed>16080119</pubmed></ref><ref name=Meins2005><pubmed>15689435</pubmed></ref>。これらの報告により、MeCP2は[[エピジェネティクス]]と脳機能・神経疾患を結びつける分子として注目を集めている。MECP2遺伝子の異常はレット症候群やMECP2重複症候群だけでなく、広範な神経疾患患者にも認められることが明らかになっており、MeCP2の機能を明らかにすることは脳機能や幅広い神経疾患病態の解明に寄与すると考えられている<ref name=Chahrour2007><pubmed>17988628</pubmed></ref>。 | |||
== 構造 == | == 構造 == | ||
[[ファイル:Tsujimura MeCP2 Fig1.png|サムネイル|'''図1. MECP2遺伝子から発現する二つのアイソフォーム'''<br>MECP2-e1アイソフォームは選択的スプライシングによりエクソン2が除去される。MECP2-e2アイソフォームはエクソン2のATGより翻訳される。]] | |||
=== 遺伝子構造 === | === 遺伝子構造 === | ||
MECP2遺伝子は4つのエクソンから成り、エクソン2の[[選択的スプライシング]]により2つの異なるアイソフォームをコードしている('''図1''')。[[MECP2a]]によってコードされる[[MeCP2-e1]]アイソフォームは、エクソン1によってコードされる24アミノ酸を含み、9アミノ酸をコードするエクソン2を欠いている。一方、[[MECP2b]]によってコードされる[[MeCP2-e2]]アイソフォームの転写開始部位はエクソン2にある。さらに、MECP2遺伝子には複数の[[ポリアデニル化部位]]を含む保存性の高い[[3'末端非翻訳領域]]があり、これにより代替ポリアデニル化による4つの異なる転写産物を産生する<ref name=Chahrour2007><pubmed>17988628</pubmed></ref>。 | |||
[[ファイル:Tsujimura MeCP2 Fig2.png|サムネイル|'''図2: MECP2の遺伝子構造およびレット症候群患者にみられる主なMECP2遺伝子の変異'''<br>オレンジがメチル化DNA結合ドメイン(MBD)、緑が転写抑制ドメイン(TRD)、紫がNCOR-SMRT相互作用ドメイン (NID)ドメイン、青がAT-hookドメインを示している。レット症候群患者にみられる代表的なナンセンス変異(赤文字)とミスセンス変異(青文字)。]] | |||
=== タンパク質構造 === | === タンパク質構造 === | ||
[[メチル化DNA結合ドメイン]](MBD)、[[転写抑制ドメイン]](TRD)、[[NCOR-SMRT相互作用ドメイン]] (NCOR-SMRT interaction domain, NID)、3つのAT-hookドメインなどの機能ドメインを有している<ref name=Lyst2015><pubmed>25732612</pubmed></ref>('''図2''')。MeCP2はメチル化DNA結合ドメインを介してメチル化された[[ヘテロクロマチン]]領域と相互作用する。転写抑制ドメインはMeCP2の転写抑制活性に重要なドメインであり、その中に位置するNCOR-SMRT相互作用ドメインを介して[[NCOR-SMRT転写抑制複合体]]と相互作用し標的遺伝子の転写を抑制する。AT-hookドメインはAT配列が豊富なDNA領域への相互作用を媒介する機能ドメインであり遺伝学的にMECP2の機能に重要な役割を果たしていることが示されている<ref name=Baker2013><pubmed>23452848</pubmed></ref>。 | |||
MBDドメインによるメチル化DNAへの結合様式については結晶構造解析により原子レベルでの研究が報告されている。関連タンパク質MBD1のメチル化DNA結合ドメインとメチル化DNAとの複合体の溶液構造は、MBD内の疎水性残基のパッチによって特異的結合が媒介されることが示唆された<ref name=Ohki2001><pubmed>11371345</pubmed></ref>。しかしながら、その後の研究によりDNAと結合したMeCP2メチル化DNA結合ドメインの共結晶構造から、結合特異性はDNAの主溝(Major Groove)のメチル化依存的な水和の認識によってもたらされることが示唆されている<ref name=Ho2008><pubmed>18313390</pubmed></ref>。 | |||
[[ファイル:Tsujimura MeCP2 Fig3.png|サムネイル|'''図3. メチル化されたDNAに結合するMBDタンパク質ファミリー'''<br>哺乳類においては、MeCP2、MBD1、MBD2、MBD4の4つのメチル化されたDNAに結合するMBDタンパク質が存在する。]] | |||
== サブファミリー == | == サブファミリー == | ||
哺乳類においては、MeCP2、[[MBD1]]、[[MBD2]]、[[MBD4]]の4つのメチル化DNAに結合するMBDタンパク質が存在する<ref name=Fournier2012><pubmed>22184333</pubmed></ref> ('''図3''')。他の[[MBD3]]、[[MBD5]]、[[MBD6]]の3つのタンパク質もこのMBDタンパク質ファミリーに属するが、メチル化されたDNAに結合しない<ref name=Hendrich2009><pubmed>12711219</pubmed></ref><ref name=Roloff2003><pubmed>12529184</pubmed></ref>。 | |||
MBDタンパク質は、MBDを介して対称的にメチル化されたCpGと結合するという共通性を有するが、それぞれのタンパク質は異なる機能ドメイン構造をもち、異なるタンパク質と相互作用する。このことは、MBDタンパク質が概して重複しない機能を持ち、多様な生物学的プロセスで役割を果たしていることを示唆している。しかしながら、MBDタンパク質の機能を解明するための広範な研究が行われてきたにもかかわらず、MeCP2以外の各MBD遺伝子の[[ノックアウトマウス]]では明らかな表現型が見られないためそれぞれのMBDタンパク質の生物学的意義はまだ明らかではない<ref name=Fournier2012><pubmed>22184333</pubmed></ref>。 | |||
MeCP2以外のMBDファミリーのうち、MBD1について[[中枢神経系]]機能との関連がいくつか報告されている。MBD1もMeCP2と同様にメチル化DNAに結合しクロマチン修飾タンパク質と相互作用することで転写抑制を媒介する<ref name=Fournier2012><pubmed>22184333</pubmed></ref>。[[ヒト]]において、MBD1遺伝子の変異や遺伝子多型が孤発性の[[自閉スペクトラム症]](ASD)患者に認められる<ref name=Li2005><pubmed>15967618</pubmed></ref><ref name=Cukier2010><pubmed>19921286</pubmed></ref>。MBD1を欠失したマウスは[[学習障害]]や[[不安]]亢進、[[社会行動]]異常などのASDに関連した行動異常を示すことが報告されている<ref name=Zhao2003><pubmed>12748381</pubmed></ref><ref name=Allan2008><pubmed>18385101</pubmed></ref>。さらに、MBD1は成体[[神経幹細胞]]の神経細胞への分化を制御していることが明らかになっている<ref name=Jobe2017><pubmed>28100736</pubmed></ref>。 | |||
== 発現 == | == 発現 == | ||
MeCP2-e1は生体内でMeCP2-e2より豊富に存在する。MeCP2遺伝子は複数の[[ポリ(A)付加部位]]を含むヒトとマウス間で高度に保存された[[3'-UTR]]を有しており、MeCP2の[[mRNA]]発現解析により、最も長い転写産物が脳において豊富に存在することが報告されている。この転写産物は胎生期に発現が高く、生後一過的に発現が減少するが、その後成体において再度発現が上昇するという特徴的な発現パターンを示す<ref name=Pelka2005><pubmed>15780747</pubmed></ref>。MeCP2タンパク質の発現量は胎生期には低く、生後のニューロンの成熟に伴って高くなることが示されている<ref name=Kishi2004><pubmed>15519245</pubmed></ref>。 | |||
=== 細胞内分布 === | === 細胞内分布 === | ||
MeCP2タンパク質は細胞内では[[核]]内に強く発現がみられ、特にヘテロクロマチンに豊富に存在することが知られている。最近の報告では、MeCP2が核内ヘテロクロマチンの[[液-液相分離]] (特定タンパク質が濃縮された液滴を形成する現象。液相様凝集)を促進しており、レット症候群患者でみられるメチル化DNAへの結合能を失った変異ではこの相分離能を喪失することが報告されている<ref name=Li2020><pubmed>32698189</pubmed></ref>。 | |||
一方で、MeCP2は[[Y-box-binding protein 1 ]] ([[YB-1]])や[[microRNAプロセッサー]]である[[Drosha]]複合体などの[[RNA結合タンパク質]]とも相互作用することが報告されており、[[細胞質]]にも存在し機能している<ref name=Young2005><pubmed>16251272</pubmed></ref><ref name=Tsujimura2015><pubmed>26344767</pubmed></ref><ref name=Nakashima2021><pubmed>34010654</pubmed></ref><ref name=Cheng2014><pubmed>24636259</pubmed></ref>。 | |||
=== 組織分布 === | === 組織分布 === | ||
MeCP2 | MeCP2 mRNAは特に[[海馬]]、[[大脳皮質]]、[[小脳]]において高く発現しており、他の脳領域では中程度発現している。MeCP2タンパク質は成体脳の全領域に発現がみられるが[[前脳]]ニューロンにおいて特に高い発現が認められる<ref name=Jung2003><pubmed>12605461</pubmed></ref>。MeCP2は[[グリア細胞]]や末梢組織では発現していないと考えられていたが、近年の研究により[[アストロサイト]]や[[ミクログリア]]などのグリア細胞にも低いながら発現が認められ、神経機能や疾患病態への寄与が報告されている<ref name=Albizzati2024><pubmed>38469559</pubmed></ref><ref name=Cao2024><pubmed>38289948</pubmed></ref>。神経系以外の組織においても広範囲にMeCP2の発現は認められる<ref name=Vashi2021><pubmed>34230964</pubmed></ref>。 | ||
== 機能 == | == 機能 == | ||
=== 転写抑制活性 === | |||
MeCP2はMBDを介してメチル化されたCpGヌクレオチドに特異的に結合する。この結合特異性は近接するA/Tリッチな配列に依存する<ref name=Klose2005><pubmed>16137622</pubmed></ref> (Klose RJ et al., Mol Cell 19,667-678, 2005)。TRDはNIDを介して[[HDAC]]や[[mSin3A]]、NCoR-SMRT複合体などのコリプレッサー、[[SWI]]/[[SNF]]クロマチンリモデリング因子、DNAメチル基転移酵素[[Suv39H1]]等をリクルートすることにより、メチル化された遺伝子[[プロモーター]]に結合し標的遺伝子の発現を抑制する[[転写抑制因子]]([[リプレッサー]])として作用する<ref name=Nan1998><pubmed>9620804</pubmed></ref><ref name=Harikrishnan2005><pubmed>15696166</pubmed></ref><ref name=Kimura2003><pubmed>12473678</pubmed></ref>。 | |||
C末端ドメインは[[naked DNA]]や[[ヌクレオソーム]]へのMeCP2の結合を促進することやヌクレオソームの安定性に作用することが示されているが、機能的役割の全貌は明らかになっていない<ref name=Buschdorf2004><pubmed>14618241</pubmed></ref><ref name=Chua2024><pubmed>39164525</pubmed></ref>。しかし、多くのレット症候群患者においてC末端の欠失がみられること、MeCP2のC末端領域を欠失したモデルマウスは種々のレット症候群にみられる表現型を示すことからMeCP2の正常な機能とその破綻に起因する病態に重要なことは明白である。 | |||
一方、転写抑制因子として作用するだけでなく、極めて多様な機能を有することが明らかになっている。[[転写因子]][[cAMP response element binding protein 1]] ([[CREB1]])と結合し[[転写活性化因子]]としても機能すること<ref name=Chahrour2008><pubmed>18511691</pubmed></ref>や、[[クロマチンループ]]構造の形成を介してクロマチン凝集を制御すること<ref name=Horike2005><pubmed>15608638</pubmed></ref>、RNA結合タンパク質であるYB-1と相互作用し、mRNAのスプライシングを調節すること<ref name=Young2005><pubmed>16251272</pubmed></ref>、Drosha複合体と相互作用することで[[microRNAプロセシング調節因子]]として作用すること<ref name=Tsujimura2015><pubmed>26344767</pubmed></ref><ref name=Nakashima2021><pubmed>34010654</pubmed></ref><ref name=Cheng2014><pubmed>24636259</pubmed></ref>が示されている。このようにMeCP2は様々なタンパク質パートナーと状況依存的に相互作用し、非常に多彩な機能を発揮していることが明らかになっている。これまでに40以上の結合タンパク質が同定されている<ref name=Lyst2015><pubmed>25732612</pubmed></ref>。加えて、MeCP2が[[ヒドロキシメチル化シトシン]]([[5hmC]])にも結合することが示され、レット症候群患者でみられるMECP2変異体R133Cでは5hmCとの結合が減弱することから、この機能の病態への関与も示唆されている<ref name=Mellen2012><pubmed>23260135</pubmed></ref>。 | |||
=== MeCP2標的因子 === | === MeCP2標的因子 === | ||
レット症候群やMECP2重複症候群をはじめとするMECP2の機能異常に起因する神経疾患の病態解明や治療法開発を考慮する上でMeCP2の下流標的因子を同定することは重要である。MeCP2機能欠損による標的遺伝子発現異常を調べるために、MeCP2 ノックアウト(KO)マウスの脳組織を用いた転写プロファイリングが行われたが、予想外に大きな発現変化は検出されず病態に関連するような異常発現遺伝子の同定には至らなかった<ref name=Tudor2002><pubmed>12432090</pubmed></ref>。 | |||
MeCP2の転写抑制標的として、[[脳由来神経栄養因子]] ([[brain-derived neurotrophic factor]], [[BDNF]]) <ref name=Chen2003><pubmed>14593183</pubmed></ref>やFXYD domain containing ion transport regulator (FXYD1) <ref name=Deng2007><pubmed>17309881</pubmed></ref>、[[インスリン様成長因子結合タンパク質3]] ([[insulin like growth factor binding protein]], [[IGFBP3]]) <ref name=Itoh2007><pubmed>17278996</pubmed></ref>遺伝子などが同定されている。BDNFはMeCP2の下流標的遺伝子であることが複数の研究により報告されているが、MeCP2ノックアウトマウスにおいて発現量の減少がみられること<ref name=Chang2006><pubmed>16446138</pubmed></ref>から転写活性化の標的になっていることや間接的に影響を受けている可能性があり、MeCP2によってどのように発現が調節されているのか、病態にどのような寄与をしているのかは依然として不明瞭である。 | |||
CREBを介したMeCP2の転写活性化因子としての標的は、[[ソマトスタチン]]や[[G protein regulated inducer of neurite outgrowth 1]] ([[Gprin1]])などが報告されている<ref name=Chahrour2008><pubmed>18511691</pubmed></ref>。MeCP2のスプライシング調節因子としての標的は[[NMDA型グルタミン酸受容体]][[NR1]]サブユニットなどが挙げられる<ref name=Young2005><pubmed>16251272</pubmed></ref>。 | |||
miRNAプロセシング調節因子の標的は、MeCP2- | miRNAプロセシング調節因子の標的は、MeCP2-Drosha複合体の標的として[[miR-199a]]が同定されており、miR-199aノックアウトマウスはMecp2ノックアウトマウスにみられる体重減少や短寿命などの表現型を模倣する<ref name=Tsujimura2015><pubmed>26344767</pubmed></ref>。さらに、このmiR-199aは下流の[[骨形成因子]] ([[bone morphogenetic protein]], [[BMP]]シグナル因子[[Smad-1]]の発現抑制を介してMeCP2の神経幹細胞分化制御作用を媒介し、miR-199aの発現やBMPシグナル阻害剤処理はレット症候群患者[[iPS細胞]]由来神経幹細胞の分化や[[オルガノイド]]発達の異常を改善する<ref name=Nakashima2021><pubmed>34010654</pubmed></ref>。 | ||
== 疾患との関わり == | == 疾患との関わり == | ||
MECP2遺伝子の変異はレット症候群を、MECP2遺伝子の重複はMECP2重複症候群を引き起こす。さらに、MECP2の変異は種々の精神・神経疾患患者に認められ、広範な疾患の病態に寄与する。 | |||
これらの疾患に関してはマウスモデルのほか、[[霊長類]]モデルも作製されており<ref name=Chen2017><pubmed>28525759</pubmed></ref><ref name=Cai2020><pubmed>32269107</pubmed></ref>、今後は霊長類モデルを用いた研究によりMECP2機能異常に起因するヒト疾患病態のさらなる理解や治療法開発が期待される。 | |||
=== レット症候群 === | === レット症候群 === | ||
主に女児にみられる進行性の重篤な神経発達症である。X連鎖優性遺伝病で10,000〜15,000人に一人の頻度で発症する。男性はX染色体を1本しか持たないため、変異を持つと致死的となるケースがほとんどであり、まれにみられるのは主要な機能ドメイン外における変異や体細胞モザイク変異の場合などである。生後6〜18ヶ月程度までは正常に発達するが、その後それまでに獲得された言語能力や運動機能の退行がみられる。患者は自閉傾向や[[てんかん]]、手もみ動作に代表される[[常同行動]]や[[精神遅滞]]、[[小頭症]]などの種々の神経学的症状を示す。神経系以外の症状としては、全身の成長遅延や骨形成不全などの特徴がみられる<ref name=Rett1966>'''Rett A., (1966)'''<br>Wien Med Wochenschr 116(37), 723-726,</ref><ref name=Hagberg1983><pubmed>6638958</pubmed></ref>。 | |||
95%以上の古典的レット症候群症例にMECP2遺伝子の変異が認められる。変異のタイプは[[ミスセンス]]や[[ナンセンス]]、[[フレームシフト]]型など、300以上のヌクレオチド置換が報告されているが、特にT158M、R306C、R168X、R255X、R270Xの8つの変異が〜70%を占めることが示されている<ref name=Christodoulou2003><pubmed>12673788</pubmed></ref><ref name=Chahrour2007><pubmed>17988628</pubmed></ref>。 | |||
MECP2の個体における機能と疾患病態を理解するために様々なモデルマウスが作製されてきた。最初に、Birdらと[[wj:ルドルフ・イエーニッシュ|Jaenish]]らそれぞれの独立したグループにより、エクソン3あるいはエクソン3と4を全身で欠失したMeCP2ノックアウト(MeCP2<sup>-/y</sup>)マウスが作製された<ref name=Chen2001><pubmed>11242118</pubmed></ref><ref name=Guy2001><pubmed>11242117</pubmed></ref>。これらのレット症候群モデルマウスはレット症候群患者の症状を模倣した表現型を示す。3-6週齢までは一見正常な発達がみられるが、それ以降には低活動性や振戦、歩行失調、イレギュラーな呼吸などの中枢性症状を示すようになり8-10週齢までにほとんどの個体が死亡する。脳は、患者の脳と同様に全体的な脳体積が小さく、個々のニューロンの[[細胞体]]も小さい。また、海馬を含めた脳の種々の領域においてニューロンが密に配置されるという組織学的な特徴を示す。一方で、脳全体の顕著な構造的異常は確認されない。MeCP2ヘテロ(MeCP2<sup>+/-</sup>)雌マウスは患者と同様に全組織中においてX染色体のランダムな不活性化により正常MeCP2を発現する細胞とMeCP2を欠失した細胞が混在しておりレット症候群様の行動異常を示すが、全ての細胞でMeCP2を欠失しているMeCP2<sup>-/y</sup>雄よりも遅い時期に表現型が観察されるようになる。さらに[[ネスチン]]-Creドライバーを用いて作製された中枢神経系特異的MeCP2欠損マウスは全身性のMeCP2<sup>-/y</sup>マウスと類似した表現型がみられることから、脳・神経系におけるMeCP2の欠損はレット症候群の病態を引き起こすのに十分であることが証明されている。加えて、[[Ca2+/カルモジュリン依存性タンパク質キナーゼII|Ca<sup>2+</sup>/カルモジュリン依存性タンパク質キナーゼII]] ([[Ca2+-calmodulin-dependent protein kinase II|Ca<sup>2+</sup>-calmodulin-dependent protein kinase II]], [[CaMKII]])-[[Cre]]ドライバーを用いて作製された最終分裂後のニューロンに特異的なMeCP2欠損マウスにおいても時期は遅延するものの類似の表現型がみられることから成熟ニューロン機能におけるMeCP2の重要性が確認されている<ref name=Chen2001><pubmed>11242118</pubmed></ref><ref name=Gemelli2006><pubmed>16199017</pubmed></ref>。特筆すべきことに、MeCP2欠失マウスにおいて神経系細胞およびニューロンにMeCP2を再発現させると、上述のMeCP2欠失マウスの表現型が改善されることが示されている<ref name=Guy2001><pubmed>11242117</pubmed></ref><ref name=Giacometti2007><pubmed>17267601</pubmed></ref>。これらの結果は進行性の重篤な神経疾患を治療することが可能であることを示唆する臨床的にも重要な知見である。 | |||
患者の神経生理学的研究から、レット症候群患者において異常に増大した体性感覚誘発電位<ref name=Yoshikawa1991><pubmed>206399</pubmed></ref>や脳波におけるてんかん性異常<ref name=Moser2007><pubmed>17275660</pubmed></ref>が報告されている。MeCP2-/yモデルマウスでは時折発作性脳波が観察されるが、主に過興奮性発火がみられることが示されている<ref name=Chao2010><pubmed>21068835</pubmed></ref>。また、抑制性ニューロンにおいてMeCP2を欠損するマウスは同様に主に過興奮性発火を示すが、発作性脳波は検出されないことが報告されている<ref name=Chao2010><pubmed>21068835</pubmed></ref>。MeCP2<sup>-/y</sup>マウスやMeCP2<sup>308/y</sup>マウス(308番目のアミノ酸からC末端が欠失した短縮型変異体)の皮質スライスでは、[[長期増強]]([[long-term potentiation]], [[LTP]])の減少がみられること<ref name=Asaka2006><pubmed>16087343</pubmed></ref>、MeCP2<sup>-/y</sup>マウスの皮質においては興奮性シナプス伝達の減少と抑制性シナプス伝達の上昇が示されている<ref name=Dani2005><pubmed>16116096</pubmed></ref>。また、MeCP2-/yマウス由来の培養海馬ニューロンは自発的な興奮性シナプス伝達の頻度の減少と興奮性シナプス密度の減少を示すことが報告されている<ref name=Nelson2006><pubmed>16581518</pubmed></ref><ref name=Chao2007><pubmed>17920015</pubmed></ref>。これらの報告から、MeCP2は局所の興奮性シナプス伝達と抑制性シナプス伝達のバランスを調節することによってマクロな興奮性/抑制性神経ネットワークの制御に重要な役割を果たしていることが示唆される。 | |||
様々な脳領域や細胞種特異的にMecp2を欠損させたコンディショナルノックアウトマウスが作製され、種々の脳部位および神経サブタイプ機能におけるMeCP2の機能が個体レベルで明らかにされてきている。[[扁桃体]]特異的コンディショナルノックアウトマウスは、不安様行動の増加と恐怖学習の低下がみられる<ref name=Adachi2009><pubmed>19339616</pubmed></ref>。[[視床下部]]特異的コンディショナルノックアウトマウスは、不安様行動の増加や、[[攻撃性]]の上昇、[[食欲]]過剰、[[肥満]]を示す<ref name=Fyffe2008><pubmed>18817733</pubmed></ref>F。[[チロシン水酸化酵素]] ([[tyrosine hydroxylase]], [[TH]])発現[[ドーパミン]]および[[ノルアドレナリン]]ニューロン特異コンディショナルノックアウトマウスにおいては、ドーパミンおよびノルアドレナリン量の減少と運動機能障害がみられる<ref name=Samaco2009><pubmed>20007372</pubmed></ref>。[[PC12 ETS factor 1]] ([[PET1]])発現[[セロトニン]]ニューロン特異的にMecp2を欠損したマウスは、セロトニン量の減少と攻撃性の上昇を示す<ref name=Samaco2009><pubmed>20007372</pubmed></ref>。広範な抑制性ニューロンにおけるMecp2の欠損は、短命や呼吸障害、運動機能障害、反復行動、低活動、異常な社会性の上昇、感覚運動遮断の異常、学習障害などレット症候群様の多くの表現型を示す(<ref name=Chao2010><pubmed>21068835</pubmed></ref>。 | |||
一方で、前脳の抑制性ニューロンにおけるMecp2の欠損は、運動機能障害、反復行動、低活動、異常な社会性の上昇、感覚運動遮断の異常、学習障害などいくつかのレット症候群様表現型を示すことが明らかにされている<ref name=Chao2010><pubmed>21068835</pubmed></ref>。[[抑制性ニューロン]]サブタイプにおけるMeCP2の機能についても研究が行われており、[[パルアルブミン]]発現抑制性ニューロン特異的にMecp2を欠損したマウスでは運動機能や感覚情報処理、学習、社会性の異常がみられ、[[ソマトスタチン]]発現抑制性ニューロン特異的にMecp2を欠損したマウスにおいてはてんかんや常同運動がみられることが示されている<ref name=ItoIshida2015><pubmed>26590342</pubmed></ref>。 | |||
実際のレット症候群患者にみられる高頻度にみられるC末端欠失型ナンセンス変異体を模倣したMeCP2<sup>R168X/y</sup>マウス、MeCP2<sup>R255X/y</sup>マウス、MeCP2<sup>308/y</sup>マウスは、運動機能低下、低活動、社会行動低下、不安様行動などのレット症候群患者でみられる多くの表現型を示す<ref name=Wegener2014><pubmed>25541993</pubmed></ref><ref name=Pitcher2015><pubmed>25634563</pubmed></ref><ref name=Shahbazian2002><pubmed>12160743</pubmed></ref>。点変異型ミスセンス変異を模倣したモデルマウスも作製されており部分的なレット症候群表現型を示す(<ref name=Goffin2011><pubmed>22119903</pubmed></ref>。興味深いことに、Mecp2のN末端とC末端を欠失したMBDとNIDを含む短いMeCP2(正常タンパク質のおよそ半分の長さ)を発現するマウスはほぼ正常に近い表現型を示し、Mecp2欠損マウスにこの短いMeCP2を導入することにより表現型の改善がみられることも報告されている<ref name=Tillotson2017><pubmed>29019980</pubmed></ref>。 | |||
=== MECP2重複症候群 === | === MECP2重複症候群 === | ||
MECP2重複症候群はX染色体上にあるMECP2遺伝子を含む領域の重複により引き起こされ、男児に発症する。出生男児10万人に一人の頻度で発症することが報告されている(<ref name=GiudiceNairn2019><pubmed>30756435</pubmed></ref> | MECP2重複症候群はX染色体上にあるMECP2遺伝子を含む領域の重複により引き起こされ、男児に発症する。出生男児10万人に一人の頻度で発症することが報告されている(<ref name=GiudiceNairn2019><pubmed>30756435</pubmed></ref>。同じアレル上で重複することが多くみられるが[[転座]]例も報告されている。重度の知的障害、運動発達障害、自閉的行動特性、筋緊張低下、反復性の[[感染症]]、薬剤抵抗性のてんかんを特徴とする。ほとんどの患者でてんかんが認められ、種々の異常脳波が神経生理学的な異常として報告されている(<ref name=Lorenzo2021><pubmed>34486423</pubmed></ref><ref name=Cani2022><pubmed>35520952</pubmed></ref>。 | ||
ヒトMECP2遺伝子をゲノムに挿入しMeCP2を正常量より多く発現するMECP2重複症候群モデルマウスも作製されており、MECP2重複患者にみられるような異常脳波などの神経生理学的表現型の一部を模倣することが報告されている(<ref name=Collins2004><pubmed>15351775</pubmed></ref> | ヒトMECP2遺伝子をゲノムに挿入しMeCP2を正常量より多く発現するMECP2重複症候群モデルマウスも作製されており、MECP2重複患者にみられるような異常脳波などの神経生理学的表現型の一部を模倣することが報告されている(<ref name=Collins2004><pubmed>15351775</pubmed></ref>。 | ||
過剰なMeCP2の発現を抑制するようにデザインされた[[アンチセンスオリゴヌクレオチド]]([[ASO]])がMECP2重複モデルマウスの表現型を改善することが示され<ref name=Shao2021><pubmed>33658357</pubmed></ref><ref name=Sztainberg2015><pubmed>26605526</pubmed></ref>、それらの結果を基に現在臨床第1/2相試験が実施されている(ClinicalTrial.gov identifier: NCT06430385)。 | |||
=== その他の疾患との関連 === | === その他の疾患との関連 === | ||
MECP2遺伝子の異常はレット症候群やMECP2重複症候群だけでなく、種々の精神・神経疾患患者にも認められる。これまでに、患者のゲノム解析によりMECP2遺伝子の異常が自閉スペクトラム症(Autism spectrum disorder: ASD) | MECP2遺伝子の異常はレット症候群やMECP2重複症候群だけでなく、種々の精神・神経疾患患者にも認められる。これまでに、患者のゲノム解析によりMECP2遺伝子の異常が自閉スペクトラム症(Autism spectrum disorder: ASD)、[[学習障害]] (Intellectual disability: ID)、[[統合失調症]]、[[双極性障害]]など多様な疾患の発症に寄与することが示されている(<ref name=Chahrour2007><pubmed>17988628</pubmed></ref><ref name=Wen2017><pubmed>28785396</pubmed></ref>。今後、精神・神経疾患患者の[[全ゲノムシークエンス]] ([[Whole Genome Sequencing]]: WGS)の普及が進むことによりMECP2遺伝子異常と広範な疾患病態とのさらなる関連の解明が期待される。 | ||
== 関連語 == | == 関連語 == | ||
* [[エピジェネティクス]] | |||
* [[遺伝子発現制御]] | |||
* [[DNAメチル化]] | |||
* [[発達障害]] | |||
* [[レット症候群]] | |||
* [[MECP2重複症候群]] | |||
* [[自閉スペクトラム症]] | |||
* [[学習障害]] | |||
* [[統合失調症]] | |||
* [[双極性障害]] | |||
* [[精神疾患]] | |||
* [[認知機能障害]] | |||
== 参考文献 == | |||
2025年10月6日 (月) 12:49時点における版
辻村啓太
元名古屋大学大学院理学研究科附属ニューロサイエンス研究センター・脳機能発達制御学グループ
レット症候群支援機構、MECP2重複症候群家族会
DOI:10.14931/bsd.11354 原稿受付日:2025年9月1日 原稿完成日:2025年9月XXX日
担当編集委員:加藤 忠史(順天堂大学大学院医学研究科 精神・行動科学/医学部精神医学講座)
英:methyl-CpG binding protein 2
略称:MeCP2
メチル化CpG結合タンパク質(MeCP2)はメチル化されたDNAに結合する転写抑制因子として同定されて以来、多様な機能を発揮し遺伝子発現を精巧に制御していることが明らかになっている。また、MECP2遺伝子の異常が重篤な神経症状を呈する神経発達症・レット症候群とMECP2重複症候群を引き起こすことや、様々な神経疾患の病態に関与することが示されており中枢神経系機能や疾患病態における重要な役割が明らかになっている。
メチル化CpG結合タンパク質2とは
メチル化CpG結合タンパク質2 (MeCP2)は、1992年にBirdらによって哺乳類のメチル化されたDNAに強い親和性を持って結合するタンパク質として初めて同定され[1]、その後の研究により、メチル化された標的遺伝子に結合し、その発現を抑制することが報告された[2]。一方で1999年、Huda Zhoghbiらのグループにより進行性の神経症状と発達遅延を特徴とする重度の神経発達症であるレット症候群の女児患者がX染色体に存在するMECP2遺伝子に変異を有することが示され、原因遺伝子であることが明らかとなった[3]。2005年には重度の精神遅滞と進行性の神経症状を呈する複数の男児患者らにおいてMECP2遺伝子の重複が見出され、MECP2遺伝子の重複がレット症候群とは異なる神経発達症、MECP2重複症候群を引き起こすことが判った[4][5]。これらの報告により、MeCP2はエピジェネティクスと脳機能・神経疾患を結びつける分子として注目を集めている。MECP2遺伝子の異常はレット症候群やMECP2重複症候群だけでなく、広範な神経疾患患者にも認められることが明らかになっており、MeCP2の機能を明らかにすることは脳機能や幅広い神経疾患病態の解明に寄与すると考えられている[6]。
構造
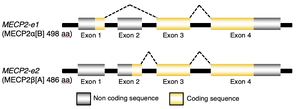
MECP2-e1アイソフォームは選択的スプライシングによりエクソン2が除去される。MECP2-e2アイソフォームはエクソン2のATGより翻訳される。
遺伝子構造
MECP2遺伝子は4つのエクソンから成り、エクソン2の選択的スプライシングにより2つの異なるアイソフォームをコードしている(図1)。MECP2aによってコードされるMeCP2-e1アイソフォームは、エクソン1によってコードされる24アミノ酸を含み、9アミノ酸をコードするエクソン2を欠いている。一方、MECP2bによってコードされるMeCP2-e2アイソフォームの転写開始部位はエクソン2にある。さらに、MECP2遺伝子には複数のポリアデニル化部位を含む保存性の高い3'末端非翻訳領域があり、これにより代替ポリアデニル化による4つの異なる転写産物を産生する[6]。
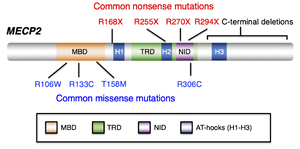
オレンジがメチル化DNA結合ドメイン(MBD)、緑が転写抑制ドメイン(TRD)、紫がNCOR-SMRT相互作用ドメイン (NID)ドメイン、青がAT-hookドメインを示している。レット症候群患者にみられる代表的なナンセンス変異(赤文字)とミスセンス変異(青文字)。
タンパク質構造
メチル化DNA結合ドメイン(MBD)、転写抑制ドメイン(TRD)、NCOR-SMRT相互作用ドメイン (NCOR-SMRT interaction domain, NID)、3つのAT-hookドメインなどの機能ドメインを有している[7](図2)。MeCP2はメチル化DNA結合ドメインを介してメチル化されたヘテロクロマチン領域と相互作用する。転写抑制ドメインはMeCP2の転写抑制活性に重要なドメインであり、その中に位置するNCOR-SMRT相互作用ドメインを介してNCOR-SMRT転写抑制複合体と相互作用し標的遺伝子の転写を抑制する。AT-hookドメインはAT配列が豊富なDNA領域への相互作用を媒介する機能ドメインであり遺伝学的にMECP2の機能に重要な役割を果たしていることが示されている[8]。
MBDドメインによるメチル化DNAへの結合様式については結晶構造解析により原子レベルでの研究が報告されている。関連タンパク質MBD1のメチル化DNA結合ドメインとメチル化DNAとの複合体の溶液構造は、MBD内の疎水性残基のパッチによって特異的結合が媒介されることが示唆された[9]。しかしながら、その後の研究によりDNAと結合したMeCP2メチル化DNA結合ドメインの共結晶構造から、結合特異性はDNAの主溝(Major Groove)のメチル化依存的な水和の認識によってもたらされることが示唆されている[10]。
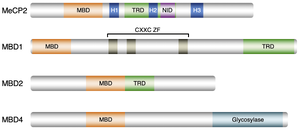
哺乳類においては、MeCP2、MBD1、MBD2、MBD4の4つのメチル化されたDNAに結合するMBDタンパク質が存在する。
サブファミリー
哺乳類においては、MeCP2、MBD1、MBD2、MBD4の4つのメチル化DNAに結合するMBDタンパク質が存在する[11] (図3)。他のMBD3、MBD5、MBD6の3つのタンパク質もこのMBDタンパク質ファミリーに属するが、メチル化されたDNAに結合しない[12][13]。
MBDタンパク質は、MBDを介して対称的にメチル化されたCpGと結合するという共通性を有するが、それぞれのタンパク質は異なる機能ドメイン構造をもち、異なるタンパク質と相互作用する。このことは、MBDタンパク質が概して重複しない機能を持ち、多様な生物学的プロセスで役割を果たしていることを示唆している。しかしながら、MBDタンパク質の機能を解明するための広範な研究が行われてきたにもかかわらず、MeCP2以外の各MBD遺伝子のノックアウトマウスでは明らかな表現型が見られないためそれぞれのMBDタンパク質の生物学的意義はまだ明らかではない[11]。
MeCP2以外のMBDファミリーのうち、MBD1について中枢神経系機能との関連がいくつか報告されている。MBD1もMeCP2と同様にメチル化DNAに結合しクロマチン修飾タンパク質と相互作用することで転写抑制を媒介する[11]。ヒトにおいて、MBD1遺伝子の変異や遺伝子多型が孤発性の自閉スペクトラム症(ASD)患者に認められる[14][15]。MBD1を欠失したマウスは学習障害や不安亢進、社会行動異常などのASDに関連した行動異常を示すことが報告されている[16][17]。さらに、MBD1は成体神経幹細胞の神経細胞への分化を制御していることが明らかになっている[18]。
発現
MeCP2-e1は生体内でMeCP2-e2より豊富に存在する。MeCP2遺伝子は複数のポリ(A)付加部位を含むヒトとマウス間で高度に保存された3'-UTRを有しており、MeCP2のmRNA発現解析により、最も長い転写産物が脳において豊富に存在することが報告されている。この転写産物は胎生期に発現が高く、生後一過的に発現が減少するが、その後成体において再度発現が上昇するという特徴的な発現パターンを示す[19]。MeCP2タンパク質の発現量は胎生期には低く、生後のニューロンの成熟に伴って高くなることが示されている[20]。
細胞内分布
MeCP2タンパク質は細胞内では核内に強く発現がみられ、特にヘテロクロマチンに豊富に存在することが知られている。最近の報告では、MeCP2が核内ヘテロクロマチンの液-液相分離 (特定タンパク質が濃縮された液滴を形成する現象。液相様凝集)を促進しており、レット症候群患者でみられるメチル化DNAへの結合能を失った変異ではこの相分離能を喪失することが報告されている[21]。
一方で、MeCP2はY-box-binding protein 1 (YB-1)やmicroRNAプロセッサーであるDrosha複合体などのRNA結合タンパク質とも相互作用することが報告されており、細胞質にも存在し機能している[22][23][24][25]。
組織分布
MeCP2 mRNAは特に海馬、大脳皮質、小脳において高く発現しており、他の脳領域では中程度発現している。MeCP2タンパク質は成体脳の全領域に発現がみられるが前脳ニューロンにおいて特に高い発現が認められる[26]。MeCP2はグリア細胞や末梢組織では発現していないと考えられていたが、近年の研究によりアストロサイトやミクログリアなどのグリア細胞にも低いながら発現が認められ、神経機能や疾患病態への寄与が報告されている[27][28]。神経系以外の組織においても広範囲にMeCP2の発現は認められる[29]。
機能
転写抑制活性
MeCP2はMBDを介してメチル化されたCpGヌクレオチドに特異的に結合する。この結合特異性は近接するA/Tリッチな配列に依存する[30] (Klose RJ et al., Mol Cell 19,667-678, 2005)。TRDはNIDを介してHDACやmSin3A、NCoR-SMRT複合体などのコリプレッサー、SWI/SNFクロマチンリモデリング因子、DNAメチル基転移酵素Suv39H1等をリクルートすることにより、メチル化された遺伝子プロモーターに結合し標的遺伝子の発現を抑制する転写抑制因子(リプレッサー)として作用する[31][32][33]。
C末端ドメインはnaked DNAやヌクレオソームへのMeCP2の結合を促進することやヌクレオソームの安定性に作用することが示されているが、機能的役割の全貌は明らかになっていない[34][35]。しかし、多くのレット症候群患者においてC末端の欠失がみられること、MeCP2のC末端領域を欠失したモデルマウスは種々のレット症候群にみられる表現型を示すことからMeCP2の正常な機能とその破綻に起因する病態に重要なことは明白である。
一方、転写抑制因子として作用するだけでなく、極めて多様な機能を有することが明らかになっている。転写因子cAMP response element binding protein 1 (CREB1)と結合し転写活性化因子としても機能すること[36]や、クロマチンループ構造の形成を介してクロマチン凝集を制御すること[37]、RNA結合タンパク質であるYB-1と相互作用し、mRNAのスプライシングを調節すること[22]、Drosha複合体と相互作用することでmicroRNAプロセシング調節因子として作用すること[23][24][25]が示されている。このようにMeCP2は様々なタンパク質パートナーと状況依存的に相互作用し、非常に多彩な機能を発揮していることが明らかになっている。これまでに40以上の結合タンパク質が同定されている[7]。加えて、MeCP2がヒドロキシメチル化シトシン(5hmC)にも結合することが示され、レット症候群患者でみられるMECP2変異体R133Cでは5hmCとの結合が減弱することから、この機能の病態への関与も示唆されている[38]。
MeCP2標的因子
レット症候群やMECP2重複症候群をはじめとするMECP2の機能異常に起因する神経疾患の病態解明や治療法開発を考慮する上でMeCP2の下流標的因子を同定することは重要である。MeCP2機能欠損による標的遺伝子発現異常を調べるために、MeCP2 ノックアウト(KO)マウスの脳組織を用いた転写プロファイリングが行われたが、予想外に大きな発現変化は検出されず病態に関連するような異常発現遺伝子の同定には至らなかった[39]。
MeCP2の転写抑制標的として、脳由来神経栄養因子 (brain-derived neurotrophic factor, BDNF) [40]やFXYD domain containing ion transport regulator (FXYD1) [41]、インスリン様成長因子結合タンパク質3 (insulin like growth factor binding protein, IGFBP3) [42]遺伝子などが同定されている。BDNFはMeCP2の下流標的遺伝子であることが複数の研究により報告されているが、MeCP2ノックアウトマウスにおいて発現量の減少がみられること[43]から転写活性化の標的になっていることや間接的に影響を受けている可能性があり、MeCP2によってどのように発現が調節されているのか、病態にどのような寄与をしているのかは依然として不明瞭である。
CREBを介したMeCP2の転写活性化因子としての標的は、ソマトスタチンやG protein regulated inducer of neurite outgrowth 1 (Gprin1)などが報告されている[36]。MeCP2のスプライシング調節因子としての標的はNMDA型グルタミン酸受容体NR1サブユニットなどが挙げられる[22]。
miRNAプロセシング調節因子の標的は、MeCP2-Drosha複合体の標的としてmiR-199aが同定されており、miR-199aノックアウトマウスはMecp2ノックアウトマウスにみられる体重減少や短寿命などの表現型を模倣する[23]。さらに、このmiR-199aは下流の骨形成因子 (bone morphogenetic protein, BMPシグナル因子Smad-1の発現抑制を介してMeCP2の神経幹細胞分化制御作用を媒介し、miR-199aの発現やBMPシグナル阻害剤処理はレット症候群患者iPS細胞由来神経幹細胞の分化やオルガノイド発達の異常を改善する[24]。
疾患との関わり
MECP2遺伝子の変異はレット症候群を、MECP2遺伝子の重複はMECP2重複症候群を引き起こす。さらに、MECP2の変異は種々の精神・神経疾患患者に認められ、広範な疾患の病態に寄与する。
これらの疾患に関してはマウスモデルのほか、霊長類モデルも作製されており[44][45]、今後は霊長類モデルを用いた研究によりMECP2機能異常に起因するヒト疾患病態のさらなる理解や治療法開発が期待される。
レット症候群
主に女児にみられる進行性の重篤な神経発達症である。X連鎖優性遺伝病で10,000〜15,000人に一人の頻度で発症する。男性はX染色体を1本しか持たないため、変異を持つと致死的となるケースがほとんどであり、まれにみられるのは主要な機能ドメイン外における変異や体細胞モザイク変異の場合などである。生後6〜18ヶ月程度までは正常に発達するが、その後それまでに獲得された言語能力や運動機能の退行がみられる。患者は自閉傾向やてんかん、手もみ動作に代表される常同行動や精神遅滞、小頭症などの種々の神経学的症状を示す。神経系以外の症状としては、全身の成長遅延や骨形成不全などの特徴がみられる[46][47]。
95%以上の古典的レット症候群症例にMECP2遺伝子の変異が認められる。変異のタイプはミスセンスやナンセンス、フレームシフト型など、300以上のヌクレオチド置換が報告されているが、特にT158M、R306C、R168X、R255X、R270Xの8つの変異が〜70%を占めることが示されている[48][6]。
MECP2の個体における機能と疾患病態を理解するために様々なモデルマウスが作製されてきた。最初に、BirdらとJaenishらそれぞれの独立したグループにより、エクソン3あるいはエクソン3と4を全身で欠失したMeCP2ノックアウト(MeCP2-/y)マウスが作製された[49][50]。これらのレット症候群モデルマウスはレット症候群患者の症状を模倣した表現型を示す。3-6週齢までは一見正常な発達がみられるが、それ以降には低活動性や振戦、歩行失調、イレギュラーな呼吸などの中枢性症状を示すようになり8-10週齢までにほとんどの個体が死亡する。脳は、患者の脳と同様に全体的な脳体積が小さく、個々のニューロンの細胞体も小さい。また、海馬を含めた脳の種々の領域においてニューロンが密に配置されるという組織学的な特徴を示す。一方で、脳全体の顕著な構造的異常は確認されない。MeCP2ヘテロ(MeCP2+/-)雌マウスは患者と同様に全組織中においてX染色体のランダムな不活性化により正常MeCP2を発現する細胞とMeCP2を欠失した細胞が混在しておりレット症候群様の行動異常を示すが、全ての細胞でMeCP2を欠失しているMeCP2-/y雄よりも遅い時期に表現型が観察されるようになる。さらにネスチン-Creドライバーを用いて作製された中枢神経系特異的MeCP2欠損マウスは全身性のMeCP2-/yマウスと類似した表現型がみられることから、脳・神経系におけるMeCP2の欠損はレット症候群の病態を引き起こすのに十分であることが証明されている。加えて、Ca2+/カルモジュリン依存性タンパク質キナーゼII (Ca2+-calmodulin-dependent protein kinase II, CaMKII)-Creドライバーを用いて作製された最終分裂後のニューロンに特異的なMeCP2欠損マウスにおいても時期は遅延するものの類似の表現型がみられることから成熟ニューロン機能におけるMeCP2の重要性が確認されている[49][51]。特筆すべきことに、MeCP2欠失マウスにおいて神経系細胞およびニューロンにMeCP2を再発現させると、上述のMeCP2欠失マウスの表現型が改善されることが示されている[50][52]。これらの結果は進行性の重篤な神経疾患を治療することが可能であることを示唆する臨床的にも重要な知見である。
患者の神経生理学的研究から、レット症候群患者において異常に増大した体性感覚誘発電位[53]や脳波におけるてんかん性異常[54]が報告されている。MeCP2-/yモデルマウスでは時折発作性脳波が観察されるが、主に過興奮性発火がみられることが示されている[55]。また、抑制性ニューロンにおいてMeCP2を欠損するマウスは同様に主に過興奮性発火を示すが、発作性脳波は検出されないことが報告されている[55]。MeCP2-/yマウスやMeCP2308/yマウス(308番目のアミノ酸からC末端が欠失した短縮型変異体)の皮質スライスでは、長期増強(long-term potentiation, LTP)の減少がみられること[56]、MeCP2-/yマウスの皮質においては興奮性シナプス伝達の減少と抑制性シナプス伝達の上昇が示されている[57]。また、MeCP2-/yマウス由来の培養海馬ニューロンは自発的な興奮性シナプス伝達の頻度の減少と興奮性シナプス密度の減少を示すことが報告されている[58][59]。これらの報告から、MeCP2は局所の興奮性シナプス伝達と抑制性シナプス伝達のバランスを調節することによってマクロな興奮性/抑制性神経ネットワークの制御に重要な役割を果たしていることが示唆される。
様々な脳領域や細胞種特異的にMecp2を欠損させたコンディショナルノックアウトマウスが作製され、種々の脳部位および神経サブタイプ機能におけるMeCP2の機能が個体レベルで明らかにされてきている。扁桃体特異的コンディショナルノックアウトマウスは、不安様行動の増加と恐怖学習の低下がみられる[60]。視床下部特異的コンディショナルノックアウトマウスは、不安様行動の増加や、攻撃性の上昇、食欲過剰、肥満を示す[61]F。チロシン水酸化酵素 (tyrosine hydroxylase, TH)発現ドーパミンおよびノルアドレナリンニューロン特異コンディショナルノックアウトマウスにおいては、ドーパミンおよびノルアドレナリン量の減少と運動機能障害がみられる[62]。PC12 ETS factor 1 (PET1)発現セロトニンニューロン特異的にMecp2を欠損したマウスは、セロトニン量の減少と攻撃性の上昇を示す[62]。広範な抑制性ニューロンにおけるMecp2の欠損は、短命や呼吸障害、運動機能障害、反復行動、低活動、異常な社会性の上昇、感覚運動遮断の異常、学習障害などレット症候群様の多くの表現型を示す([55]。
一方で、前脳の抑制性ニューロンにおけるMecp2の欠損は、運動機能障害、反復行動、低活動、異常な社会性の上昇、感覚運動遮断の異常、学習障害などいくつかのレット症候群様表現型を示すことが明らかにされている[55]。抑制性ニューロンサブタイプにおけるMeCP2の機能についても研究が行われており、パルアルブミン発現抑制性ニューロン特異的にMecp2を欠損したマウスでは運動機能や感覚情報処理、学習、社会性の異常がみられ、ソマトスタチン発現抑制性ニューロン特異的にMecp2を欠損したマウスにおいてはてんかんや常同運動がみられることが示されている[63]。
実際のレット症候群患者にみられる高頻度にみられるC末端欠失型ナンセンス変異体を模倣したMeCP2R168X/yマウス、MeCP2R255X/yマウス、MeCP2308/yマウスは、運動機能低下、低活動、社会行動低下、不安様行動などのレット症候群患者でみられる多くの表現型を示す[64][65][66]。点変異型ミスセンス変異を模倣したモデルマウスも作製されており部分的なレット症候群表現型を示す([67]。興味深いことに、Mecp2のN末端とC末端を欠失したMBDとNIDを含む短いMeCP2(正常タンパク質のおよそ半分の長さ)を発現するマウスはほぼ正常に近い表現型を示し、Mecp2欠損マウスにこの短いMeCP2を導入することにより表現型の改善がみられることも報告されている[68]。
MECP2重複症候群
MECP2重複症候群はX染色体上にあるMECP2遺伝子を含む領域の重複により引き起こされ、男児に発症する。出生男児10万人に一人の頻度で発症することが報告されている([69]。同じアレル上で重複することが多くみられるが転座例も報告されている。重度の知的障害、運動発達障害、自閉的行動特性、筋緊張低下、反復性の感染症、薬剤抵抗性のてんかんを特徴とする。ほとんどの患者でてんかんが認められ、種々の異常脳波が神経生理学的な異常として報告されている([70][71]。
ヒトMECP2遺伝子をゲノムに挿入しMeCP2を正常量より多く発現するMECP2重複症候群モデルマウスも作製されており、MECP2重複患者にみられるような異常脳波などの神経生理学的表現型の一部を模倣することが報告されている([72]。
過剰なMeCP2の発現を抑制するようにデザインされたアンチセンスオリゴヌクレオチド(ASO)がMECP2重複モデルマウスの表現型を改善することが示され[73][74]、それらの結果を基に現在臨床第1/2相試験が実施されている(ClinicalTrial.gov identifier: NCT06430385)。
その他の疾患との関連
MECP2遺伝子の異常はレット症候群やMECP2重複症候群だけでなく、種々の精神・神経疾患患者にも認められる。これまでに、患者のゲノム解析によりMECP2遺伝子の異常が自閉スペクトラム症(Autism spectrum disorder: ASD)、学習障害 (Intellectual disability: ID)、統合失調症、双極性障害など多様な疾患の発症に寄与することが示されている([6][75]。今後、精神・神経疾患患者の全ゲノムシークエンス (Whole Genome Sequencing: WGS)の普及が進むことによりMECP2遺伝子異常と広範な疾患病態とのさらなる関連の解明が期待される。
関連語
参考文献
- ↑
Lewis, J.D., Meehan, R.R., Henzel, W.J., Maurer-Fogy, I., Jeppesen, P., Klein, F., & Bird, A. (1992).
Purification, sequence, and cellular localization of a novel chromosomal protein that binds to methylated DNA. Cell, 69(6), 905-14. [PubMed:1606614] [WorldCat] [DOI] - ↑
Nan, X., Campoy, F.J., & Bird, A. (1997).
MeCP2 is a transcriptional repressor with abundant binding sites in genomic chromatin. Cell, 88(4), 471-81. [PubMed:9038338] [WorldCat] [DOI] - ↑
Amir, R.E., Van den Veyver, I.B., Wan, M., Tran, C.Q., Francke, U., & Zoghbi, H.Y. (1999).
Rett syndrome is caused by mutations in X-linked MECP2, encoding methyl-CpG-binding protein 2. Nature genetics, 23(2), 185-8. [PubMed:10508514] [WorldCat] [DOI] - ↑
Van Esch, H., Bauters, M., Ignatius, J., Jansen, M., Raynaud, M., Hollanders, K., ..., & Froyen, G. (2005).
Duplication of the MECP2 region is a frequent cause of severe mental retardation and progressive neurological symptoms in males. American journal of human genetics, 77(3), 442-53. [PubMed:16080119] [PMC] [WorldCat] [DOI] - ↑
Meins, M., Lehmann, J., Gerresheim, F., Herchenbach, J., Hagedorn, M., Hameister, K., & Epplen, J.T. (2005).
Submicroscopic duplication in Xq28 causes increased expression of the MECP2 gene in a boy with severe mental retardation and features of Rett syndrome. Journal of medical genetics, 42(2), e12. [PubMed:15689435] [PMC] [WorldCat] [DOI] - ↑ 6.0 6.1 6.2 6.3
Chahrour, M., & Zoghbi, H.Y. (2007).
The story of Rett syndrome: from clinic to neurobiology. Neuron, 56(3), 422-37. [PubMed:17988628] [WorldCat] [DOI] - ↑ 7.0 7.1
Lyst, M.J., & Bird, A. (2015).
Rett syndrome: a complex disorder with simple roots. Nature reviews. Genetics, 16(5), 261-75. [PubMed:25732612] [WorldCat] [DOI] - ↑
Baker, S.A., Chen, L., Wilkins, A.D., Yu, P., Lichtarge, O., & Zoghbi, H.Y. (2013).
An AT-hook domain in MeCP2 determines the clinical course of Rett syndrome and related disorders. Cell, 152(5), 984-96. [PubMed:23452848] [PMC] [WorldCat] [DOI] - ↑
Ohki, I., Shimotake, N., Fujita, N., Jee, J., Ikegami, T., Nakao, M., & Shirakawa, M. (2001).
Solution structure of the methyl-CpG binding domain of human MBD1 in complex with methylated DNA. Cell, 105(4), 487-97. [PubMed:11371345] [WorldCat] [DOI] - ↑
Ho, K.L., McNae, I.W., Schmiedeberg, L., Klose, R.J., Bird, A.P., & Walkinshaw, M.D. (2008).
MeCP2 binding to DNA depends upon hydration at methyl-CpG. Molecular cell, 29(4), 525-31. [PubMed:18313390] [WorldCat] [DOI] - ↑ 11.0 11.1 11.2
Fournier, A., Sasai, N., Nakao, M., & Defossez, P.A. (2012).
The role of methyl-binding proteins in chromatin organization and epigenome maintenance. Briefings in functional genomics, 11(3), 251-64. [PubMed:22184333] [WorldCat] [DOI] - ↑
Hendrich, B., & Tweedie, S. (2003).
The methyl-CpG binding domain and the evolving role of DNA methylation in animals. Trends in genetics : TIG, 19(5), 269-77. [PubMed:12711219] [WorldCat] [DOI] - ↑
Roloff, T.C., Ropers, H.H., & Nuber, U.A. (2003).
Comparative study of methyl-CpG-binding domain proteins. BMC genomics, 4(1), 1. [PubMed:12529184] [PMC] [WorldCat] [DOI] - ↑
Li, H., Yamagata, T., Mori, M., Yasuhara, A., & Momoi, M.Y. (2005).
Mutation analysis of methyl-CpG binding protein family genes in autistic patients. Brain & development, 27(5), 321-5. [PubMed:15967618] [WorldCat] [DOI] - ↑
Cukier, H.N., Rabionet, R., Konidari, I., Rayner-Evans, M.Y., Baltos, M.L., Wright, H.H., ..., & Gilbert, J.R. (2010).
Novel variants identified in methyl-CpG-binding domain genes in autistic individuals. Neurogenetics, 11(3), 291-303. [PubMed:19921286] [PMC] [WorldCat] [DOI] - ↑
Zhao, X., Ueba, T., Christie, B.R., Barkho, B., McConnell, M.J., Nakashima, K., ..., & Gage, F.H. (2003).
Mice lacking methyl-CpG binding protein 1 have deficits in adult neurogenesis and hippocampal function. Proceedings of the National Academy of Sciences of the United States of America, 100(11), 6777-82. [PubMed:12748381] [PMC] [WorldCat] [DOI] - ↑
Allan, A.M., Liang, X., Luo, Y., Pak, C., Li, X., Szulwach, K.E., ..., & Zhao, X. (2008).
The loss of methyl-CpG binding protein 1 leads to autism-like behavioral deficits. Human molecular genetics, 17(13), 2047-57. [PubMed:18385101] [PMC] [WorldCat] [DOI] - ↑
Jobe, E.M., Gao, Y., Eisinger, B.E., Mladucky, J.K., Giuliani, C.C., Kelnhofer, L.E., & Zhao, X. (2017).
Methyl-CpG-Binding Protein MBD1 Regulates Neuronal Lineage Commitment through Maintaining Adult Neural Stem Cell Identity. The Journal of neuroscience : the official journal of the Society for Neuroscience, 37(3), 523-536. [PubMed:28100736] [PMC] [WorldCat] [DOI] - ↑
Pelka, G.J., Watson, C.M., Christodoulou, J., & Tam, P.P. (2005).
Distinct expression profiles of Mecp2 transcripts with different lengths of 3'UTR in the brain and visceral organs during mouse development. Genomics, 85(4), 441-52. [PubMed:15780747] [WorldCat] [DOI] - ↑
Kishi, N., & Macklis, J.D. (2004).
MECP2 is progressively expressed in post-migratory neurons and is involved in neuronal maturation rather than cell fate decisions. Molecular and cellular neurosciences, 27(3), 306-21. [PubMed:15519245] [WorldCat] [DOI] - ↑
Li, C.H., Coffey, E.L., Dall'Agnese, A., Hannett, N.M., Tang, X., Henninger, J.E., ..., & Young, R.A. (2020).
MeCP2 links heterochromatin condensates and neurodevelopmental disease. Nature, 586(7829), 440-444. [PubMed:32698189] [PMC] [WorldCat] [DOI] - ↑ 22.0 22.1 22.2
Young, J.I., Hong, E.P., Castle, J.C., Crespo-Barreto, J., Bowman, A.B., Rose, M.F., ..., & Zoghbi, H.Y. (2005).
Regulation of RNA splicing by the methylation-dependent transcriptional repressor methyl-CpG binding protein 2. Proceedings of the National Academy of Sciences of the United States of America, 102(49), 17551-8. [PubMed:16251272] [PMC] [WorldCat] [DOI] - ↑ 23.0 23.1 23.2
Tsujimura, K., Irie, K., Nakashima, H., Egashira, Y., Fukao, Y., Fujiwara, M., ..., & Nakashima, K. (2015).
miR-199a Links MeCP2 with mTOR Signaling and Its Dysregulation Leads to Rett Syndrome Phenotypes. Cell reports, 12(11), 1887-901. [PubMed:26344767] [WorldCat] [DOI] - ↑ 24.0 24.1 24.2
Nakashima, H., Tsujimura, K., Irie, K., Imamura, T., Trujillo, C.A., Ishizu, M., ..., & Nakashima, K. (2021).
MeCP2 controls neural stem cell fate specification through miR-199a-mediated inhibition of BMP-Smad signaling. Cell reports, 35(7), 109124. [PubMed:34010654] [WorldCat] [DOI] - ↑ 25.0 25.1
Cheng, T.L., Wang, Z., Liao, Q., Zhu, Y., Zhou, W.H., Xu, W., & Qiu, Z. (2014).
MeCP2 suppresses nuclear microRNA processing and dendritic growth by regulating the DGCR8/Drosha complex. Developmental cell, 28(5), 547-60. [PubMed:24636259] [WorldCat] [DOI] - ↑
Jung, B.P., Jugloff, D.G., Zhang, G., Logan, R., Brown, S., & Eubanks, J.H. (2003).
The expression of methyl CpG binding factor MeCP2 correlates with cellular differentiation in the developing rat brain and in cultured cells. Journal of neurobiology, 55(1), 86-96. [PubMed:12605461] [WorldCat] [DOI] - ↑
Albizzati, E., Breccia, M., Florio, E., Cabasino, C., Postogna, F.M., Grassi, R., ..., & Frasca, A. (2024).
Mecp2 knock-out astrocytes affect synaptogenesis by interleukin 6 dependent mechanisms. iScience, 27(3), 109296. [PubMed:38469559] [PMC] [WorldCat] [DOI] - ↑
Cao, Z., Min, X., Xie, X., Huang, M., Liu, Y., Sun, W., ..., & Yuan, J. (2024).
RIPK1 activation in Mecp2-deficient microglia promotes inflammation and glutamate release in RTT. Proceedings of the National Academy of Sciences of the United States of America, 121(6), e2320383121. [PubMed:38289948] [PMC] [WorldCat] [DOI] - ↑
Vashi, N., Ackerley, C., Post, M., & Justice, M.J. (2021).
Aberrant lung lipids cause respiratory impairment in a Mecp2-deficient mouse model of Rett syndrome. Human molecular genetics, 30(22), 2161-2176. [PubMed:34230964] [PMC] [WorldCat] [DOI] - ↑
Klose, R.J., Sarraf, S.A., Schmiedeberg, L., McDermott, S.M., Stancheva, I., & Bird, A.P. (2005).
DNA binding selectivity of MeCP2 due to a requirement for A/T sequences adjacent to methyl-CpG. Molecular cell, 19(5), 667-78. [PubMed:16137622] [WorldCat] [DOI] - ↑
Nan, X., Ng, H.H., Johnson, C.A., Laherty, C.D., Turner, B.M., Eisenman, R.N., & Bird, A. (1998).
Transcriptional repression by the methyl-CpG-binding protein MeCP2 involves a histone deacetylase complex. Nature, 393(6683), 386-9. [PubMed:9620804] [WorldCat] [DOI] - ↑
Harikrishnan, K.N., Chow, M.Z., Baker, E.K., Pal, S., Bassal, S., Brasacchio, D., ..., & El-Osta, A. (2005).
Brahma links the SWI/SNF chromatin-remodeling complex with MeCP2-dependent transcriptional silencing. Nature genetics, 37(3), 254-64. [PubMed:15696166] [WorldCat] [DOI] - ↑
Kimura, H., & Shiota, K. (2003).
Methyl-CpG-binding protein, MeCP2, is a target molecule for maintenance DNA methyltransferase, Dnmt1. The Journal of biological chemistry, 278(7), 4806-12. [PubMed:12473678] [WorldCat] [DOI] - ↑
Buschdorf, J.P., & Strätling, W.H. (2004).
A WW domain binding region in methyl-CpG-binding protein MeCP2: impact on Rett syndrome. Journal of molecular medicine (Berlin, Germany), 82(2), 135-43. [PubMed:14618241] [WorldCat] [DOI] - ↑
Chua, G.N.L., Watters, J.W., Olinares, P.D.B., Begum, M., Vostal, L.E., Luo, J.A., ..., & Liu, S. (2024).
Differential dynamics specify MeCP2 function at nucleosomes and methylated DNA. Nature structural & molecular biology, 31(11), 1789-1797. [PubMed:39164525] [PMC] [WorldCat] [DOI] - ↑ 36.0 36.1
Chahrour, M., Jung, S.Y., Shaw, C., Zhou, X., Wong, S.T., Qin, J., & Zoghbi, H.Y. (2008).
MeCP2, a key contributor to neurological disease, activates and represses transcription. Science (New York, N.Y.), 320(5880), 1224-9. [PubMed:18511691] [PMC] [WorldCat] [DOI] - ↑
Horike, S., Cai, S., Miyano, M., Cheng, J.F., & Kohwi-Shigematsu, T. (2005).
Loss of silent-chromatin looping and impaired imprinting of DLX5 in Rett syndrome. Nature genetics, 37(1), 31-40. [PubMed:15608638] [WorldCat] [DOI] - ↑
Mellén, M., Ayata, P., Dewell, S., Kriaucionis, S., & Heintz, N. (2012).
MeCP2 binds to 5hmC enriched within active genes and accessible chromatin in the nervous system. Cell, 151(7), 1417-30. [PubMed:23260135] [PMC] [WorldCat] [DOI] - ↑
Tudor, M., Akbarian, S., Chen, R.Z., & Jaenisch, R. (2002).
Transcriptional profiling of a mouse model for Rett syndrome reveals subtle transcriptional changes in the brain. Proceedings of the National Academy of Sciences of the United States of America, 99(24), 15536-41. [PubMed:12432090] [PMC] [WorldCat] [DOI] - ↑
Chen, W.G., Chang, Q., Lin, Y., Meissner, A., West, A.E., Griffith, E.C., ..., & Greenberg, M.E. (2003).
Derepression of BDNF transcription involves calcium-dependent phosphorylation of MeCP2. Science (New York, N.Y.), 302(5646), 885-9. [PubMed:14593183] [WorldCat] [DOI] - ↑
Deng, V., Matagne, V., Banine, F., Frerking, M., Ohliger, P., Budden, S., ..., & Ojeda, S.R. (2007).
FXYD1 is an MeCP2 target gene overexpressed in the brains of Rett syndrome patients and Mecp2-null mice. Human molecular genetics, 16(6), 640-50. [PubMed:17309881] [WorldCat] [DOI] - ↑
Itoh, M., Ide, S., Takashima, S., Kudo, S., Nomura, Y., Segawa, M., ..., & Goto, Y. (2007).
Methyl CpG-binding protein 2 (a mutation of which causes Rett syndrome) directly regulates insulin-like growth factor binding protein 3 in mouse and human brains. Journal of neuropathology and experimental neurology, 66(2), 117-23. [PubMed:17278996] [WorldCat] [DOI] - ↑
Chang, Q., Khare, G., Dani, V., Nelson, S., & Jaenisch, R. (2006).
The disease progression of Mecp2 mutant mice is affected by the level of BDNF expression. Neuron, 49(3), 341-8. [PubMed:16446138] [WorldCat] [DOI] - ↑
Chen, Y., Yu, J., Niu, Y., Qin, D., Liu, H., Li, G., ..., & Sun, Y.E. (2017).
Modeling Rett Syndrome Using TALEN-Edited MECP2 Mutant Cynomolgus Monkeys. Cell, 169(5), 945-955.e10. [PubMed:28525759] [PMC] [WorldCat] [DOI] - ↑
Cai, D.C., Wang, Z., Bo, T., Yan, S., Liu, Y., Liu, Z., ..., & Wang, Z. (2020).
MECP2 Duplication Causes Aberrant GABA Pathways, Circuits and Behaviors in Transgenic Monkeys: Neural Mappings to Patients with Autism. The Journal of neuroscience : the official journal of the Society for Neuroscience, 40(19), 3799-3814. [PubMed:32269107] [PMC] [WorldCat] [DOI] - ↑ Rett A., (1966)
Wien Med Wochenschr 116(37), 723-726, - ↑
Hagberg, B., Aicardi, J., Dias, K., & Ramos, O. (1983).
A progressive syndrome of autism, dementia, ataxia, and loss of purposeful hand use in girls: Rett's syndrome: report of 35 cases. Annals of neurology, 14(4), 471-9. [PubMed:6638958] [WorldCat] [DOI] - ↑
Christodoulou, J., Grimm, A., Maher, T., & Bennetts, B. (2003).
RettBASE: The IRSA MECP2 variation database-a new mutation database in evolution. Human mutation, 21(5), 466-72. [PubMed:12673788] [WorldCat] [DOI] - ↑ 49.0 49.1
Chen, R.Z., Akbarian, S., Tudor, M., & Jaenisch, R. (2001).
Deficiency of methyl-CpG binding protein-2 in CNS neurons results in a Rett-like phenotype in mice. Nature genetics, 27(3), 327-31. [PubMed:11242118] [WorldCat] [DOI] - ↑ 50.0 50.1
Guy, J., Hendrich, B., Holmes, M., Martin, J.E., & Bird, A. (2001).
A mouse Mecp2-null mutation causes neurological symptoms that mimic Rett syndrome. Nature genetics, 27(3), 322-6. [PubMed:11242117] [WorldCat] [DOI] - ↑
Gemelli, T., Berton, O., Nelson, E.D., Perrotti, L.I., Jaenisch, R., & Monteggia, L.M. (2006).
Postnatal loss of methyl-CpG binding protein 2 in the forebrain is sufficient to mediate behavioral aspects of Rett syndrome in mice. Biological psychiatry, 59(5), 468-76. [PubMed:16199017] [WorldCat] [DOI] - ↑
Giacometti, E., Luikenhuis, S., Beard, C., & Jaenisch, R. (2007).
Partial rescue of MeCP2 deficiency by postnatal activation of MeCP2. Proceedings of the National Academy of Sciences of the United States of America, 104(6), 1931-6. [PubMed:17267601] [PMC] [WorldCat] [DOI] - ↑
Horsmanheimo, M., Virolainen, M., Nikoskelainen, J., & Fudenberg, H.H. (1978).
Lymphoblastoid cell lines from sarcoid patients. Clinical immunology and immunopathology, 9(4), 419-24. [PubMed:206399] [WorldCat] [DOI] - ↑
Moser, S.J., Weber, P., & Lütschg, J. (2007).
Rett syndrome: clinical and electrophysiologic aspects. Pediatric neurology, 36(2), 95-100. [PubMed:17275660] [WorldCat] [DOI] - ↑ 55.0 55.1 55.2 55.3
Chao, H.T., Chen, H., Samaco, R.C., Xue, M., Chahrour, M., Yoo, J., ..., & Zoghbi, H.Y. (2010).
Dysfunction in GABA signalling mediates autism-like stereotypies and Rett syndrome phenotypes. Nature, 468(7321), 263-9. [PubMed:21068835] [PMC] [WorldCat] [DOI] - ↑
Asaka, Y., Jugloff, D.G., Zhang, L., Eubanks, J.H., & Fitzsimonds, R.M. (2006).
Hippocampal synaptic plasticity is impaired in the Mecp2-null mouse model of Rett syndrome. Neurobiology of disease, 21(1), 217-27. [PubMed:16087343] [WorldCat] [DOI] - ↑
Dani, V.S., Chang, Q., Maffei, A., Turrigiano, G.G., Jaenisch, R., & Nelson, S.B. (2005).
Reduced cortical activity due to a shift in the balance between excitation and inhibition in a mouse model of Rett syndrome. Proceedings of the National Academy of Sciences of the United States of America, 102(35), 12560-5. [PubMed:16116096] [PMC] [WorldCat] [DOI] - ↑
Nelson, E.D., Kavalali, E.T., & Monteggia, L.M. (2006).
MeCP2-dependent transcriptional repression regulates excitatory neurotransmission. Current biology : CB, 16(7), 710-6. [PubMed:16581518] [WorldCat] [DOI] - ↑
Chao, H.T., Zoghbi, H.Y., & Rosenmund, C. (2007).
MeCP2 controls excitatory synaptic strength by regulating glutamatergic synapse number. Neuron, 56(1), 58-65. [PubMed:17920015] [PMC] [WorldCat] [DOI] - ↑
Adachi, M., Autry, A.E., Covington, H.E., & Monteggia, L.M. (2009).
MeCP2-mediated transcription repression in the basolateral amygdala may underlie heightened anxiety in a mouse model of Rett syndrome. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(13), 4218-27. [PubMed:19339616] [PMC] [WorldCat] [DOI] - ↑
Fyffe, S.L., Neul, J.L., Samaco, R.C., Chao, H.T., Ben-Shachar, S., Moretti, P., ..., & Zoghbi, H.Y. (2008).
Deletion of Mecp2 in Sim1-expressing neurons reveals a critical role for MeCP2 in feeding behavior, aggression, and the response to stress. Neuron, 59(6), 947-58. [PubMed:18817733] [PMC] [WorldCat] [DOI] - ↑ 62.0 62.1
Samaco, R.C., Mandel-Brehm, C., Chao, H.T., Ward, C.S., Fyffe-Maricich, S.L., Ren, J., ..., & Neul, J.L. (2009).
Loss of MeCP2 in aminergic neurons causes cell-autonomous defects in neurotransmitter synthesis and specific behavioral abnormalities. Proceedings of the National Academy of Sciences of the United States of America, 106(51), 21966-71. [PubMed:20007372] [PMC] [WorldCat] [DOI] - ↑
Ito-Ishida, A., Ure, K., Chen, H., Swann, J.W., & Zoghbi, H.Y. (2015).
Loss of MeCP2 in Parvalbumin-and Somatostatin-Expressing Neurons in Mice Leads to Distinct Rett Syndrome-like Phenotypes. Neuron, 88(4), 651-8. [PubMed:26590342] [PMC] [WorldCat] [DOI] - ↑
Wegener, E., Brendel, C., Fischer, A., Hülsmann, S., Gärtner, J., & Huppke, P. (2014).
Characterization of the MeCP2R168X knockin mouse model for Rett syndrome. PloS one, 9(12), e115444. [PubMed:25541993] [PMC] [WorldCat] [DOI] - ↑
Pitcher, M.R., Herrera, J.A., Buffington, S.A., Kochukov, M.Y., Merritt, J.K., Fisher, A.R., ..., & Neul, J.L. (2015).
Rett syndrome like phenotypes in the R255X Mecp2 mutant mouse are rescued by MECP2 transgene. Human molecular genetics, 24(9), 2662-72. [PubMed:25634563] [PMC] [WorldCat] [DOI] - ↑
Shahbazian, M., Young, J., Yuva-Paylor, L., Spencer, C., Antalffy, B., Noebels, J., ..., & Zoghbi, H. (2002).
Mice with truncated MeCP2 recapitulate many Rett syndrome features and display hyperacetylation of histone H3. Neuron, 35(2), 243-54. [PubMed:12160743] [WorldCat] [DOI] - ↑
Goffin, D., Allen, M., Zhang, L., Amorim, M., Wang, I.T., Reyes, A.R., ..., & Zhou, Z. (2011).
Rett syndrome mutation MeCP2 T158A disrupts DNA binding, protein stability and ERP responses. Nature neuroscience, 15(2), 274-83. [PubMed:22119903] [PMC] [WorldCat] [DOI] - ↑
Tillotson, R., Selfridge, J., Koerner, M.V., Gadalla, K.K.E., Guy, J., De Sousa, D., ..., & Bird, A. (2017).
Radically truncated MeCP2 rescues Rett syndrome-like neurological defects. Nature, 550(7676), 398-401. [PubMed:29019980] [PMC] [WorldCat] [DOI] - ↑
Giudice-Nairn, P., Downs, J., Wong, K., Wilson, D., Ta, D., Gattas, M., ..., & Leonard, H. (2019).
The incidence, prevalence and clinical features of MECP2 duplication syndrome in Australian children. Journal of paediatrics and child health, 55(11), 1315-1322. [PubMed:30756435] [WorldCat] [DOI] - ↑
Lorenzo, J., Dolce, A., & Lowden, A. (2021).
Electroclinical Features in MECP2 Duplication Syndrome: Pediatric Case Series. Journal of child neurology, 36(12), 1086-1094. [PubMed:34486423] [WorldCat] [DOI] - ↑
Cani, I., Muccioli, L., Mignani, F., Licchetta, L., Tinuper, P., Provini, F., & Bisulli, F. (2022).
MECP2 duplication syndrome: The electroclinical features of a case with long-term evolution. Epilepsy & behavior reports, 19, 100541. [PubMed:35520952] [PMC] [WorldCat] [DOI] - ↑
Collins, A.L., Levenson, J.M., Vilaythong, A.P., Richman, R., Armstrong, D.L., Noebels, J.L., ..., & Zoghbi, H.Y. (2004).
Mild overexpression of MeCP2 causes a progressive neurological disorder in mice. Human molecular genetics, 13(21), 2679-89. [PubMed:15351775] [WorldCat] [DOI] - ↑
Shao, Y., Sztainberg, Y., Wang, Q., Bajikar, S.S., Trostle, A.J., Wan, Y.W., ..., & Zoghbi, H.Y. (2021).
Antisense oligonucleotide therapy in a humanized mouse model of MECP2 duplication syndrome. Science translational medicine, 13(583). [PubMed:33658357] [PMC] [WorldCat] [DOI] - ↑
Sztainberg, Y., Chen, H.M., Swann, J.W., Hao, S., Tang, B., Wu, Z., ..., & Zoghbi, H.Y. (2015).
Reversal of phenotypes in MECP2 duplication mice using genetic rescue or antisense oligonucleotides. Nature, 528(7580), 123-6. [PubMed:26605526] [PMC] [WorldCat] [DOI] - ↑
Wen, Z., Cheng, T.L., Li, G.Z., Sun, S.B., Yu, S.Y., Zhang, Y., ..., & Qiu, Z. (2017).
Identification of autism-related MECP2 mutations by whole-exome sequencing and functional validation. Molecular autism, 8, 43. [PubMed:28785396] [PMC] [WorldCat] [DOI]