「神経突起自己回避」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (同じ利用者による、間の2版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[https://researchmap.jp/K1225/ 桑子 賢一郎]</font><br> | <font size="+1">[https://researchmap.jp/K1225/ 桑子 賢一郎]</font><br> | ||
''島根大学医学部 神経・筋肉生理学''<br> | ''島根大学医学部 神経・筋肉生理学''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2020年7月14日 原稿完成日:2020年7月19日<br> | ||
担当編集委員:[https://researchmap.jp/yamagatm 山形 方人](ハーバード大学・脳科学センター)<br> | 担当編集委員:[https://researchmap.jp/yamagatm 山形 方人](ハーバード大学・脳科学センター)<br> | ||
</div> | </div> | ||
| 12行目: | 12行目: | ||
[[ファイル:Kuwako Fig1.jpg|サムネイル|'''図1. 神経突起の自己回避'''<br>'''(A)''' 細胞表面分子を介した反発作用によって自己の突起の交錯が回避される。この機構により、神経突起は重複を抑えてより広範囲を効率的にカバーする。<br>'''(B)''' それぞれのニューロンは自己回避によって神経突起の重なりを最小限に抑える。一方、細胞集団としては、タイリングによって周辺細胞と重ならずに領域を充填するパターンと、オーバーラップするパターンがある。]] | [[ファイル:Kuwako Fig1.jpg|サムネイル|'''図1. 神経突起の自己回避'''<br>'''(A)''' 細胞表面分子を介した反発作用によって自己の突起の交錯が回避される。この機構により、神経突起は重複を抑えてより広範囲を効率的にカバーする。<br>'''(B)''' それぞれのニューロンは自己回避によって神経突起の重なりを最小限に抑える。一方、細胞集団としては、タイリングによって周辺細胞と重ならずに領域を充填するパターンと、オーバーラップするパターンがある。]] | ||
== 神経突起自己回避とは == | == 神経突起自己回避とは == | ||
神経突起自己回避の概念は、[[wj:ヒル|ヒル]](''[[w:Hirudo medicinalis|Hirudo medicinalis]]'')の[[機械感覚ニューロン]]の軸索の詳細な観察をもとに提唱された<ref><pubmed>5711143</pubmed></ref> | 神経突起自己回避の概念は、[[wj:ヒル|ヒル]](''[[w:Hirudo medicinalis|Hirudo medicinalis]]'')の[[機械感覚ニューロン]]の軸索の詳細な観察をもとに提唱された<ref><pubmed>5711143</pubmed></ref>。すなわち、同じ機械感覚ニューロン由来の分岐した軸索はほとんどオーバーラップせずに空間を埋めるのに対し、異なるニューロン由来の軸索は頻繁に重なり合う。この観察から、神経突起は互いに “自己”か“非自己”を認識して自己を避ける機構が存在する可能性が示唆され、この機構は「自己回避」“self-avoidance”と名付けられた<ref>'''Kramer, A.P. (1982).'''<br>The development of neuronal arborizations in the leech.<br>Neuronal Development: Cellular Approaches in invertebrates, pp882-85</ref><ref><pubmed>6317810</pubmed></ref>('''図1''')。 | ||
一方、領域内でそれぞれのニューロンの神経突起が互いに“非自己”を避けて伸展して隙間なく空間を埋めていく現象を「[[タイリング]]」“tiling”と呼ぶ。[[ショウジョウバエ]][[感覚ニューロン]]と[[マウス]][[網膜]][[スターバーストアマクリン細胞]]は、いずれも自己回避機構によりほとんど交錯しない[[樹状突起]]構造をつくるが、周囲の細胞との関係では、ショウジョウバエ感覚ニューロンはタイリングによって互いを避けながら空間を埋めていくのに対し、スターバーストアマクリン細胞は周囲とオーバーラップして網膜内の空間を埋める('''図1''')。 | 一方、領域内でそれぞれのニューロンの神経突起が互いに“非自己”を避けて伸展して隙間なく空間を埋めていく現象を「[[タイリング]]」“tiling”と呼ぶ。[[ショウジョウバエ]][[感覚ニューロン]]と[[マウス]][[網膜]][[スターバーストアマクリン細胞]]は、いずれも自己回避機構によりほとんど交錯しない[[樹状突起]]構造をつくるが、周囲の細胞との関係では、ショウジョウバエ感覚ニューロンはタイリングによって互いを避けながら空間を埋めていくのに対し、スターバーストアマクリン細胞は周囲とオーバーラップして網膜内の空間を埋める('''図1''')。 | ||
神経突起自己回避は、神経突起上の特定の細胞表面分子の結合を介して起こる。細胞表面分子の下流シグナルによって[[細胞骨格]]が制御されて、神経突起の伸展停止あるいは退縮が起き、結果として局所で自己の神経突起どうしの反発が起こる<ref><pubmed>29972794</pubmed></ref> | 神経突起自己回避は、神経突起上の特定の細胞表面分子の結合を介して起こる。細胞表面分子の下流シグナルによって[[細胞骨格]]が制御されて、神経突起の伸展停止あるいは退縮が起き、結果として局所で自己の神経突起どうしの反発が起こる<ref><pubmed>29972794</pubmed></ref>。これまでに、無脊椎・脊椎動物の様々なニューロンで神経突起の自己回避を制御する細胞表面分子が多数同定されており、それらを欠失させると反発作用が消失して神経突起の著しい交錯がみられるようになる('''図2''')。したがって、神経突起は積極的に自己の接触を回避しなければ正しい空間配置を確立できないと考えられる。実際、ニューロンでは同じホモフィリックな[[接着分子]]が発現しており、それらを介して自然と神経突起が接着して束化してしまうと考えられる。 | ||
神経突起の適切な空間配置は、回路接続や情報処理機能に重要であることから、神経突起自己回避は回路形成の基礎となる非常に重要な機構であるといえる<ref><pubmed> 20573716 </pubmed></ref><ref><pubmed> 26422333 </pubmed></ref>。 | 神経突起の適切な空間配置は、回路接続や情報処理機能に重要であることから、神経突起自己回避は回路形成の基礎となる非常に重要な機構であるといえる<ref><pubmed> 20573716 </pubmed></ref><ref><pubmed> 26422333 </pubmed></ref>。 | ||
| 34行目: | 34行目: | ||
=== ショウジョウバエ === | === ショウジョウバエ === | ||
==== DSCAM1 ==== | ==== DSCAM1 ==== | ||
同種親和性結合能をもつ進化的に保存された細胞接着分子で、細胞外領域には10個の[[免疫グロブリン領域]]と6個の[[フィブロネクチンリピート]]が存在する。[[選択的スプライシング]]によって、細胞外領域には19,008種類のバリアントが存在し、1つのDscam1遺伝子から合計で38,016種類のアイソフォームがつくられる<ref><pubmed>10892653</pubmed></ref> | 同種親和性結合能をもつ進化的に保存された細胞接着分子で、細胞外領域には10個の[[免疫グロブリン領域]]と6個の[[フィブロネクチンリピート]]が存在する。[[選択的スプライシング]]によって、細胞外領域には19,008種類のバリアントが存在し、1つのDscam1遺伝子から合計で38,016種類のアイソフォームがつくられる<ref><pubmed>10892653</pubmed></ref>('''図3''')。DSCAM1は同じアイソフォームどうしが細胞外領域で特異的に結合し、その結果、細胞内領域を介したシグナルにより反発作用を生じる。それぞれのニューロンはランダムにDscam1アイソフォームを発現しているが、同じ細胞由来の突起どうしでは同じアイソフォームが発現しており、それらの同種親和性結合によって反発作用が生じて神経突起の自己回避が起こる<ref><pubmed>15339666</pubmed></ref><ref><pubmed>17889655</pubmed></ref>。 | ||
ショウジョウバエ感覚ニューロンや中枢[[キノコ体]]ニューロンでDscam1を欠失させると、同じニューロン由来の神経突起の自己交錯が著しく増加する('''図2''')<ref><pubmed>15339649</pubmed></ref> | ショウジョウバエ感覚ニューロンや中枢[[キノコ体]]ニューロンでDscam1を欠失させると、同じニューロン由来の神経突起の自己交錯が著しく増加する('''図2''')<ref><pubmed>15339649</pubmed></ref><ref><pubmed>17481395</pubmed></ref><ref><pubmed>17482551</pubmed></ref><ref><pubmed>17481394</pubmed></ref>。ただし、神経突起の自己回避に必要なのはDSCAM1アイソフォームの多様性ではなくあくまで同一アイソフォームによる結合であり、アイソフォームの多様性は自己と非自己の識別に関わるとされている<ref><pubmed>19794492</pubmed></ref>。 | ||
==== インテグリン-ラミニン ==== | ==== インテグリン-ラミニン ==== | ||
ショウジョウバエ感覚ニューロンで発現する細胞接着分子[[インテグリン]]と上皮から分泌される[[ラミニン]]が結合することで樹状突起の自己回避が起こる<ref name=ref22243747 ><pubmed>22243747</pubmed></ref> | ショウジョウバエ感覚ニューロンで発現する細胞接着分子[[インテグリン]]と上皮から分泌される[[ラミニン]]が結合することで樹状突起の自己回避が起こる<ref name=ref22243747 ><pubmed>22243747</pubmed></ref><ref name=ref22243748 ><pubmed>22243748</pubmed></ref>。 | ||
==== Sema2b-プレキシンB ==== | ==== Sema2b-プレキシンB ==== | ||
上皮から分泌される[[Sema2b]]とショウジョウバエ感覚ニューロンで発現する[[プレキシンB]]が結合し、このSema2B-プレキシンBシグナルが[[リン酸化酵素]][[Tricornered]]<ref><pubmed>15479641</pubmed></ref> | 上皮から分泌される[[Sema2b]]とショウジョウバエ感覚ニューロンで発現する[[プレキシンB]]が結合し、このSema2B-プレキシンBシグナルが[[リン酸化酵素]][[Tricornered]]<ref><pubmed>15479641</pubmed></ref>を活性化することで樹状突起の自己回避が起こる<ref name=ref26853303><pubmed>26853303</pubmed></ref>。さらにプレキシンBはインテグリンβサブユニット<ref name=ref22243747 ></ref><ref name=ref22243748 ></ref>や細胞内の[[target of rapamycin complex2]]<ref><pubmed> 19875983</pubmed></ref>とも相互作用することで樹状突起自己回避に関わると考えられる<ref name=ref26853303></ref>。 | ||
==== その他 ==== | ==== その他 ==== | ||
[[ | [[カドヘリン]]ファミリーに属する接着分子[[Flamingo]]はその細胞内領域に[[LIMドメイン]]タンパク質である[[Espinas]]が結合することで反発作用を生み、感覚ニューロンの樹状突起の自己回避を促す<ref><pubmed> 21937715</pubmed></ref>。細胞膜貫通タンパク質である[[Turtle]]の変異体ショウジョウバエは感覚ニューロンの樹状突起自己回避に異常が起こる<ref><pubmed>19783736</pubmed></ref>。Turtleによる樹状突起自己回避は、その細胞内領域を必要としないことからTurtleは[[リガンド]]あるいは共[[受容体]]として機能することで反発作用を生むと考えられる。 | ||
リン酸化酵素[[Hippo]]の変異ショウジョウバエも感覚ニューロンの樹状突起自己回避に異常が起こることから、自己の樹状突起どうしの反発を引き起こす細胞内シグナルとしてはたらいていると考えられる<ref><pubmed>16906135</pubmed></ref> | リン酸化酵素[[Hippo]]の変異ショウジョウバエも感覚ニューロンの樹状突起自己回避に異常が起こることから、自己の樹状突起どうしの反発を引き起こす細胞内シグナルとしてはたらいていると考えられる<ref><pubmed>16906135</pubmed></ref>。ただし、Hippoと樹状突起自己回避を制御する細胞表面分子との関係はわかっていない。 | ||
=== 線虫 === | === 線虫 === | ||
==== SAX-7/MNR-1/DMA-1 ==== | ==== SAX-7/MNR-1/DMA-1 ==== | ||
皮下組織由来のリガンド[[SAX-7]]と[[MNR-1]]の複合体がPVD侵害受容ニューロンで発現する受容体[[DMA-1]]に結合することで樹状突起の自己回避が起こる<ref><pubmed>24120131</pubmed></ref> | 皮下組織由来のリガンド[[SAX-7]]と[[MNR-1]]の複合体がPVD侵害受容ニューロンで発現する受容体[[DMA-1]]に結合することで樹状突起の自己回避が起こる<ref><pubmed>24120131</pubmed></ref><ref><pubmed>24120132</pubmed></ref>。 | ||
==== UNC-6/UNC-40/UNC-5 ==== | ==== UNC-6/UNC-40/UNC-5 ==== | ||
[[UNC-6]]([[ネトリン]])-[[UNC-40]]([[DCC]])シグナルは細胞表面の[[UNC-5]]を介してその下流の[[UNC-34]]、[[WSP-1]], [[UNC-73]], [[MIG-10]]、[[Arp2/3]]複合体による[[アクチン細胞骨格]]制御を促すことでPVD侵害受容ニューロンの樹状突起自己回避を促進する<ref><pubmed>22426253</pubmed></ref> | [[UNC-6]]([[ネトリン]])-[[UNC-40]]([[DCC]])シグナルは細胞表面の[[UNC-5]]を介してその下流の[[UNC-34]]、[[WSP-1]], [[UNC-73]], [[MIG-10]]、[[Arp2/3]]複合体による[[アクチン細胞骨格]]制御を促すことでPVD侵害受容ニューロンの樹状突起自己回避を促進する<ref><pubmed>22426253</pubmed></ref><ref><pubmed>31220078</pubmed></ref>。 | ||
==== その他 ==== | ==== その他 ==== | ||
カドへリンファミリーFlamingo <ref><pubmed>32631831</pubmed></ref> | カドへリンファミリーFlamingo <ref><pubmed>32631831</pubmed></ref>や[[Wnt]]分泌因子[[MIG-14]]/[[Wntless]] <ref><pubmed>29673481</pubmed></ref>、[[前駆体タンパク質変換酵素]][[KPC-1]]/[[Furin]] <ref><pubmed>25232734</pubmed></ref>もPVD侵害受容ニューロンの樹状突起に関わることが報告されている。 | ||
=== マウス === | === マウス === | ||
==== DSCAM ==== | ==== DSCAM ==== | ||
遺伝子は[[DSCAM]]とDSCAML1は2つで、いずれもショウジョウバエDSCAM1のように多様な選択的スプライシングは観察されていないので、分子種としては2種類となり多様性がない。マウス網膜の研究から、脊椎動物のDSCAMは網膜神経節細胞およびアマクリン細胞の、ファミリー分子DSCAML1は[[桿体細胞]]の樹状突起の自己回避に関わる。DSCAMおよびDSCAML1は、直接反発作用を生むのではなく、カドへリンなどの他の分子を介した細胞接着を阻害することで神経突起の過度の接触を防いでいると考えられる<ref><pubmed>19945391</pubmed></ref> | 遺伝子は[[DSCAM]]とDSCAML1は2つで、いずれもショウジョウバエDSCAM1のように多様な選択的スプライシングは観察されていないので、分子種としては2種類となり多様性がない。マウス網膜の研究から、脊椎動物のDSCAMは網膜神経節細胞およびアマクリン細胞の、ファミリー分子DSCAML1は[[桿体細胞]]の樹状突起の自己回避に関わる。DSCAMおよびDSCAML1は、直接反発作用を生むのではなく、カドへリンなどの他の分子を介した細胞接着を阻害することで神経突起の過度の接触を防いでいると考えられる<ref><pubmed>19945391</pubmed></ref><ref><pubmed>30297418</pubmed></ref>。 | ||
==== クラスター型プロトカドヘリン ==== | ==== クラスター型プロトカドヘリン ==== | ||
ショウジョウバエDSCAM1と同じく、アイソフォーム特異的に同種親和性結合能をもつ細胞接着分子である<ref><pubmed>20679223</pubmed></ref> | ショウジョウバエDSCAM1と同じく、アイソフォーム特異的に同種親和性結合能をもつ細胞接着分子である<ref><pubmed>20679223</pubmed></ref>。マウスでは、[[プロトカドヘリン]](Pcdh)α、Pcdhβ、Pcdhγの3つのプロトカドへリンクラスターがあり、プロモーター選択に基づいてそれぞれの遺伝子座から14、22、22種類のアイソフォームが産生されるため、合計で58種類のバリアントが存在する('''図3''')。Pcdhγクラスターをすべて欠失させたノックアウトマウスでは網膜スターバーストアマクリン細胞や小脳プルキンエ細胞で樹状突起の自己回避に著しい異常が生じる<ref><pubmed>22842903</pubmed></ref>('''図2''')。クラスター型プロトカドへリンによる樹状突起自己回避は、ショウジョウバエDSCAM1と同じく、自己の細胞で発現する同一アイソフォームどうしの結合で生じる反発作用によって起こる。 | ||
==== Slit-Robo2 ==== | ==== Slit-Robo2 ==== | ||
小脳プルキンエ細胞の樹状突起自己回避において、プロトカドへリンとは独立してはたらく反発性のリガンドー受容体である。[[Slit2]]および[[Robo2]]はどちらもプルキンエ細胞で発現し、樹状突起の細胞膜上に局在するSlit2とその受容体であるRobo2が結合すると反発シグナルが生じるとされる<ref><pubmed> 24607227 </pubmed></ref> | 小脳プルキンエ細胞の樹状突起自己回避において、プロトカドへリンとは独立してはたらく反発性のリガンドー受容体である。[[Slit2]]および[[Robo2]]はどちらもプルキンエ細胞で発現し、樹状突起の細胞膜上に局在するSlit2とその受容体であるRobo2が結合すると反発シグナルが生じるとされる<ref><pubmed> 24607227 </pubmed></ref>。リン酸化酵素[[LKB1]]-[[SIK]]経路を介してRobo2が樹状突起に選択的に運ばれることがプルキンエ細胞の樹状突起自己回避に必須である<ref><pubmed>30208308</pubmed></ref>。 | ||
==== セマフォリン6A-プレキシンA2/A4 ==== | ==== セマフォリン6A-プレキシンA2/A4 ==== | ||
[[セマフォリン6A]]とその受容体である[[プレキシンA2]]/[[プレキシンA4|A4]]の結合によって、網膜スターバーストアマクリン細胞の樹状突起の自己回避が制御されている<ref><pubmed>22593055</pubmed></ref> | [[セマフォリン6A]]とその受容体である[[プレキシンA2]]/[[プレキシンA4|A4]]の結合によって、網膜スターバーストアマクリン細胞の樹状突起の自己回避が制御されている<ref><pubmed>22593055</pubmed></ref><ref><pubmed>24179230</pubmed></ref>。 | ||
==参考文献== | ==参考文献== | ||
<references /> | <references /> | ||
2020年7月19日 (日) 21:35時点における最新版
桑子 賢一郎
島根大学医学部 神経・筋肉生理学
DOI:10.14931/bsd.9217 原稿受付日:2020年7月14日 原稿完成日:2020年7月19日
担当編集委員:山形 方人(ハーバード大学・脳科学センター)
英語名:neuronal self-avoidance
神経系の発生過程では、多数のニューロンがそれぞれ複数の神経突起突起を伸長させ、分岐させていく。神経突起の自己回避は、1個のニューロンから伸長する神経突起どうしが交錯して絡み合わない現象である。細胞表面分子群を介した局所の反発作用によって自己の突起の交錯が回避される。この機構により、樹状突起や軸索は重複を最小限に抑えるようにできるだけ広がって与えられた空間を効率的にカバーする。例えば、樹状突起のこのような3次元構造は、入力回路との正しいシナプス接続や入力情報の階層的な処理において重要であるとされており神経回路形成の基礎となるシステムである。無脊椎動物・脊椎動物ともにみられる。
神経突起自己回避とは
神経突起自己回避の概念は、ヒル(Hirudo medicinalis)の機械感覚ニューロンの軸索の詳細な観察をもとに提唱された[1]。すなわち、同じ機械感覚ニューロン由来の分岐した軸索はほとんどオーバーラップせずに空間を埋めるのに対し、異なるニューロン由来の軸索は頻繁に重なり合う。この観察から、神経突起は互いに “自己”か“非自己”を認識して自己を避ける機構が存在する可能性が示唆され、この機構は「自己回避」“self-avoidance”と名付けられた[2][3](図1)。
一方、領域内でそれぞれのニューロンの神経突起が互いに“非自己”を避けて伸展して隙間なく空間を埋めていく現象を「タイリング」“tiling”と呼ぶ。ショウジョウバエ感覚ニューロンとマウス網膜スターバーストアマクリン細胞は、いずれも自己回避機構によりほとんど交錯しない樹状突起構造をつくるが、周囲の細胞との関係では、ショウジョウバエ感覚ニューロンはタイリングによって互いを避けながら空間を埋めていくのに対し、スターバーストアマクリン細胞は周囲とオーバーラップして網膜内の空間を埋める(図1)。
神経突起自己回避は、神経突起上の特定の細胞表面分子の結合を介して起こる。細胞表面分子の下流シグナルによって細胞骨格が制御されて、神経突起の伸展停止あるいは退縮が起き、結果として局所で自己の神経突起どうしの反発が起こる[4]。これまでに、無脊椎・脊椎動物の様々なニューロンで神経突起の自己回避を制御する細胞表面分子が多数同定されており、それらを欠失させると反発作用が消失して神経突起の著しい交錯がみられるようになる(図2)。したがって、神経突起は積極的に自己の接触を回避しなければ正しい空間配置を確立できないと考えられる。実際、ニューロンでは同じホモフィリックな接着分子が発現しており、それらを介して自然と神経突起が接着して束化してしまうと考えられる。
神経突起の適切な空間配置は、回路接続や情報処理機能に重要であることから、神経突起自己回避は回路形成の基礎となる非常に重要な機構であるといえる[5][6]。
典型的な神経突起自己回避を示すニューロン群
初期の形態学的な研究では、ヒルの感覚ニューロンやネコの網膜ニューロンが盛んに解析された。その後、遺伝学や分子生物学的解析法の発展に伴い、神経突起自己回避の研究も分子機構に迫る研究が展開され、現在に至っている。
無脊椎動物では神経突起自己回避の研究のほとんどは、ショウジョウバエのdendritic arborization (da) 感覚ニューロンと線虫のPVD侵害受容感覚ニューロンにおいて遺伝学を駆使した変異体解析が行われてきた。
一方、脊椎動物では、マウスの網膜ニューロン、特に網膜神経節細胞とアマクリン細胞の樹状突起を中心に多くの研究が行われてきた。最近は、高度に分岐した単層平面構造の樹状突起をもつ小脳プルキンエ細胞での研究も進められている。いずれのニューロンも自己回避機構によって大きく広がった樹状突起が空間を効率的にカバーする構造をとる。これら以外のニューロンも基本的に自己の神経突起の接触を回避した構造をもつことから、神経突起の自己回避は保存された普遍的なシステムであると考えられる。
制御する分子群
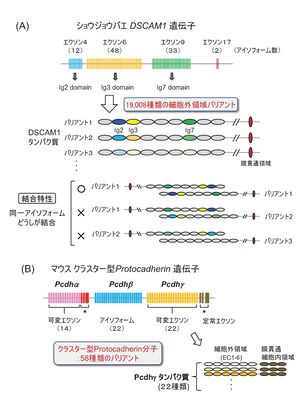
(A) ショウジョウバエDSCAM1は、選択的スプライシングによって19008種類の細胞外領域バリアントが存在する。エクソン4は免疫グロブリン2(Ig2)ドメインを、エクソン6とエクソン9はそれぞれIg3とIg7をコードする。そして、エクソン4、6、9はそれぞれ12、48、33のアイソフォームがある。多くのバリアントが産生されるが、同一のアイソフォームどうしが特異的に結合する。
(B) マウスクラスター型プロトカドヘリン(Pcdh)は、PcdhαとPcdhβ、Pcdhγが遺伝子クラスターを形成しており、細胞外領域の異なるプロトカドヘリン分子が全部で58種類存在する。クラスター型プロトカドヘリンのバリアントは異なるプロモーター選択によって産生される。
これまでにショウジョウバエや線虫、マウスなどのモデル生物において、神経突起の自己回避を直接制御する多くの細胞表面分子が同定されている。なかでも、ショウジョウバエのDSCAM1とマウスのクラスター型プロトカドヘリンは、多様な細胞外ドメインからなる多くのアイソフォームをもつ巨大ファミリー分子で、これらが神経突起表面でのアイソフォームどうしのマッチングによって “自己”あるいは“非自己”を認識し、そして、同じアイソフォームの同種親和性結合を介して自己の突起の反発を引き起こす。
ショウジョウバエ
DSCAM1
同種親和性結合能をもつ進化的に保存された細胞接着分子で、細胞外領域には10個の免疫グロブリン領域と6個のフィブロネクチンリピートが存在する。選択的スプライシングによって、細胞外領域には19,008種類のバリアントが存在し、1つのDscam1遺伝子から合計で38,016種類のアイソフォームがつくられる[7](図3)。DSCAM1は同じアイソフォームどうしが細胞外領域で特異的に結合し、その結果、細胞内領域を介したシグナルにより反発作用を生じる。それぞれのニューロンはランダムにDscam1アイソフォームを発現しているが、同じ細胞由来の突起どうしでは同じアイソフォームが発現しており、それらの同種親和性結合によって反発作用が生じて神経突起の自己回避が起こる[8][9]。
ショウジョウバエ感覚ニューロンや中枢キノコ体ニューロンでDscam1を欠失させると、同じニューロン由来の神経突起の自己交錯が著しく増加する(図2)[10][11][12][13]。ただし、神経突起の自己回避に必要なのはDSCAM1アイソフォームの多様性ではなくあくまで同一アイソフォームによる結合であり、アイソフォームの多様性は自己と非自己の識別に関わるとされている[14]。
インテグリン-ラミニン
ショウジョウバエ感覚ニューロンで発現する細胞接着分子インテグリンと上皮から分泌されるラミニンが結合することで樹状突起の自己回避が起こる[15][16]。
Sema2b-プレキシンB
上皮から分泌されるSema2bとショウジョウバエ感覚ニューロンで発現するプレキシンBが結合し、このSema2B-プレキシンBシグナルがリン酸化酵素Tricornered[17]を活性化することで樹状突起の自己回避が起こる[18]。さらにプレキシンBはインテグリンβサブユニット[15][16]や細胞内のtarget of rapamycin complex2[19]とも相互作用することで樹状突起自己回避に関わると考えられる[18]。
その他
カドヘリンファミリーに属する接着分子Flamingoはその細胞内領域にLIMドメインタンパク質であるEspinasが結合することで反発作用を生み、感覚ニューロンの樹状突起の自己回避を促す[20]。細胞膜貫通タンパク質であるTurtleの変異体ショウジョウバエは感覚ニューロンの樹状突起自己回避に異常が起こる[21]。Turtleによる樹状突起自己回避は、その細胞内領域を必要としないことからTurtleはリガンドあるいは共受容体として機能することで反発作用を生むと考えられる。
リン酸化酵素Hippoの変異ショウジョウバエも感覚ニューロンの樹状突起自己回避に異常が起こることから、自己の樹状突起どうしの反発を引き起こす細胞内シグナルとしてはたらいていると考えられる[22]。ただし、Hippoと樹状突起自己回避を制御する細胞表面分子との関係はわかっていない。
線虫
SAX-7/MNR-1/DMA-1
皮下組織由来のリガンドSAX-7とMNR-1の複合体がPVD侵害受容ニューロンで発現する受容体DMA-1に結合することで樹状突起の自己回避が起こる[23][24]。
UNC-6/UNC-40/UNC-5
UNC-6(ネトリン)-UNC-40(DCC)シグナルは細胞表面のUNC-5を介してその下流のUNC-34、WSP-1, UNC-73, MIG-10、Arp2/3複合体によるアクチン細胞骨格制御を促すことでPVD侵害受容ニューロンの樹状突起自己回避を促進する[25][26]。
その他
カドへリンファミリーFlamingo [27]やWnt分泌因子MIG-14/Wntless [28]、前駆体タンパク質変換酵素KPC-1/Furin [29]もPVD侵害受容ニューロンの樹状突起に関わることが報告されている。
マウス
DSCAM
遺伝子はDSCAMとDSCAML1は2つで、いずれもショウジョウバエDSCAM1のように多様な選択的スプライシングは観察されていないので、分子種としては2種類となり多様性がない。マウス網膜の研究から、脊椎動物のDSCAMは網膜神経節細胞およびアマクリン細胞の、ファミリー分子DSCAML1は桿体細胞の樹状突起の自己回避に関わる。DSCAMおよびDSCAML1は、直接反発作用を生むのではなく、カドへリンなどの他の分子を介した細胞接着を阻害することで神経突起の過度の接触を防いでいると考えられる[30][31]。
クラスター型プロトカドヘリン
ショウジョウバエDSCAM1と同じく、アイソフォーム特異的に同種親和性結合能をもつ細胞接着分子である[32]。マウスでは、プロトカドヘリン(Pcdh)α、Pcdhβ、Pcdhγの3つのプロトカドへリンクラスターがあり、プロモーター選択に基づいてそれぞれの遺伝子座から14、22、22種類のアイソフォームが産生されるため、合計で58種類のバリアントが存在する(図3)。Pcdhγクラスターをすべて欠失させたノックアウトマウスでは網膜スターバーストアマクリン細胞や小脳プルキンエ細胞で樹状突起の自己回避に著しい異常が生じる[33](図2)。クラスター型プロトカドへリンによる樹状突起自己回避は、ショウジョウバエDSCAM1と同じく、自己の細胞で発現する同一アイソフォームどうしの結合で生じる反発作用によって起こる。
Slit-Robo2
小脳プルキンエ細胞の樹状突起自己回避において、プロトカドへリンとは独立してはたらく反発性のリガンドー受容体である。Slit2およびRobo2はどちらもプルキンエ細胞で発現し、樹状突起の細胞膜上に局在するSlit2とその受容体であるRobo2が結合すると反発シグナルが生じるとされる[34]。リン酸化酵素LKB1-SIK経路を介してRobo2が樹状突起に選択的に運ばれることがプルキンエ細胞の樹状突起自己回避に必須である[35]。
セマフォリン6A-プレキシンA2/A4
セマフォリン6Aとその受容体であるプレキシンA2/A4の結合によって、網膜スターバーストアマクリン細胞の樹状突起の自己回避が制御されている[36][37]。
参考文献
- ↑
Nicholls, J.G., & Baylor, D.A. (1968).
Specific modalities and receptive fields of sensory neurons in CNS of the leech. Journal of neurophysiology, 31(5), 740-56. [PubMed:5711143] [WorldCat] [DOI] - ↑ Kramer, A.P. (1982).
The development of neuronal arborizations in the leech.
Neuronal Development: Cellular Approaches in invertebrates, pp882-85 - ↑
Kramer, A.P., & Kuwada, J.Y. (1983).
Formation of the receptive fields of leech mechanosensory neurons during embryonic development. The Journal of neuroscience : the official journal of the Society for Neuroscience, 3(12), 2474-86. [PubMed:6317810] [PMC] [WorldCat] - ↑
Kawabata Galbraith, K., Fujishima, K., Mizuno, H., Lee, S.J., Uemura, T., Sakimura, K., ..., & Kengaku, M. (2018).
MTSS1 Regulation of Actin-Nucleating Formin DAAM1 in Dendritic Filopodia Determines Final Dendritic Configuration of Purkinje Cells. Cell reports, 24(1), 95-106.e9. [PubMed:29972794] [WorldCat] [DOI] - ↑
Grueber, W.B., & Sagasti, A. (2010).
Self-avoidance and tiling: Mechanisms of dendrite and axon spacing. Cold Spring Harbor perspectives in biology, 2(9), a001750. [PubMed:20573716] [PMC] [WorldCat] [DOI] - ↑
Lefebvre, J.L., Sanes, J.R., & Kay, J.N. (2015).
Development of dendritic form and function. Annual review of cell and developmental biology, 31, 741-77. [PubMed:26422333] [WorldCat] [DOI] - ↑
Schmucker, D., Clemens, J.C., Shu, H., Worby, C.A., Xiao, J., Muda, M., ..., & Zipursky, S.L. (2000).
Drosophila Dscam is an axon guidance receptor exhibiting extraordinary molecular diversity. Cell, 101(6), 671-84. [PubMed:10892653] [WorldCat] [DOI] - ↑
Wojtowicz, W.M., Flanagan, J.J., Millard, S.S., Zipursky, S.L., & Clemens, J.C. (2004).
Alternative splicing of Drosophila Dscam generates axon guidance receptors that exhibit isoform-specific homophilic binding. Cell, 118(5), 619-33. [PubMed:15339666] [PMC] [WorldCat] [DOI] - ↑
Wojtowicz, W.M., Wu, W., Andre, I., Qian, B., Baker, D., & Zipursky, S.L. (2007).
A vast repertoire of Dscam binding specificities arises from modular interactions of variable Ig domains. Cell, 130(6), 1134-45. [PubMed:17889655] [PMC] [WorldCat] [DOI] - ↑
Zhan, X.L., Clemens, J.C., Neves, G., Hattori, D., Flanagan, J.J., Hummel, T., ..., & Zipursky, S.L. (2004).
Analysis of Dscam diversity in regulating axon guidance in Drosophila mushroom bodies. Neuron, 43(5), 673-86. [PubMed:15339649] [WorldCat] [DOI] - ↑
Hughes, M.E., Bortnick, R., Tsubouchi, A., Bäumer, P., Kondo, M., Uemura, T., & Schmucker, D. (2007).
Homophilic Dscam interactions control complex dendrite morphogenesis. Neuron, 54(3), 417-27. [PubMed:17481395] [PMC] [WorldCat] [DOI] - ↑
Matthews, B.J., Kim, M.E., Flanagan, J.J., Hattori, D., Clemens, J.C., Zipursky, S.L., & Grueber, W.B. (2007).
Dendrite self-avoidance is controlled by Dscam. Cell, 129(3), 593-604. [PubMed:17482551] [WorldCat] [DOI] - ↑
Soba, P., Zhu, S., Emoto, K., Younger, S., Yang, S.J., Yu, H.H., ..., & Jan, Y.N. (2007).
Drosophila sensory neurons require Dscam for dendritic self-avoidance and proper dendritic field organization. Neuron, 54(3), 403-16. [PubMed:17481394] [PMC] [WorldCat] [DOI] - ↑
Hattori, D., Chen, Y., Matthews, B.J., Salwinski, L., Sabatti, C., Grueber, W.B., & Zipursky, S.L. (2009).
Robust discrimination between self and non-self neurites requires thousands of Dscam1 isoforms. Nature, 461(7264), 644-8. [PubMed:19794492] [PMC] [WorldCat] [DOI] - ↑ 15.0 15.1
Han, C., Wang, D., Soba, P., Zhu, S., Lin, X., Jan, L.Y., & Jan, Y.N. (2012).
Integrins regulate repulsion-mediated dendritic patterning of drosophila sensory neurons by restricting dendrites in a 2D space. Neuron, 73(1), 64-78. [PubMed:22243747] [PMC] [WorldCat] [DOI] - ↑ 16.0 16.1
Kim, M.E., Shrestha, B.R., Blazeski, R., Mason, C.A., & Grueber, W.B. (2012).
Integrins establish dendrite-substrate relationships that promote dendritic self-avoidance and patterning in drosophila sensory neurons. Neuron, 73(1), 79-91. [PubMed:22243748] [PMC] [WorldCat] [DOI] - ↑
Emoto, K., He, Y., Ye, B., Grueber, W.B., Adler, P.N., Jan, L.Y., & Jan, Y.N. (2004).
Control of dendritic branching and tiling by the Tricornered-kinase/Furry signaling pathway in Drosophila sensory neurons. Cell, 119(2), 245-56. [PubMed:15479641] [WorldCat] [DOI] - ↑ 18.0 18.1
Meltzer, S., Yadav, S., Lee, J., Soba, P., Younger, S.H., Jin, P., ..., & Jan, Y.N. (2016).
Epidermis-Derived Semaphorin Promotes Dendrite Self-Avoidance by Regulating Dendrite-Substrate Adhesion in Drosophila Sensory Neurons. Neuron, 89(4), 741-55. [PubMed:26853303] [PMC] [WorldCat] [DOI] - ↑
Koike-Kumagai, M., Yasunaga, K., Morikawa, R., Kanamori, T., & Emoto, K. (2009).
The target of rapamycin complex 2 controls dendritic tiling of Drosophila sensory neurons through the Tricornered kinase signalling pathway. The EMBO journal, 28(24), 3879-92. [PubMed:19875983] [PMC] [WorldCat] [DOI] - ↑
Matsubara, D., Horiuchi, S.Y., Shimono, K., Usui, T., & Uemura, T. (2011).
The seven-pass transmembrane cadherin Flamingo controls dendritic self-avoidance via its binding to a LIM domain protein, Espinas, in Drosophila sensory neurons. Genes & development, 25(18), 1982-96. [PubMed:21937715] [PMC] [WorldCat] [DOI] - ↑
Long, H., Ou, Y., Rao, Y., & van Meyel, D.J. (2009).
Dendrite branching and self-avoidance are controlled by Turtle, a conserved IgSF protein in Drosophila. Development (Cambridge, England), 136(20), 3475-84. [PubMed:19783736] [WorldCat] [DOI] - ↑
Emoto, K., Parrish, J.Z., Jan, L.Y., & Jan, Y.N. (2006).
The tumour suppressor Hippo acts with the NDR kinases in dendritic tiling and maintenance. Nature, 443(7108), 210-3. [PubMed:16906135] [WorldCat] [DOI] - ↑
Dong, X., Liu, O.W., Howell, A.S., & Shen, K. (2013).
An extracellular adhesion molecule complex patterns dendritic branching and morphogenesis. Cell, 155(2), 296-307. [PubMed:24120131] [PMC] [WorldCat] [DOI] - ↑
Salzberg, Y., Díaz-Balzac, C.A., Ramirez-Suarez, N.J., Attreed, M., Tecle, E., Desbois, M., ..., & Bülow, H.E. (2013).
Skin-derived cues control arborization of sensory dendrites in Caenorhabditis elegans. Cell, 155(2), 308-20. [PubMed:24120132] [PMC] [WorldCat] [DOI] - ↑
Smith, C.J., Watson, J.D., VanHoven, M.K., Colón-Ramos, D.A., & Miller, D.M. (2012).
Netrin (UNC-6) mediates dendritic self-avoidance. Nature neuroscience, 15(5), 731-7. [PubMed:22426253] [PMC] [WorldCat] [DOI] - ↑
Sundararajan, L., Smith, C.J., Watson, J.D., Millis, B.A., Tyska, M.J., & Miller, D.M. (2019).
Actin assembly and non-muscle myosin activity drive dendrite retraction in an UNC-6/Netrin dependent self-avoidance response. PLoS genetics, 15(6), e1008228. [PubMed:31220078] [PMC] [WorldCat] [DOI] - ↑
Hsu, H.W., Liao, C.P., Chiang, Y.C., Syu, R.T., & Pan, C.L. (2020).
C. elegans flamingo FMI-1 controls dendrite self-avoidance through F-actin assembly. Development (Cambridge, England). [PubMed:32631831] [WorldCat] [DOI] - ↑
Liao, C.P., Li, H., Lee, H.H., Chien, C.T., & Pan, C.L. (2018).
Cell-Autonomous Regulation of Dendrite Self-Avoidance by the Wnt Secretory Factor MIG-14/Wntless. Neuron, 98(2), 320-334.e6. [PubMed:29673481] [WorldCat] [DOI] - ↑
Salzberg, Y., Ramirez-Suarez, N.J., & Bülow, H.E. (2014).
The proprotein convertase KPC-1/furin controls branching and self-avoidance of sensory dendrites in Caenorhabditis elegans. PLoS genetics, 10(9), e1004657. [PubMed:25232734] [PMC] [WorldCat] [DOI] - ↑
Fuerst, P.G., Bruce, F., Tian, M., Wei, W., Elstrott, J., Feller, M.B., ..., & Burgess, R.W. (2009).
DSCAM and DSCAML1 function in self-avoidance in multiple cell types in the developing mouse retina. Neuron, 64(4), 484-97. [PubMed:19945391] [PMC] [WorldCat] [DOI] - ↑
Garrett, A.M., Khalil, A., Walton, D.O., & Burgess, R.W. (2018).
DSCAM promotes self-avoidance in the developing mouse retina by masking the functions of cadherin superfamily members. Proceedings of the National Academy of Sciences of the United States of America, 115(43), E10216-E10224. [PubMed:30297418] [PMC] [WorldCat] [DOI] - ↑
Schreiner, D., & Weiner, J.A. (2010).
Combinatorial homophilic interaction between gamma-protocadherin multimers greatly expands the molecular diversity of cell adhesion. Proceedings of the National Academy of Sciences of the United States of America, 107(33), 14893-8. [PubMed:20679223] [PMC] [WorldCat] [DOI] - ↑
Lefebvre, J.L., Kostadinov, D., Chen, W.V., Maniatis, T., & Sanes, J.R. (2012).
Protocadherins mediate dendritic self-avoidance in the mammalian nervous system. Nature, 488(7412), 517-21. [PubMed:22842903] [PMC] [WorldCat] [DOI] - ↑
Gibson, D.A., Tymanskyj, S., Yuan, R.C., Leung, H.C., Lefebvre, J.L., Sanes, J.R., ..., & Ma, L. (2014).
Dendrite self-avoidance requires cell-autonomous slit/robo signaling in cerebellar purkinje cells. Neuron, 81(5), 1040-1056. [PubMed:24607227] [PMC] [WorldCat] [DOI] - ↑
Kuwako, K.I., & Okano, H. (2018).
The LKB1-SIK Pathway Controls Dendrite Self-Avoidance in Purkinje Cells. Cell reports, 24(11), 2808-2818.e4. [PubMed:30208308] [WorldCat] [DOI] - ↑
Matsuoka, R.L., Jiang, Z., Samuels, I.S., Nguyen-Ba-Charvet, K.T., Sun, L.O., Peachey, N.S., ..., & Kolodkin, A.L. (2012).
Guidance-cue control of horizontal cell morphology, lamination, and synapse formation in the mammalian outer retina. The Journal of neuroscience : the official journal of the Society for Neuroscience, 32(20), 6859-68. [PubMed:22593055] [PMC] [WorldCat] [DOI] - ↑
Sun, L.O., Jiang, Z., Rivlin-Etzion, M., Hand, R., Brady, C.M., Matsuoka, R.L., ..., & Kolodkin, A.L. (2013).
On and off retinal circuit assembly by divergent molecular mechanisms. Science (New York, N.Y.), 342(6158), 1241974. [PubMed:24179230] [PMC] [WorldCat] [DOI]

