「シナプス接着因子」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/tabuchi 田渕 克彦]</font><br> | <font size="+1">[http://researchmap.jp/tabuchi 田渕 克彦]</font><br> | ||
''信州大学医学部 分子細胞生理学講座''<br> | ''信州大学医学部 分子細胞生理学講座''<br> | ||
DOI XXXX/XXXX 原稿受付日:2012年5月1日 原稿完成日:2013年9月2日<br> | |||
担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所 脳科学総合研究センター)<br> | 担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所 脳科学総合研究センター)<br> | ||
</div> | </div> | ||
2013年9月2日 (月) 09:39時点における版
田渕 克彦
信州大学医学部 分子細胞生理学講座
DOI XXXX/XXXX 原稿受付日:2012年5月1日 原稿完成日:2013年9月2日
担当編集委員:林 康紀(独立行政法人理化学研究所 脳科学総合研究センター)
英語名:synaptic adhesion molecules 英略語:SAMs 独: synaptische Adhäsionsmoleküle 仏:protéine d'adhésion synaptique
同義語:シナプス細胞接着因子、シナプス局在性細胞接着因子、シナプス接着分子
シナプス接着因子とは、細胞接着因子のうちシナプスに局在するもので、細胞外ドメインを介した分子間相互作用により、シナプス前・後終末を架橋し、シナプスの形成や機能面での修飾を担うものである。1回膜貫通型のものは、cis-2量体を形成して機能するものが多く、特にリガンドとtransに結合することによって2量体形成を誘導される場合、これが細胞内シグナル伝達のトリガーとして働くと考えられている。シナプス接着因子の中には、LTP/LTDなど、シナプスの可塑性との関与が示されるもの、自閉症や統合失調症との関係が示唆されるものが多く存在する。細胞外領域の細胞接着ドメインには、LNSドメイン、カドヘリンドメイン、免疫グロブリンドメイン、LRRドメインなどがあり、本項ではこれらのドメイン構造に分けて、それぞれの代表的な分子について説明する。
概要
一般的な細胞接着因子同様、多くのものは1回膜貫通型タンパク質で、細胞外領域に細胞接着に関与するドメイン構造を有する。細胞内領域は軒並み短く、C末にPDZ結合配列を持ち、それを介してシナプス足場タンパク質と結合するタイプのものが多いが、全てがそうではない。接着因子と言う名称から、シナプス同士を単に結び付ける機能をイメージしがちだが、殆どの場合、接着機能だけでなく、シナプス結合を介した細胞内シグナル伝達に関与し、シナプスのダイナミックな形態変化やシナプス伝達機能の調節に寄与している。ただし、シナプス接着因子が伝達する細胞内シグナルに関しては、研究が遅れている。
シナプス形成能のスクリーニングとして、これらの遺伝子を導入した線維芽細胞をニューロンと共培養し、遺伝子導入線維芽細胞表面でのシナプス形成の有無を調べる手法(artificial synapse formation assay)が用いられている[1] 。ただし、この実験でシナプス形成能が確認されたものでも、遺伝子欠損動物でシナプスの形成不全が見られるものはごく一部である。これは、シナプス形成には、複数のシナプス接着因子が機能的にオーバーラップしながら働いているからだと考えられる。
シナプス接着因子の中には、シナプス前終末とシナプス後部の両方に存在してホモ結合により機能するもの、シナプス前終末と後部の両方に存在するが、別の種類の接着因子とヘテロ結合するもの、シナプス前終末ないしは後部のどちらかのみに局在し、それぞれの間でヘテロ結合するものなどがある。また、これらの結合にカルシウムが必要なものと、そうでないものがあり、この性質によって分類されることもある。
シナプス接着因子の中で、自閉症や統合失調症などとの関連が示唆されるものが多い。
接着に関わる細胞外ドメインには、LNS (laminin A, ニューレキシン, and sex hormone-binding protein)ドメイン、カドヘリン (cadherin)ドメイン、免疫グロブリン (immunoglobuline)ドメイン、LRR (leucine-rich repeats)などがあり、これらはしばしばリピート構造を呈している。
ニューレキシン/ニューロリギン
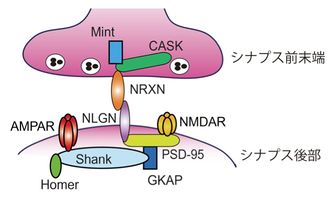
ニューレキシンとニューロリギンはシナプス前末端とシナプス後部間で結合している。ニューレキシンとニューロリギンはそれぞれシナプス前末端とシナプス後部のシナプス局在分子と直接・間接的に結合している。渡辺、二井らによるニューレキシンの項目より。
ニューレキシン
ニューレキシンは、シナプス前終末に局在する1回膜貫通型タンパク質で、哺乳類では3種類の遺伝子が存在する(NRXN1, NRXN2, NRXN3)[2]。それぞれの遺伝子は、上流にあるプロモーターによって転写されるα-ニューレキシンと、遺伝子の中ほどにあるプロモーターによって転写されるβ-ニューレキシンの二つのアイソフォームを産生する[3] 。α-ニューレキシンは、細胞外領域に6個のLNS ドメインと、3個のEGF様リピートを持ち、細胞内領域は短く、C末にPDZ結合配列を有し、これを介してCASKと結合する[4]。β-ニューレキシンは、α-ニューレキシンのうち、1-5番目のLNSドメインと3個のEGF様リピートを欠く構造になっており、N末に短いβ-ニューレキシン特有の配列を持つ以外は、α-ニューレキシンの6番目のLNSドメインからC末にかけて共通の配列を有している。ニューレキシンタンパク質はシナプス後終末にも局在するという報告もあるが、議論が分かれている[5]。
ニューロリギン
ニューロリギンは、β-ニューレキシンとカルシウム依存的に結合する分子として単離された1回膜貫通型タンパク質で、シナプス後部特異的に局在する[6][7]。ヒトでは5種類の遺伝子が存在する(NLGN1, NLGN2, NLGN3, NLGN4X, NLGN4Y)が、げっ歯類ではNLGN4Yに相当するものは確認されていない。ニューロリギンは、細胞外領域にアセチルコリンエステラーゼ様ドメインと、細胞内領域にニューレキシンとは異なるクラスのPDZ結合配列を有し、これを介してPSD-95と結合する[8]。
ニューロリギンのシナプスにおける機能は、各アイソフォームで異なる。NLGN1は、興奮性シナプス後部に局在し、欠損マウスでNMDA型グルタミン酸受容体を介したシナプス伝達の異常をきたす[9]。一方、NLGN2は、抑制性シナプス後部に局在し、欠損マウスでGABA受容体を介したシナプス伝達の異常をきたす[10][11]。NLGN3は興奮性・抑制性両方のシナプス後部に局在するが、海馬や大脳皮質において、欠損マウスで明確なシナプス異常は見られていない[12]。NLGN4は、げっ歯類においてグリシン作動性抑制性シナプスとの関連が示唆されている (但し、げっ歯類のNLGN4がヒトのNLGN4Xの相同分子なのかは議論の余地が残る)[13]。
ニューロリギンとニューレキシンの結合
ニューレキシンとニューロリギンは、シナプス間隙において、互いの細胞外ドメインを介して結合する(図1)。結合様式としては、ニューロリギンがシナプス後終末にcis-2量体として存在し、それぞれのアセリルコリンエステラーゼ様ドメインに、シナプス前終末側から伸びてきたニューレキシンのLNSドメインが、カルシウムイオンを介して1つずつ結合し、ヘテロ4量複合体を形成する[14][15]。ニューレキシンの第4選択的スプライス部位がこの結合の特異性を制御している[16]。ニューレキシンとニューロリギンの結合は、シナプスの形成よりも、成熟により関与していると考えられている[9]。ニューレキシン、Neurolignが細胞内でどのようなシグナル伝達に関与しているかは今のところ殆どわかっていない。
近年、ニューレキシンのリガンドとして、ニューロリギン以外に、LRRTMやCbln1が同定されている[17][18][19]。また、ニューレキシンおよびニューロリギンは自閉症との関連が示唆されており、自閉症患者から見つかったニューロリギン-3の変異を導入したマウスで、社会行動の異常が起こることが確認されている[20]。
カドヘリン
詳細はカドヘリンの項目参照。
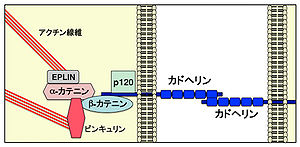
クラッシックカドヘリンは、細胞外領域にECドメイン(青の長方形)を5個もち、その細胞内領域で、カテニン(βカテニン、p120カテニン)と結合する[21]。川内によるカドヘリンの項目より。
古典的カドヘリン
古典的カドヘリン (classical cadherin)は、細胞外に5個のカドヘリンドメイン(EC1-5)を有する1回膜貫通型タンパク質で、カルシウム依存性のホモ結合によって機能している(図2)。これらタンパク質はまずcis 2量体を形成し、このcis 2量体同士が細胞間でtransに結合し、強固な細胞接着を生み出している。古典的カドヘリンの細胞内領域は、カテニン (catenin) ファミリータンパク質と結合し、細胞骨格の再編などに関するシグナル伝達を誘導している。N-カドヘリンは、脳で発現する代表的な古典的カドヘリンであり、シナプスの前および後終末の両方に局在し、ホモ結合によりシナプスを架橋している。N-カドヘリンは、シナプスの発達において広汎な調節的な役割を果たしていると考えられ、カテニンシグナルを介して長期増強現象 (LTP)に伴うシナプス後終末の形態変化を担ったり[22][23]、シナプス前終末でのシナプス小胞の集積に関与していると考えられている[24]。
プロトカドヘリン
プロトカドヘリン (protocadherin)は、細胞外に4-7個のカドヘリンドメインを有し、古典的カドヘリンと異なり、細胞内領域にカテニンファミリーとの結合モチーフを持たない。約80種類のプロトカドヘリン遺伝子が同定されており、これらはクラスター型と非クラスター型に分けられる。クラスター型プロトカドヘリンにはα、β、γの3種類のサブファミリーが存在し、これらをコードする遺伝子がゲノムの同一領域にタンデムに配置されている。これらのタンパク質には可変部位が存在し、エクソンを組み換えることによって約60種類もの異なるタンパク質を作り出す。クラスター型プロトカドヘリンは脳で強く発現しており、シナプス形成の特異性との関連が指摘されている[25]。
その他のカドヘリン分子
その他に、ショウジョウバエではカドヘリンリピートを有するGタンパク質共役型受容体であるFlamingoが、シナプスの特異性の獲得に関与していることが知られている[26]。
Calsynteninもカドヘリン関連タンパク質で、シナプス後膜肥厚に局在しているが、機能は今のところ不明である[27]。
免疫グロブリンドメインタンパク質
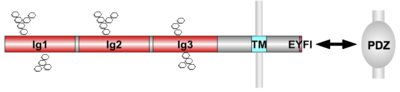
3個の免疫グロブリンドメイン(Ig)が存在し、細胞内C末端の配列EYFIによりPDZドメインタンパク質と結合する。
SynCAM
SynCAM (cell adhesion molecule; CADM)は、細胞外に3個の免疫グロブリンドメイン、細胞内にPFRMとニューレキシン類似のPDZドメイン結合配列をを含む1回膜貫通型タンパク質で、脊椎動物では4種類の遺伝子が知られている(図3)。カルシウム非依存的なホモ結合およびファミリータンパク質間のヘテロ結合による細胞接着を担う。SynCAM同士の結合強度はシアル酸などのNグリカンによって制御されている。SynCAM1の過剰発現で興奮性シナプスの数が増加し、逆に、SynCAM1の欠損により、興奮性シナプスの数や伝達が減少することから、興奮性シナプスの形成維持に寄与していると考えられる[28]。成熟シナプスにおいて、SynCAM1は長期抑制現象 (LTD)を負に制御し、空間学習記憶に影響を与えることが知られている[28]。他のSynCAMファミリータンパク質の脳での機能はまだあまり解析されていないが、SynCAM2とSynCAM1が強く結合すること、SynCAM2がシナプスを誘導すること、SynCAM3/nectin-like molecule1が、軸索末端とグリア細胞の接触面に存在することから、これらがSynCAM1とシナプス形成において機能的にオーバーラップしている可能性が示唆される[29]。
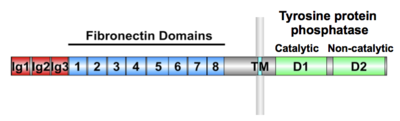
3個の免疫グロブリンドメイン(Ig)、8個のフィブロネクチンドメインが存在する。
LAR-type RPTPs
LAR-type RPTPs (receptor phosphor-tyrosine phosphatase)には、LAR (leukocyte-associated receptor), RPTPσ, RPTPδがある(図4)。これらの細胞外領域は、3つの免疫グロブリンドメインと8つのfibronectin type III repeatからなる。LAR-type RPTPsは細胞内でαリプリンとの結合を介してシナプス形成を起こすと考えられている。細胞外の結合相手としてネトリンGリガンド(NGL)と、神経栄養因子受容体のTrkCが知られており、これらのことからRPTPsがシナプス前終末で機能していることが示唆される。
NCAM/L1
NCAM/L1ファミリーもシナプス形成や機能獲得に関与していることが知られる免疫グロブリンドメインタンパク質である。NCAMはシナプス前終末で神経筋接合部の形成、特にリリースサイトの分布を制御したり[30]、シナプス小胞のリサイクルの機能の成熟に重要な役割を果たしていることが知られている[31]。シナプス後終末では、NCAMがクラスタリングすることにより細胞骨格の足場タンパク質が集積し、LTPの形成に寄与していると考えられている [32]。
その他の免疫グロブリンドメインタンパク質
SidekickやDscamは、網膜においてシナプス形成の位置決定に関与していることが知られている[33][34]。
C. elegansのSyg-1とSyg-2は、1個のニューロン内でシナプスが形成される位置をガイドする役割を果たしている[35]。
LRR (leucine-rich repeat)タンパク質
Leucine-rich repeat transmembrane neuronal proteins
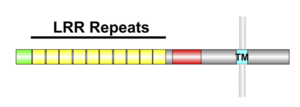
細胞外に10個のleucine-rich repeat (LRR)を持つ。
もともとLeucine-rich repeat transmembrane neuronal proteins (LRRTMs)のシナプス形成能は、artificial synapse formation assay のスクリーニングで見出された[36]。LRRTMs (leucine-rich repeat transmembrane neuronal proteins)は、細胞外領域に10個のLRRを持つ1回膜貫通型タンパク質で、細胞内領域にclass I PDZ結合配列を有する。哺乳類では4つの遺伝子が知られている(LRRTM1-4)(図5)。
ニューレキシンと第4選択的スプライスサイト 依存的に結合し、ニューロリギンとともに、ニューレキシンを介したシナプス成熟因子として注目されている。ニューロリギンがシナプス成熟の比較的後期に働くのに対してLRRTMは、シナプス形成期から成熟初期に働いていると考えられているが、LRRTM1の単独ノックアウトマウス、LRRTMの複数のアイソフォームの同時ノックダウンで、明確なシナプスの数の減少は見られない[37](ただしLRRTM2単独のshRNAによるノックダウンでシナプスの数が減少する報告もある[38] )。LRRTMsは興奮性シナプス特異的に機能していると考えられており、ノックアウトマウスやノックダウンニューロンでAMPA型グルタミン酸受容体を介したシナプス伝達の異常が認められる[39][40]。
Synaptic adhesion like molecules
SALMs (synaptic adhesion like molecules)は、細胞外領域に、N末から順に6個のLRR、単一免疫グロブリンドメイン、fibronectin IIIドメインを含む1回膜貫通型タンパク質で、脊椎動物では5つのSALMsタンパク質が存在する。SALM1-3は細胞内領域のC末にPDZ結合配列を有し、これを介してPSD-95と結合するが、SALM4-5は、PDZ結合配列を持たない。SALMsは、PSD-95との結合を介して興奮性シナプスの形成を促進したり、AMPAやNMDA型グルタミン酸受容体と相互作用することが知られているが、接着因子としての機能はまだよくわかっていない[41][42]。
Netrin-G ligands
Netrin-G ligands (NGLs)はnetrin-G1に結合するものとして同定された1回膜貫通型タンパク質で、LRRC4 (leucine-rich repeat/LRR-containing glycoprotein 4)とも呼ばれる。
細胞外領域にLRR、単一免疫グロブリンドメイン、短い細胞内領域にPDZ結合配列を有し、これを介してPSD-95と結合する。脊椎動物で3種類のNGLs (NGL1-3)が存在する。NGLsはシナプス後終末に局在し、NGL1とNGL2はシナプス前終末のnetrin-G1と-G2と相互作用し、NGL3はLAR-type RPTPsと相互作用する。NGL2の過剰発現でNMDA型グルタミン酸受容体がシナプス後部にリクルートされるが、AMPA型グルタミン酸受容体はリクルートされないことが示されている [43]。
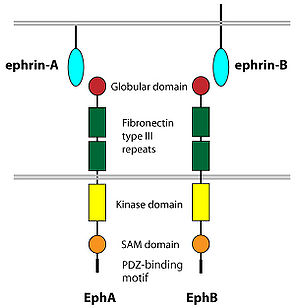
Eph受容体とephrinリガンドの構造。野村によるEph受容体の項目より。
エフリン-Eph受容体型チロシンキナーゼ
詳細はエフリン、Eph受容体の項目参照。 エフリン-Eph受容体型チロシンキナーゼは、リガンドと受容体の関係にあるシグナル誘導タンパク質であるが、シナプスにおける機能も示されている。
エフリン
エフリンは哺乳類では8種類のメンバーがあり、これらは構造の違いからAとBの二つのサブファミリーに分けられる。エフリンA (エフリンA1-5) は、GPI (glycosylphosphatidylinositol)リンカーによって細胞膜に結合しているタイプで、エフリンB (エフリンB1-3) は、1回膜貫通型タンパク質である。
Eph受容体型チロシンキナーゼ
Eph受容体型チロシンキナーゼは16個のメンバー(哺乳類では14個)から成る1回膜貫通型タンパク質で、これらのうち、エフリンAと相互作用するものをEphA (EphA1-EphA8, EphA10), エフリンBと相互作用するものをEphB (EphB1-4, EphB6)として分けられている。エフリンAはGPIアンカーで細胞膜に付着しているため細胞内ドメインが無いが、エフリンB, EphAおよびEphBは細胞内領域を介してシグナル伝達に関わる。特にエフリンBとEphBは、双方向性にシグナル伝達をするため、どちらも受容体とリガンドの両方の側面を有していることになる。またこれらのC末にPDZ結合配列があり、これを介してPICK1, syntenin, GRIP, PDZ-RGSなどと結合する。
EphBは、シナプス後部に局在し、シナプス前終末のエフリンBと結合することによりシナプス後終末で、RhoAやRac1を含むいくつかのRhoファミリー低分子量GTP結合タンパク質と連動し、スパインのアクチン細胞骨格を再構築することが知られている(図6)。EphB1-3の複合欠損マウスでは、シナプス密度の減少と、樹状突起のスパインの形態異常がみられる [44]。海馬ニューロンの培養系において、EphB2はエフリンとの結合を介してシナプス前終末の分化を誘導することが示されている[45]。更にシナプス後終末のEphB2はNMDA型グルタミン酸受容体とシスに相互作用することも示唆されている [46]。
一方、リガンドであるエフリンBはシナプス前終末だけでなく興奮性のシナプス後終末にも存在することが示されており、スパインの密度と成熟やAMPA型グルタミン酸受容体の輸送を促進していると思われる [47]。
Wikipediaより。
インテグリン (integrin)
詳細はインテグリンの項目参照。 インテグリンは、その他の重要な接着因子で、シナプスの成熟を促進する。インテグリンはβ1サブユニットの欠損でLTPに障害が出ることなど、シナプスの生理的機能にも関与している。
関連項目
参考文献
- ↑
Scheiffele, P., Fan, J., Choih, J., Fetter, R., & Serafini, T. (2000).
Neuroligin expressed in nonneuronal cells triggers presynaptic development in contacting axons. Cell, 101(6), 657-69. [PubMed:10892652] [WorldCat] [DOI] - ↑
Ushkaryov, Y.A., Petrenko, A.G., Geppert, M., & Südhof, T.C. (1992).
Neurexins: synaptic cell surface proteins related to the alpha-latrotoxin receptor and laminin. Science (New York, N.Y.), 257(5066), 50-6. [PubMed:1621094] [WorldCat] [DOI] - ↑
Tabuchi, K., & Südhof, T.C. (2002).
Structure and evolution of neurexin genes: insight into the mechanism of alternative splicing. Genomics, 79(6), 849-59. [PubMed:12036300] [WorldCat] [DOI] - ↑
Hata, Y., Butz, S., & Südhof, T.C. (1996).
CASK: a novel dlg/PSD95 homolog with an N-terminal calmodulin-dependent protein kinase domain identified by interaction with neurexins. The Journal of neuroscience : the official journal of the Society for Neuroscience, 16(8), 2488-94. [PubMed:8786425] [WorldCat] - ↑
Taniguchi, H., Gollan, L., Scholl, F.G., Mahadomrongkul, V., Dobler, E., Limthong, N., ..., & Scheiffele, P. (2007).
Silencing of neuroligin function by postsynaptic neurexins. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(11), 2815-24. [PubMed:17360903] [PMC] [WorldCat] [DOI] - ↑
Ichtchenko, K., Hata, Y., Nguyen, T., Ullrich, B., Missler, M., Moomaw, C., & Südhof, T.C. (1995).
Neuroligin 1: a splice site-specific ligand for beta-neurexins. Cell, 81(3), 435-43. [PubMed:7736595] [WorldCat] [DOI] - ↑
Song, J.Y., Ichtchenko, K., Südhof, T.C., & Brose, N. (1999).
Neuroligin 1 is a postsynaptic cell-adhesion molecule of excitatory synapses. Proceedings of the National Academy of Sciences of the United States of America, 96(3), 1100-5. [PubMed:9927700] [PMC] [WorldCat] [DOI] - ↑
Irie, M., Hata, Y., Takeuchi, M., Ichtchenko, K., Toyoda, A., Hirao, K., ..., & Südhof, T.C. (1997).
Binding of neuroligins to PSD-95. Science (New York, N.Y.), 277(5331), 1511-5. [PubMed:9278515] [WorldCat] [DOI] - ↑ 9.0 9.1
Chubykin, A.A., Atasoy, D., Etherton, M.R., Brose, N., Kavalali, E.T., Gibson, J.R., & Südhof, T.C. (2007).
Activity-dependent validation of excitatory versus inhibitory synapses by neuroligin-1 versus neuroligin-2. Neuron, 54(6), 919-31. [PubMed:17582332] [PMC] [WorldCat] [DOI] - ↑
Varoqueaux, F., Jamain, S., & Brose, N. (2004).
Neuroligin 2 is exclusively localized to inhibitory synapses. European journal of cell biology, 83(9), 449-56. [PubMed:15540461] [WorldCat] [DOI] - ↑
Poulopoulos, A., Aramuni, G., Meyer, G., Soykan, T., Hoon, M., Papadopoulos, T., ..., & Varoqueaux, F. (2009).
Neuroligin 2 drives postsynaptic assembly at perisomatic inhibitory synapses through gephyrin and collybistin. Neuron, 63(5), 628-42. [PubMed:19755106] [WorldCat] [DOI] - ↑
Budreck, E.C., & Scheiffele, P. (2007).
Neuroligin-3 is a neuronal adhesion protein at GABAergic and glutamatergic synapses. The European journal of neuroscience, 26(7), 1738-48. [PubMed:17897391] [WorldCat] [DOI] - ↑
Hoon, M., Soykan, T., Falkenburger, B., Hammer, M., Patrizi, A., Schmidt, K.F., ..., & Varoqueaux, F. (2011).
Neuroligin-4 is localized to glycinergic postsynapses and regulates inhibition in the retina. Proceedings of the National Academy of Sciences of the United States of America, 108(7), 3053-8. [PubMed:21282647] [PMC] [WorldCat] [DOI] - ↑
Araç, D., Boucard, A.A., Ozkan, E., Strop, P., Newell, E., Südhof, T.C., & Brunger, A.T. (2007).
Structures of neuroligin-1 and the neuroligin-1/neurexin-1 beta complex reveal specific protein-protein and protein-Ca2+ interactions. Neuron, 56(6), 992-1003. [PubMed:18093522] [WorldCat] [DOI] - ↑
Fabrichny, I.P., Leone, P., Sulzenbacher, G., Comoletti, D., Miller, M.T., Taylor, P., ..., & Marchot, P. (2007).
Structural analysis of the synaptic protein neuroligin and its beta-neurexin complex: determinants for folding and cell adhesion. Neuron, 56(6), 979-91. [PubMed:18093521] [PMC] [WorldCat] [DOI] - ↑
Boucard, A.A., Chubykin, A.A., Comoletti, D., Taylor, P., & Südhof, T.C. (2005).
A splice code for trans-synaptic cell adhesion mediated by binding of neuroligin 1 to alpha- and beta-neurexins. Neuron, 48(2), 229-36. [PubMed:16242404] [WorldCat] [DOI] - ↑
Linhoff, M.W., Laurén, J., Cassidy, R.M., Dobie, F.A., Takahashi, H., Nygaard, H.B., ..., & Craig, A.M. (2009).
An unbiased expression screen for synaptogenic proteins identifies the LRRTM protein family as synaptic organizers. Neuron, 61(5), 734-49. [PubMed:19285470] [PMC] [WorldCat] [DOI] - ↑
Ko, J., Fuccillo, M.V., Malenka, R.C., & Südhof, T.C. (2009).
LRRTM2 functions as a neurexin ligand in promoting excitatory synapse formation. Neuron, 64(6), 791-8. [PubMed:20064387] [PMC] [WorldCat] [DOI] - ↑
Uemura, T., Lee, S.J., Yasumura, M., Takeuchi, T., Yoshida, T., Ra, M., ..., & Mishina, M. (2010).
Trans-synaptic interaction of GluRdelta2 and Neurexin through Cbln1 mediates synapse formation in the cerebellum. Cell, 141(6), 1068-79. [PubMed:20537373] [WorldCat] [DOI] - ↑
Tabuchi, K., Blundell, J., Etherton, M.R., Hammer, R.E., Liu, X., Powell, C.M., & Südhof, T.C. (2007).
A neuroligin-3 mutation implicated in autism increases inhibitory synaptic transmission in mice. Science (New York, N.Y.), 318(5847), 71-6. [PubMed:17823315] [PMC] [WorldCat] [DOI] - ↑
Kawauchi, T. (2012).
Cell adhesion and its endocytic regulation in cell migration during neural development and cancer metastasis. International journal of molecular sciences, 13(4), 4564-90. [PubMed:22605996] [PMC] [WorldCat] [DOI] - ↑
Bozdagi, O., Wang, X.B., Nikitczuk, J.S., Anderson, T.R., Bloss, E.B., Radice, G.L., ..., & Huntley, G.W. (2010).
Persistence of coordinated long-term potentiation and dendritic spine enlargement at mature hippocampal CA1 synapses requires N-cadherin. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(30), 9984-9. [PubMed:20668183] [PMC] [WorldCat] [DOI] - ↑
Mendez, P., De Roo, M., Poglia, L., Klauser, P., & Muller, D. (2010).
N-cadherin mediates plasticity-induced long-term spine stabilization. The Journal of cell biology, 189(3), 589-600. [PubMed:20440002] [PMC] [WorldCat] [DOI] - ↑
Togashi, H., Abe, K., Mizoguchi, A., Takaoka, K., Chisaka, O., & Takeichi, M. (2002).
Cadherin regulates dendritic spine morphogenesis. Neuron, 35(1), 77-89. [PubMed:12123610] [WorldCat] [DOI] - ↑
Phillips, G.R., Tanaka, H., Frank, M., Elste, A., Fidler, L., Benson, D.L., & Colman, D.R. (2003).
Gamma-protocadherins are targeted to subsets of synapses and intracellular organelles in neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(12), 5096-104. [PubMed:12832533] [PMC] [WorldCat] - ↑
Formstone, C.J. (2010).
7TM-Cadherins: developmental roles and future challenges. Advances in experimental medicine and biology, 706, 14-36. [PubMed:21618823] [WorldCat] [DOI] - ↑
Hintsch, G., Zurlinden, A., Meskenaite, V., Steuble, M., Fink-Widmer, K., Kinter, J., & Sonderegger, P. (2002).
The calsyntenins--a family of postsynaptic membrane proteins with distinct neuronal expression patterns. Molecular and cellular neurosciences, 21(3), 393-409. [PubMed:12498782] [WorldCat] - ↑ 28.0 28.1
Robbins, E.M., Krupp, A.J., Perez de Arce, K., Ghosh, A.K., Fogel, A.I., Boucard, A., ..., & Biederer, T. (2010).
SynCAM 1 adhesion dynamically regulates synapse number and impacts plasticity and learning. Neuron, 68(5), 894-906. [PubMed:21145003] [PMC] [WorldCat] [DOI] - ↑
Kakunaga, S., Ikeda, W., Itoh, S., Deguchi-Tawarada, M., Ohtsuka, T., Mizoguchi, A., & Takai, Y. (2005).
Nectin-like molecule-1/TSLL1/SynCAM3: a neural tissue-specific immunoglobulin-like cell-cell adhesion molecule localizing at non-junctional contact sites of presynaptic nerve terminals, axons and glia cell processes. Journal of cell science, 118(Pt 6), 1267-77. [PubMed:15741237] [WorldCat] [DOI] - ↑
Polo-Parada, L., Bose, C.M., Plattner, F., & Landmesser, L.T. (2004).
Distinct roles of different neural cell adhesion molecule (NCAM) isoforms in synaptic maturation revealed by analysis of NCAM 180 kDa isoform-deficient mice. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(8), 1852-64. [PubMed:14985425] [PMC] [WorldCat] [DOI] - ↑
Hata, K., Polo-Parada, L., & Landmesser, L.T. (2007).
Selective targeting of different neural cell adhesion molecule isoforms during motoneuron myotube synapse formation in culture and the switch from an immature to mature form of synaptic vesicle cycling. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(52), 14481-93. [PubMed:18160656] [PMC] [WorldCat] [DOI] - ↑
Muller, D., Wang, C., Skibo, G., Toni, N., Cremer, H., Calaora, V., ..., & Kiss, J.Z. (1996).
PSA-NCAM is required for activity-induced synaptic plasticity. Neuron, 17(3), 413-22. [PubMed:8816705] [WorldCat] [DOI] - ↑
Yamagata, M., Weiner, J.A., & Sanes, J.R. (2002).
Sidekicks: synaptic adhesion molecules that promote lamina-specific connectivity in the retina. Cell, 110(5), 649-60. [PubMed:12230981] [WorldCat] [DOI] - ↑
Yamagata, M., & Sanes, J.R. (2008).
Dscam and Sidekick proteins direct lamina-specific synaptic connections in vertebrate retina. Nature, 451(7177), 465-9. [PubMed:18216854] [WorldCat] [DOI] - ↑
Shen, K., Fetter, R.D., & Bargmann, C.I. (2004).
Synaptic specificity is generated by the synaptic guidepost protein SYG-2 and its receptor, SYG-1. Cell, 116(6), 869-81. [PubMed:15035988] [WorldCat] [DOI] - ↑
Linhoff, M.W., Laurén, J., Cassidy, R.M., Dobie, F.A., Takahashi, H., Nygaard, H.B., ..., & Craig, A.M. (2009).
An unbiased expression screen for synaptogenic proteins identifies the LRRTM protein family as synaptic organizers. Neuron, 61(5), 734-49. [PubMed:19285470] [PMC] [WorldCat] [DOI] - ↑
Linhoff, M.W., Laurén, J., Cassidy, R.M., Dobie, F.A., Takahashi, H., Nygaard, H.B., ..., & Craig, A.M. (2009).
An unbiased expression screen for synaptogenic proteins identifies the LRRTM protein family as synaptic organizers. Neuron, 61(5), 734-49. [PubMed:19285470] [PMC] [WorldCat] [DOI] - ↑
de Wit, J., Sylwestrak, E., O'Sullivan, M.L., Otto, S., Tiglio, K., Savas, J.N., ..., & Ghosh, A. (2009).
LRRTM2 interacts with Neurexin1 and regulates excitatory synapse formation. Neuron, 64(6), 799-806. [PubMed:20064388] [PMC] [WorldCat] [DOI] - ↑
Ko, J., Soler-Llavina, G.J., Fuccillo, M.V., Malenka, R.C., & Südhof, T.C. (2011).
Neuroligins/LRRTMs prevent activity- and Ca2+/calmodulin-dependent synapse elimination in cultured neurons. The Journal of cell biology, 194(2), 323-34. [PubMed:21788371] [PMC] [WorldCat] [DOI] - ↑
Soler-Llavina, G.J., Fuccillo, M.V., Ko, J., Südhof, T.C., & Malenka, R.C. (2011).
The neurexin ligands, neuroligins and leucine-rich repeat transmembrane proteins, perform convergent and divergent synaptic functions in vivo. Proceedings of the National Academy of Sciences of the United States of America, 108(40), 16502-9. [PubMed:21953696] [PMC] [WorldCat] [DOI] - ↑
Ko, J., Kim, S., Chung, H.S., Kim, K., Han, K., Kim, H., ..., & Kim, E. (2006).
SALM synaptic cell adhesion-like molecules regulate the differentiation of excitatory synapses. Neuron, 50(2), 233-45. [PubMed:16630835] [WorldCat] [DOI] - ↑
Wang, C.Y., Chang, K., Petralia, R.S., Wang, Y.X., Seabold, G.K., & Wenthold, R.J. (2006).
A novel family of adhesion-like molecules that interacts with the NMDA receptor. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(8), 2174-83. [PubMed:16495444] [PMC] [WorldCat] [DOI] - ↑
Kim, S., Burette, A., Chung, H.S., Kwon, S.K., Woo, J., Lee, H.W., ..., & Kim, E. (2006).
NGL family PSD-95-interacting adhesion molecules regulate excitatory synapse formation. Nature neuroscience, 9(10), 1294-301. [PubMed:16980967] [WorldCat] [DOI] - ↑
Henkemeyer, M., Itkis, O.S., Ngo, M., Hickmott, P.W., & Ethell, I.M. (2003).
Multiple EphB receptor tyrosine kinases shape dendritic spines in the hippocampus. The Journal of cell biology, 163(6), 1313-26. [PubMed:14691139] [PMC] [WorldCat] [DOI] - ↑
Kayser, M.S., McClelland, A.C., Hughes, E.G., & Dalva, M.B. (2006).
Intracellular and trans-synaptic regulation of glutamatergic synaptogenesis by EphB receptors. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(47), 12152-64. [PubMed:17122040] [PMC] [WorldCat] [DOI] - ↑
Dalva, M.B., Takasu, M.A., Lin, M.Z., Shamah, S.M., Hu, L., Gale, N.W., & Greenberg, M.E. (2000).
EphB receptors interact with NMDA receptors and regulate excitatory synapse formation. Cell, 103(6), 945-56. [PubMed:11136979] [WorldCat] [DOI] - ↑
Segura, I., Essmann, C.L., Weinges, S., & Acker-Palmer, A. (2007).
Grb4 and GIT1 transduce ephrinB reverse signals modulating spine morphogenesis and synapse formation. Nature neuroscience, 10(3), 301-10. [PubMed:17310244] [WorldCat] [DOI]