「シンタキシン」の版間の差分
| (3人の利用者による、間の341版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | |||
<font size="+1">[http://researchmap.jp/tnishiki/?lang=japanese 西木 禎一]</font><br> | |||
''岡山大学 大学院 医歯薬学総合研究科 細胞生理学分野''<br> | |||
DOI:<selfdoi /> 原稿受付日:2015年12月22日 原稿完成日:2015年2月4日<br> | |||
担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](国立研究開発法人理化学研究所 脳科学総合研究センター)<br> | |||
</div> | |||
英語名:syntaxin 英略語:STX | |||
同義語:p35, HPC-1, synaptocanalin | |||
{{box|text= シンタキシンは、開口放出を含め細胞内小胞輸送において膜融合に関わるタンパク質ファミリーおよびそのメンバーである。ヒトを含む哺乳類では、少なくとも16種類のアイソフォームが同定されている。基本的に分子の大部分を細胞質に向けて存在する非常にαへリックスに富んだ分子量約35,000の膜タンパク質である。多くのアイソフォームは脳を含め広く生体内に分布している一方で、脳に特異的に発現するものもある。神経細胞におけるシンタキシンの役割はアイソフォームによって異なり、神経伝達物質の開口放出、カルシウムチャネルの機能調節、シナプス後膜へのグルタミン酸受容体の輸送調節、神経突起の伸長など多岐にわたる。脳での発現が認められていないアイソフォームもあるが、それらを含めシンタキシンファミリーについて概説するとともに、神経機能に重要な役割を果たしているアイソフォームを中心に詳しく説明する。}} | |||
{{Pfam_box | |||
| Symbol = シンタキシン | |||
| Name = シンタキシン | |||
| image = 1br0.pdb | |||
| width = | |||
| caption = シンタキシン1AのN末端領域<ref name=ref1></ref> | |||
| Pfam = PF00804 | |||
| InterPro = IPR006011 | |||
| SMART = SM00503 | |||
| PROSITE = | |||
| SCOP = 1br0 | |||
| TCDB = | |||
| OPM family = 218 | |||
| OPM protein = 3hd7 | |||
| PDB = {{PDB2|1br0}}, {{PDB2|1ez3}}, {{PDB2|1fio}}, {{PDB2|1hs7}}, {{PDB2|1s94}} | |||
}} | |||
== シンタキシンとは == | == シンタキシンとは == | ||
シンタキシンは、細胞内[[小胞輸送]]において膜融合をつかさどるタンパク質ファミリーおよびそのメンバーである。最初に同定されたアイソフォームは、[[シナプス小胞]]タンパク質[[シナプトタグミン]]と結合する分子量約35,000の[[膜タンパク質]]p35Aおよびp35Bとして[[ラット]]脳から単離された<ref name=ref2><pubmed>1321498</pubmed></ref>。両者は異なる遺伝子によりコードされているが、どちらも288個のアミノ酸からなり、その配列は約80%の相同性をもつ。[[シナプス]]小胞のドッキングと[[開口放出]]に関わるとの予測から、「順番に整理して一緒に並べること」を意味する古代ギリシャ語σψνταξισ (syntaxis) にちなみシンタキシンsyntaxinと命名された。ほぼ同時期に複数のグループにより同定されたので、HPC-1<ref><pubmed>1587842 </pubmed></ref>あるいはsynaptocanalin<ref><pubmed>9137572</pubmed></ref>とも呼ばれる。 | |||
シンタキシンファミリーは、[[SNARE]] ([[soluble ''N''-etylmaleimide sensitive fusion protein attachment protein receptor]]の略) と総称される[[膜融合]]関連タンパク質スーパーファミリーの一員でもある。SNAREは、輸送小胞に局在する[[v-SNARE]] (vはvesicularのv) と、標的膜に存在しv-SNAREの受容体となる[[t-SNARE]] (tはtarget-membraneのt) の2種類に大別される<ref><pubmed>8455717</pubmed></ref>。シンタキシンはその局在(後述)からt-SNAREに属するとともに、SNAREモチーフの中央に[[グルタミン]]残基を持つことから、そのアミノ酸一文字表記にならい[[Q-SNARE]]とも分類される<ref><pubmed>9861047</pubmed></ref>。 | |||
== ファミリーメンバー == | |||
[[ファイル:Syntaxin Fig0.png|300px|サムネイル|右|'''図1. 哺乳類のシンタキシンの系統樹'''<br>文献<ref name=ref7><pubmed>11737951</pubmed></ref>の図を基に改変、作成。]] | |||
[[ヒト]]では少なくとも16種類のアイソフォームが存在し、そのうちの多くが[[線虫]]から[[哺乳類]]に至るまで進化的に保存されている('''図1'''、'''表''')<ref name=ref7><pubmed>11737951</pubmed></ref>。なお、シンタキシン12、13、および14はオルソログである。また、ESTデータベースの検索結果から2種類のcDNA断片がシンタキシンのアイソフォームとして同定され、それぞれシンタキシン9([http://www.ncbi.nlm.nih.gov/nucest/1721869/?report=genbank AA150357])および15([http://www.ncbi.nlm.nih.gov/nucest/1875469/ AA244750])と命名されている<ref><pubmed>9144278</pubmed></ref>。 | |||
{| class="wikitable" | |||
|+ 表.シンタキシンアイソフォームの発現分布と主な[[動物]]種のホモログのGENE ID | |||
|- | |||
|style="background-color:#d3d3d3; text-align:center" |アイソフォーム<sup>注)</sup> | |||
|style="background-color:#d3d3d3; text-align:center" |生体内分布 | |||
|style="background-color:#d3d3d3; text-align:center" |細胞内局在 | |||
|style="background-color:#d3d3d3; text-align:center" |ヒト | |||
|style="background-color:#d3d3d3; text-align:center" |[[マウス]] | |||
|style="background-color:#d3d3d3; text-align:center" |[[ラット]] | |||
|style="background-color:#d3d3d3; text-align:center" |[[ショウジョウバエ]] | |||
|style="background-color:#d3d3d3; text-align:center" |線虫 | |||
|- | |||
|<b>[[シンタキシン1A|1A]]</b><ref name=ref2><pubmed>1321498</pubmed></ref> | |||
|神経組織、[[分泌]]組織 | |||
|[[細胞膜]] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=6804 6804] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=20907 20907] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=116470 116470] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=42854 42854] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=176743 176743] | |||
|- | |||
|<b>[[シンタキシン1B|1B]]</b><ref name=ref2><pubmed>1321498</pubmed></ref> | |||
|神経組織、分泌組織 | |||
|細胞膜 | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=112755 112755] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=56216 56216] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=24923 24923] | |||
|なし | |||
|なし | |||
|- | |||
|[[シンタキシン2|2]]<ref name=ref9><pubmed>7690687</pubmed></ref> | |||
(別名[[エピモルフィン]]) | |||
|広範な器官 | |||
(特に[[脾臓]]、[[肝臓]]、[[精巣]]) | |||
|細胞膜 | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=2054 2054] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=13852 13852] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=25130 25130] | |||
|なし | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=181505 181505] | |||
|- | |||
|<b>[[シンタキシン3|3]]</b><ref name=ref9><pubmed>7690687</pubmed></ref> | |||
|広範な器官 | |||
(特に脾臓、肺、[[腎臓]]) | |||
|細胞膜 | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=6809 6809] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=20908 20908] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=81802 81802] | |||
|なし | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=3565871 3565871] | |||
|- | |||
|<b>[[シンタキシン4|4]]</b><ref name=ref9><pubmed>7690687</pubmed></ref> | |||
|広範な器官 | |||
(特に[[心臓]]) | |||
|細胞膜 | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=6810 6810] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=20909 20909] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=81803 81803] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=31269 31269] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=177647 177647] | |||
|- | |||
|[[シンタキシン5|5]]<ref name=ref9><pubmed>7690687</pubmed></ref> | |||
|広範な器官 | |||
(特に脾臓、肝臓、精巣) | |||
|[[小胞体]]–[[ゴルジ体]]中間区画 | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=6811 6811] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=56389 56389] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=65134 65134] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=34966 34966] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=179611 179611] | |||
|- | |||
|<b>[[シンタキシン6|6]]</b><ref><pubmed>8663448</pubmed></ref> | |||
|広範な器官 | |||
|[[トランスゴルジ網]](TGN) | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=10228 10228] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=58244 58244] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=60562 60562] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=40373 40373] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=259698 259698] | |||
|- | |||
|<b>[[シンタキシン7|7]]</b><ref><pubmed>9358037</pubmed></ref> | |||
|広範な器官 | |||
|初期および後期[[エンドソーム]] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=8417 8417] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=53331 53331] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=60466 60466] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=36173 36173] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=172718 172718] | |||
|- | |||
|<b>[[シンタキシン8|8]]</b><ref name=ref13><pubmed>9852078</pubmed></ref> | |||
|広範な器官 | |||
(特に心臓) | |||
|初期および[[後期エンドソーム]] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=9482 9482] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=55943 55943] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=59074 59074] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=39847 39847] | |||
|なし | |||
|- | |||
|[[シンタキシン10|10]]<ref><pubmed>9446797</pubmed></ref> | |||
|広範な器官 | |||
(特に心臓、[[骨格筋]]、[[膵臓]]) | |||
|トランス[[ゴルジ]]網(TGN) | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=8677 8677] | |||
|なし | |||
|なし | |||
|なし | |||
|なし | |||
|- | |||
|[[シンタキシン11|11]]<ref><pubmed>9571206</pubmed></ref> | |||
|広範な器官 | |||
(特に心臓、[[胎盤]]) | |||
|トランスゴルジ網(TGN) | |||
後期エンドソーム | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=8676 8676] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=74732 74732] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=292483 292483] | |||
|なし | |||
|なし | |||
|- | |||
|<b>[[シンタキシン12|12]]</b><ref><pubmed>9507000</pubmed></ref>/<b>[[シンタキシン13|13]]</b><ref><pubmed>9553086</pubmed></ref>/[[シンタキシン14|14]] | |||
|広範な器官 | |||
|初期エンドソーム | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=23673 23673] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=100226 100226] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=65033 65033] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=39485 39485] | |||
|なし | |||
|- | |||
|<b>[[シンタキシン16|16]]</b><ref><pubmed>9464276</pubmed></ref> | |||
|広範な器官 | |||
(特に心臓、膵臓) | |||
|トランスゴルジ網(TGN) | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=8675 8675] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=228960 228960] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=362283 362283] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=33034 33034] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=175712 175712] | |||
|- | |||
|<b>[[シンタキシン17|17]]</b><ref name=ref13><pubmed>9852078</pubmed></ref> | |||
|広範な器官 | |||
(特に肝臓、精巣) | |||
|小胞体 | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=55014 55014] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=67727 67727] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=252853 252853] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=38541 38541] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=172663 172663] | |||
|- | |||
|<b>[[シンタキシン18|18]]</b><ref><pubmed>10788491</pubmed></ref> | |||
|少なくとも脳 | |||
|小胞体 | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=53407 53407] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=71116 71116] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=360953 360953] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=42933 42933] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=179055 179055] | |||
|- | |||
|[[シンタキシン19|19]] | |||
|不明 | |||
|不明 | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=415117 415117] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=68159 68159] | |||
|[http://www.ncbi.nlm.nih.gov/gene/?term=685180 685180] | |||
|なし | |||
|なし | |||
|} | |||
<sup>注)</sup>太字は脳での発現が確認されているものを示す。 | |||
== 構造 == | == 構造 == | ||
[[ファイル:Syntaxin Fig1.png|300px|サムネイル|右|''' | [[ファイル:Syntaxin Fig1.png|300px|サムネイル|右|'''図2. 代表的なシンタキシンのドメイン構造''']] | ||
シンタキシンは、約250から300アミノ酸からなる膜タンパク質(膜貫通ドメインを欠くアイソフォーム11を除く)である。主にαへリックスからなる複数のドメインがリンカーでつながれた構造をしている('''図2''')。カルボキシ末端の一箇所の膜貫通ドメイン(アイソフォーム7は二箇所)が膜に埋め込まれ、分子の大部分を細胞質に向けて存在している。 | |||
アイソフォーム6、8、10以外のシンタキシンは、アミノ末端に[[Munc-18]]との結合に関わる約20のアミノ酸残基からなるNペプチドモチーフをもつ(後述)<ref><pubmed>21139055</pubmed></ref>。 | |||
アミノ末端側のHabcと呼ばれるドメインでは、3本の[[wj:αへリックス|αへリックス]]が逆平行に結合し束になっている<ref name=ref1><pubmed>9753330</pubmed></ref><ref><pubmed>10913252</pubmed></ref>。Habcに続くリンカーはフレキシブルで<ref><pubmed>12680753</pubmed></ref>、Habcは次のH3ドメインに折り重なることよりシンタキシンの膜融合能を制御する負の調節ドメインとして働く<ref><pubmed>10535962</pubmed></ref>。 | |||
シンタキシンのカルボキシ末端側3分の1は、膜融合能を発揮するのに必要最小限の領域である。SNAREモチーフを含むH3ドメインは対になる他のSNAREと結合し、膜融合能をもつ[[SNARE複合体]]を形成する<ref name=ref9100028><pubmed>9100028</pubmed></ref>。実際、H3ドメインと膜貫通ドメインからなるシンタキシン1の組換えフラグメントを[[SNAP-25]]ととともに再構成した人工脂質小胞は、[[シナプトブレビン]]2を再構成した人工脂質小胞と自発的に融合する<ref><pubmed>9529252</pubmed></ref>。 | |||
単量体のシンタキシンは、活性化状態と不活性状態を移行する<ref><pubmed>14668446</pubmed></ref>。活性化状態では、HabcとH3が解離したいわゆる開いた構造をとり、対になるSNAREと結合できる。これに対し、HabcがH3に折り重なった閉じた構造になると不活性型となり、SNARE複合体を形成できない<ref><pubmed>18458823</pubmed></ref><ref><pubmed>10449403 </pubmed></ref>。 | |||
== 生体内および細胞内分布 == | == 生体内および細胞内分布 == | ||
生体内においてシンタキシンの大部分のアイソフォームは広範な器官に分布しており、そのうちアイソフォーム3、4、6、7、8、12/13、16、17および18は脳にも発現している(表)。一方、シンタキシン1Aおよび1Bは、脳などの神経組織および副腎髄質などの分泌組織に特異的に発現している。 | |||
ニューロンにおいてシンタキシン1は、主に[[シナプス前膜]] | 神経系においてシンタキシン1は、[[大脳皮質]]、[[海馬]]、[[小脳]]、[[脊髄]]、[[網膜]]のシナプスが豊富な領域に観察される<ref><pubmed>8361334</pubmed></ref>。[[有郭乳頭味蕾]]<ref><pubmed>17447252</pubmed></ref>、[[蝸牛]]内の[[コルチ器]]<ref><pubmed>10103074</pubmed></ref>、[[松果体]]細胞<ref><pubmed>8593674</pubmed></ref> にも存在する。神経系だけでなく、発生学的にニューロンと同じ外胚葉由来の[[副腎髄質]]にも発現している<ref name=ref7818508><pubmed>7818508</pubmed></ref>。[[中枢神経系]]および[[末梢神経系]]の両方において、1Aと1Bの分布は異なる<ref><pubmed>10197765</pubmed></ref><ref><pubmed>8996803</pubmed></ref>。 | ||
細胞内において、16種類のアイソフォームのうちシンタキシン1(AおよびB)から4までの5種類は[[形質膜]]に局在しており、残りは小胞体、[[ゴルジ体]]、トランスゴルジ網、[[エンドソーム]]などに局在している(表)。 | |||
ニューロンにおいてシンタキシン1は、主に[[シナプス前膜]]を含む細胞膜に局在する一方、シナプス小胞膜にも認められる<ref><pubmed>8301329</pubmed></ref><ref><pubmed>7698978</pubmed></ref><ref><pubmed>23821748 </pubmed></ref>。小脳皮質においては、ほとんどの[[グルタミン酸]]作動性終末と、一部の[[GABA]]作動性シナプスに局在する<ref><pubmed>22094010 </pubmed></ref>。その他にも、[[視索上核]]の[[オキシトシン]]ニューロンでは[[軸索終末]]だけでなく[[細胞体]]や[[樹状突起]]に発現が見られるとともに<ref><pubmed>21988098</pubmed></ref>、[[ヒヨコ]]の[[毛様体神経節]]の杯状シナプス前部<ref><pubmed>15102922</pubmed></ref>、[[カエル]]の[[運動神経終末]]<ref><pubmed>8963446</pubmed></ref>にも存在する。[[アストロサイト]]にも発現している<ref><pubmed>9098527</pubmed></ref><ref><pubmed>21656854</pubmed></ref>。 | |||
[[初代培養]]した海馬ニューロンにおいて、シンタキシン3は細胞体や樹状突起に加え[[成長円錐]]にも<ref name=ref44><pubmed>16598260</pubmed></ref>、シンタキシン4<ref name=ref45><pubmed>20434989</pubmed></ref>および12/13<ref name=ref46><pubmed>20098723</pubmed></ref>および16<ref><pubmed>17852734</pubmed></ref>はスパインを含め樹状突起に存在する。金魚の網膜のリボンシナプスには、シンタキシン3の選択的スプライシングアイソフォームBが発現している<ref name=ref48><pubmed>20060037</pubmed></ref>。 | |||
== 翻訳後修飾 == | == 翻訳後修飾 == | ||
シンタキシン1は、[[PKC]]および[[CaMKII]]<ref name=ref8876242><pubmed>8876242</pubmed></ref><ref name=ref9930733><pubmed>9930733</pubmed></ref> 、[[カゼインキナーゼ1]]および[[カゼインキナーゼ2|2]]<ref><pubmed> 11846792</pubmed></ref><ref name=ref2></ref><ref name=ref9930733></ref><ref><pubmed> 10844023 </pubmed></ref><ref><pubmed> 15822905 </pubmed></ref>により[[リン酸化]]される。[[PKA]]については議論が分かれている<ref name=ref8876242></ref><ref name=ref9930733></ref>。リン酸化以外に、[[ニトロ化]]<ref><pubmed> 10913827 </pubmed></ref>、[[Sニトロシル化]]<ref><pubmed>18452404</pubmed></ref>、[[パルミトイル化]]<ref><pubmed> 19508429 </pubmed></ref>を受け、[[ユビキチン]]-[[プロテアソーム]]経路により分解される<ref><pubmed>12121982</pubmed></ref>。 | |||
== 結合タンパク質 == | == 結合タンパク質 == | ||
シンタキシンは自身と同じ膜に局在する別のt-SNAREと結合するとともに、さらに輸送されて来る小胞に局在するv-SNAREとも結合して[[SNARE複合体]]を形成し膜融合能を発揮する。さらにシンタキシンには、[[SNARE複合体]]形成を制御するタンパク質の多くが結合する。この節では、他の分子との結合が最も良く調べられているシンタキシン1の主な結合タンパク質を紹介する。他のアイソフォームでは、シンタキシ4はF[[アクチン]]と<ref><pubmed>18285343</pubmed></ref>、シンタキシン13はシナプス後部の[[足場タンパク質]]Homer1c(別名Vesl-1L)<ref><pubmed>10833436</pubmed></ref>、NEEP21(neuron-enriched endosomal protein of 21 kDa)<ref><pubmed>12070131</pubmed></ref>、およびGRASP-1(GRIP-associated protein-1))<ref name=ref46 />と結合することが報告されている。 | |||
=== SNARE(SNAP-25およびシナプトブレビン) === | === SNARE(SNAP-25およびシナプトブレビン) === | ||
シンタキシン1は、同じくt- | シンタキシン1は、同じくt-SNAREである[[SNAP-25]]と自身のH3ドメインを介し結合する<ref name=ref9100028><pubmed>9100028</pubmed></ref>。会合比により2種類の複合体が存在する。1:1で結合したt-SNAREヘテロニ量体は、v-SNAREである[[シナプトブレビン]](別名VAMP)と結合し[[SNARE複合体]]を形成する。一方、シンタキシン二分子に[[SNAP-25]]が一分子結合した2:1複合体(通称)は、シナプトブレビンと結合できない<ref><pubmed>9346956</pubmed></ref>。したがって、[[シナプス前終末]]の放出部位では、別の分子により1:1複合体の状態が維持されていると予想される。 | ||
[[ファイル:Syntaxin Fig.png|300px|サムネイル|右|''' | |||
[[ファイル:Syntaxin Fig.png|300px|サムネイル|右|'''図3. 開口放出前に形成されるSNARE複合体の立体構造模式図''' <br>シンタキシンは赤で描いている。緑はSNAP-25を、青はシナプトブレビンをそれぞれ示す。明らかにされているSNARE複合体とHabcドメインの立体構造に、膜貫通ドメインを表す円柱とリンカー等を表す点線を書き加えた。]] | |||
シンタキシン1、[[SNAP-25]]、および[[シナプトブレビン]]が1:1:1の比で結合した[[SNARE複合体]]は、[[wikipedia:ja:コイルドコイル構造|コイルドコイル構造]]をもつ<ref><pubmed>9759724</pubmed></ref>。よく目にするシナプス小胞膜と[[シナプス前]]膜との間で形成されている[[SNARE複合体]]の模式図は、シンタキシンのH3ドメインと[[SNAP-25]]および[[シナプトブレビン]]の細胞質フラグメントからなる複合体の立体構造解析結果に膜貫通領域などを描き足したものである(図3)。組織を可溶化した後などに溶液中に存在する[[SNARE複合体]]は強固に結合しており、強力な[[wikipedia:ja:界面活性剤|界面活性剤]]に対しても耐性を持ち、[[wikipedia:ja:ラウリル硫酸ナトリウム|ラウリル硫酸ナトリウム]](SDS)存在下でも煮沸しない限り解離しない<ref><pubmed>7957071</pubmed></ref>。 | |||
=== シナプトタグミン === | === シナプトタグミン === | ||
シンタキシン1は、H3ドメインを介して神経伝達物質放出の[[カルシウムイオン]]センサーと考えられている[[シナプトタグミン]]1と結合する<ref><pubmed>18275379</pubmed></ref><ref><pubmed>22068972</pubmed></ref>。カルシウムイオン非存在下では、シナプトタグミンのC<sub>2</sub>Bドメインと結合する<ref><pubmed>12496268</pubmed></ref><ref><pubmed>22008253 </pubmed></ref>。[[wikipedia:ja:大腸菌|大腸菌]]で発現させた組換えタンパク質同士の結合は、結合実験に用いるフラグメントの大きさや付加するタグによって、特にカルシウムイオンの要求性に、大きな影響を受ける<ref><pubmed>8604041</pubmed></ref>。ある条件下ではシンタキシンとシナプトタグミンの結合はカルシウム依存性であり<ref><pubmed>7791877</pubmed></ref>、シナプトタグミンのC<sub>2</sub>Aドメインへのカルシウムイオンの結合が必須である<ref><pubmed>9010211</pubmed></ref>。しかし、C<sub>2</sub>Aのカルシウム結合能を欠失させた変異シナプトタグミンを発現させたニューロンで神経伝達物質の放出に異常が認められないことから<ref><pubmed>12110845</pubmed></ref>、シンタキシンとシナプトグミンの[[カルシウム]]依存性結合の伝達物質放出における意義は不明である。 | |||
===コンプレキシン === | ===コンプレキシン === | ||
シンタキシンは、SNARE複合体による膜融合を一時停止させる役割を持つとされるシナプスタンパク質[[コンプレキシン]](別名[[シナフィン]])とH3を介して結合する<ref><pubmed>7553862</pubmed></ref><ref><pubmed>9302098</pubmed></ref>。シンタキシン1を含むSNARE複合体とコンプレキシンの中央部分の結合状態の立体構造が明らかにされている<ref><pubmed>11832227</pubmed></ref>。シンタキシン1と同じく細胞膜に局在するシンタキシン2および3もコンプレキシンと結合するが、シンタキシン4は結合能を欠く<ref><pubmed>10777504</pubmed></ref>。 | |||
=== Munc-18 === | === Munc-18 === | ||
小胞のドッキングあるいはプライミングに関与する[[Munc-18]](別名n-Sec1)のシンタキシンへの結合は、当初SNARE複合体の形成を阻害するとされていた<ref><pubmed>8247129</pubmed></ref><ref><pubmed>8108429</pubmed></ref>。これは、単純化された結合実験において、シンタキシン1のNペプチドにMunc18が結合している時はその閉構造が安定化し<ref><pubmed>23561535</pubmed></ref>、SNAP-25と結合できないためである<ref><pubmed>18337752</pubmed></ref> 。しかしその後、Munc-18と結合したシンタキシン1でも[[Munc-13]]存在下では開構造へと変形し<ref><pubmed>10366611</pubmed></ref>、SNARE複合体を形成できることが明らかにされた(後述)<ref><pubmed>17002520</pubmed></ref><ref><pubmed>17301226</pubmed></ref><ref><pubmed>17264080</pubmed></ref>。このように、Munc-18は、シンタキシン1の開閉構造に応じた二種類の結合様式でモノメリックなシンタキシン1とSNARE複合体中のシンタキシン1の両方に結合することができる。シンタキシン1とMunc-18の結合は、両者のリン酸化<ref><pubmed>8631738</pubmed></ref><ref><pubmed>9478941</pubmed></ref><ref><pubmed>12730201</pubmed></ref><ref><pubmed>19748891</pubmed></ref>や、[[アラキドン酸]]<ref><pubmed>17363971</pubmed></ref>および[[スフィンゴシン]]<ref><pubmed>19390577</pubmed></ref>により制御される。シンタキシンとMunc-18の複合体の立体構造も明らかにされている<ref><pubmed>10746715</pubmed></ref> 。 | |||
=== Munc-13 === | === Munc-13 === | ||
Munc- | Munc-13は、シンタキシンを閉構造から開構造へ変換することで、Munc18と結合したシンタキシンをSNARE複合体が形成できるようにする<ref><pubmed>17645391</pubmed></ref><ref><pubmed>21499244</pubmed></ref>。このタンパク質間相互作用は、シナプス小胞のドッキングおよび[[プライミング]]に関与するとされている<ref><pubmed>18250196 </pubmed></ref><ref><pubmed>11460165</pubmed></ref>。 | ||
=== [[カルシウムチャネル]] | === カルシウムチャネル === | ||
シンタキシン1は多様な[[カルシウムチャネル]]と結合する<ref><pubmed>10212477</pubmed></ref> | |||
<ref><pubmed>10414292</pubmed></ref> | |||
<ref><pubmed>12832834</pubmed></ref> | |||
。中でも[[N型カルシウムチャネル]]との結合は良く調べられていて<ref><pubmed>8119979</pubmed></ref><ref><pubmed>1334074</pubmed></ref>、チャネルの細胞質内ループ中のシンプリントsynprintと呼ばれる部位とシンタキシン1のNペプチドがカルシウムイオン濃度依存性に結合する<ref><pubmed>7993624</pubmed></ref><ref><pubmed>12221094</pubmed></ref><ref><pubmed>8559250</pubmed></ref>。また、これとは別にシンタキシン1の膜貫通領域とその直前の細胞質領域が調節に関与している<ref><pubmed>11087812</pubmed></ref>。[[Gタンパク質]]によるカルシウムチャネルの機能調節は、シンタキシン1と[[Gβ|G<sub>β</sub>]]と[[Gγ|G<sub>γ</sub>]]からなるヘテロ二量体との直接結合により促進される<ref><pubmed>10692440</pubmed></ref>。 | |||
その他にもシンタキシン1は、[[アミシン]]、[[α-ホドリン]]、[[α-SNAP]]、[[CAPS]]、[[CaMKII]]、[[CCCrel-1]]、[[CSP]] ([[cysteine-string protein]]) 、[[D53]]、 [[DAP]]([[death-associated protein]]) キナーゼ、[[DCC]] ([[deleted in colorectal cancer]])、[[グラニュフィリン]]、[[HSP70]]、[[IP3受容体|IP<sub>3</sub>受容体]]、[[Mチャネル]]、[[RACK1]] ([[the receptor for activated C kinases]])、 [[PRIP]] ([[phospholipase C-related but catalytically inactive protein]])、[[プレセニリン-1]]、[[スタリング]]、[[シンコリン]]、[[シンタブリン]]、[[シンタフィリン]]、[[タキシリン]]、[[トモシン]]、[[VAP-A]]、ある種の[[Kチャネル]]、[[オトフェリン]]、[[モノアミン]]トランスポーター、[[グリシン]]トランスポーター、クラス[[C-Vps複合体]]、シナプトブレビン、[[ダイナミン]]、[[チューブリン]]、あるいは[[ミオシンVa]]と結合する。 | |||
== 機能 == | == 機能 == | ||
神経系において細胞体に発現しているシンタキシンは、他の細胞においてと同様、小胞体膜同士の融合、小胞体からゴルジ体への膜輸送、エンドソームからゴルジ体への膜輸送などの細胞内膜輸送に関与していると思われる<ref name=ref7><pubmed>11737951</pubmed></ref>。一方、神経系に特異的に発現しているアイソフォームを含めいくつかのシンタキシンは、神経突起に局在しニューロンに特異的な機能を担っている。 | |||
===神経伝達物質の放出=== | |||
シナプス前膜に存在するシンタキシン1は、[[エンドサイトーシス]]を含め<ref><pubmed>23643538</pubmed></ref>シナプス小胞の循環のいくつかの過程に直接または間接的に関わる。その中でもカルシウム依存性の小胞開口放出過程における役割について最も研究が進んでおり、シンタキシン1はシナプス前膜と小胞膜との間でSNAP-25およびシナプトブレビンとSNARE複合体を形成し、両方の膜を限りなく近づけて融合させ神経伝達物質を開口放出させると考えられている<ref><pubmed>10219238</pubmed></ref>。マウスの[[内耳]][[有毛細胞]]からの伝達物質放出には関与しないという例外はあるが<ref><pubmed>21378973</pubmed></ref>、実験材料として使われる多くの神経標本および開口放出のモデル細胞における伝達物質放出にはシンタキシン1が必須である<ref name=ref7818508><pubmed>7818508</pubmed></ref><ref><pubmed>7609887</pubmed></ref><ref><pubmed>9692742</pubmed></ref><ref><pubmed>7612024</pubmed></ref><ref name=ref9342384><pubmed>9342384</pubmed></ref>。金魚の網膜のリボンシナプスにおけるシナプス小胞の開口放出には、シンタキシン3の選択的スプライシングバリアント3Bが関与する<ref name=ref48 />。 | |||
シンタキシン1は、開口放出に先立ちシナプス小胞や[[有芯小胞]]を放出部位へドッキングさせる。実際、カエルの[[神経筋接合部]]<ref name=ref14622203><pubmed>14622203</pubmed></ref>ならびに[[副腎髄質]][[クロマフィン細胞]]<ref name=ref17205130><pubmed>17205130</pubmed></ref>においてシンタキシンを切断あるいは破壊すると小胞のドッキングが阻害される。一方、ニューロン間のシナプスではシンタキシンの機能を阻害してもドッキングに影響はない<ref name=ref14622203><pubmed>14622203</pubmed></ref><ref name=ref17205130><pubmed>17205130</pubmed></ref><ref name=ref9342384><pubmed>9342384</pubmed></ref>。 | |||
刺激に応じた小胞の開口放出はカルシウム依存性だが、シンタキシン1を含むSNAREにはカルシウム[[イオン]]結合能はない。しかし、シンタキシン自身は、カルシウムチャネルへの結合を介して小胞を放出部位へドッキングさせる<ref><pubmed>18060067</pubmed></ref>。一方で、カルシウムチャネルの機能を抑制することから<ref><pubmed>8524397</pubmed></ref><ref><pubmed>10548106</pubmed></ref>、伝達物質放出のカルシウムイオンによる制御において相反する二種類の働きを併せ持つ<ref><pubmed>17215385</pubmed></ref>。 | |||
それ以外にも、開口放出時に形成されると考えられているフュージョンポアへの関与<ref><pubmed>15016962</pubmed></ref> 、[[学習]]と[[記憶]]に関与する可能性<ref><pubmed>8921297 </pubmed></ref><ref><pubmed>9200718</pubmed></ref><ref><pubmed>9749751</pubmed></ref><ref><pubmed>20563839</pubmed></ref>が示唆されている。 | |||
===AMPA型グルタミン酸受容体の輸送=== | |||
シナプスの長期増強が生じる際、[[AMPA型グルタミン酸受容体]]がそれらを含むリサイクリング[[エンドソーム]]の開口放出によりシナプス後膜へ組み込まれる。いくつかのシンタキシンはこのシナプス後部におけるAMPA受容体の輸送に関与し、シナプスの伝達効率を調節している。 | |||
シンタキシン3および4は、海馬ニューロンにおいて[[長期増強]]など神経活動の亢進時に、AMPA受容体のスパインへの組込みに関与し、シナプス可塑性に重要な役割を果たしている<ref name=ref45 /><ref><pubmed>20959521</pubmed></ref><ref name=ref124><pubmed>23395379</pubmed></ref>。シンタキシン4については議論が分かれており<ref name=ref124><pubmed>23395379</pubmed></ref>、長期増強誘導時ではなく[[レチノイン酸]]によるシナプス可塑性においてAMPA受容体の組み込みに関与するという説もある<ref><pubmed>25843403 </pubmed></ref>。 | |||
シンタキシン13は、AMPA受容体の細胞内輸送に関与する[[GRIP-associated protein 1]] ([[GRASP-1]])と協働して、エンドサイトーシスにより取込まれた初期エンドソームから[[リサイクリングエンドソーム]]への輸送に関与する可能性が示されている<ref name=ref46 />。 | |||
===神経突起の伸長=== | |||
シンタキシン1<ref><pubmed>8698815</pubmed></ref><ref><pubmed>10900079</pubmed></ref><ref><pubmed>21593320</pubmed></ref>、3<ref name=ref44 />、13<ref><pubmed>10886332</pubmed></ref>、および16<ref><pubmed>20589833</pubmed></ref>は[[神経突起]]の伸長に関与する。 | |||
== 疾患との関わり == | == 疾患との関わり == | ||
[[ボツリヌス中毒]]の主な症状である[[弛緩性麻痺]]は、運動[[神経終末]]からの[[アセチルコリン]]の放出阻害による。これは、中毒の原因である[[ボツリヌス菌]]が産生する神経[[毒素]]のもつ[[タンパク質分解酵素]]活性によるSNAREの切断に起因する。7種類存在する[[ボツリヌス毒素]]の中、[[C型毒素]]はシンタキシ1をカルボキシ末端付近の1箇所、[[リジン]]残基と[[アラニン]]残基(1Aでは253番目と254番目、1Bでは252番目と253番目)の間で切断する<ref><pubmed>7901002</pubmed></ref><ref><pubmed>7737992</pubmed></ref>。 | |||
中枢ならびに末梢神経系疾患との関連性も示唆されている。[[統合失調症]]<ref><pubmed>15219469</pubmed></ref><ref><pubmed>19748077</pubmed></ref><ref><pubmed>21669024</pubmed></ref>、[[高機能自閉症]]<ref><pubmed>18593506</pubmed></ref>、[[脳虚血]]後<ref><pubmed>19344701</pubmed></ref>においてシンタキシン1の発現量が増加していることが報告されている。[[末梢神経障害]]による[[異痛症]]にシンタキシン1の発現低下が関与している可能性も言われている<ref><pubmed>21129445</pubmed></ref>。 | |||
== 遺伝子操作動物 == | == 遺伝子操作動物 == | ||
シンタキシン1Aの[[ノックアウトマウス]]は生育可能だが、[[ | シンタキシン1Aの[[ノックアウトマウス]]は生育可能だが、[[恐怖条件づけ]]記憶の阻害に加え、[[セロトニン]]作動性神経系の異常と考えられる行動異常と[[視床下部-下垂体-副腎系]]の機能不全を呈す<ref><pubmed>16723534</pubmed></ref><ref><pubmed>20576034</pubmed></ref><ref><pubmed>21910766</pubmed></ref>。 | ||
これに対し、シンタキシン1Bのノックアウトマウスは生後2週間までしか生存できず、[[グルタミン酸]]あるいは[[GABA]]の放出においてシナプス小胞の正常な開口放出と[[即時放出可能プール]]の形成が阻害されている<ref><pubmed>24587181</pubmed></ref>。恒常的に開構造をとる変異シンタキシン1B遺伝子を強制発現させた[[ノックインマウス]]は生育可能だが、2-3ヶ月齢で全身[[痙攣]]を呈し死にいたる<ref><pubmed>18703708</pubmed></ref>。[[ショウジョウバエ]]では、遺伝子破壊体<ref><pubmed>7834751</pubmed></ref><ref><pubmed>7546745</pubmed></ref><ref><pubmed>10433270</pubmed></ref><ref><pubmed>11095753</pubmed></ref>、[[温度感受性変異体]]<ref><pubmed>9728921</pubmed></ref>、SNAREモチーフ中に変異を導入した変異体<ref><pubmed>11717347</pubmed></ref>が作製されており、いずれもシナプス伝達が著しく阻害されている。 | |||
== 関連項目 == | == 関連項目 == | ||
* SNAP-25 | *[[AMPA型グルタミン酸受容体]] | ||
* SNARE複合体 | *[[SNAP-25]] | ||
* エクソサイトーシス | *[[SNARE複合体]] | ||
* コンプレキシン | *[[エクソサイトーシス]] | ||
* シナプス顆粒 | *[[コンプレキシン]] | ||
* シナプス前終末 | *[[シナプス顆粒]] | ||
* シナプトタグミン | *[[シナプス前終末]] | ||
* シナプトブレビン | *[[シナプトタグミン]] | ||
* ボツリヌス毒素 | *[[シナプトブレビン]] | ||
* 膜融合 | *[[長期増強]] | ||
* 有芯顆粒 | *[[ボツリヌス毒素]] | ||
*[[膜融合]] | |||
*[[有芯顆粒]] | |||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
2020年1月9日 (木) 19:17時点における最新版
西木 禎一
岡山大学 大学院 医歯薬学総合研究科 細胞生理学分野
DOI:10.14931/bsd.6583 原稿受付日:2015年12月22日 原稿完成日:2015年2月4日
担当編集委員:林 康紀(国立研究開発法人理化学研究所 脳科学総合研究センター)
英語名:syntaxin 英略語:STX
同義語:p35, HPC-1, synaptocanalin
シンタキシンは、開口放出を含め細胞内小胞輸送において膜融合に関わるタンパク質ファミリーおよびそのメンバーである。ヒトを含む哺乳類では、少なくとも16種類のアイソフォームが同定されている。基本的に分子の大部分を細胞質に向けて存在する非常にαへリックスに富んだ分子量約35,000の膜タンパク質である。多くのアイソフォームは脳を含め広く生体内に分布している一方で、脳に特異的に発現するものもある。神経細胞におけるシンタキシンの役割はアイソフォームによって異なり、神経伝達物質の開口放出、カルシウムチャネルの機能調節、シナプス後膜へのグルタミン酸受容体の輸送調節、神経突起の伸長など多岐にわたる。脳での発現が認められていないアイソフォームもあるが、それらを含めシンタキシンファミリーについて概説するとともに、神経機能に重要な役割を果たしているアイソフォームを中心に詳しく説明する。
| シンタキシン | |||||||||
|---|---|---|---|---|---|---|---|---|---|
シンタキシン1AのN末端領域[1] | |||||||||
| Identifiers | |||||||||
| Symbol | シンタキシン | ||||||||
| Pfam | PF00804 | ||||||||
| InterPro | IPR006011 | ||||||||
| SMART | SM00503 | ||||||||
| SCOP | 1br0 | ||||||||
| SUPERFAMILY | 1br0 | ||||||||
| OPM superfamily | 218 | ||||||||
| OPM protein | 3hd7 | ||||||||
| |||||||||
シンタキシンとは
シンタキシンは、細胞内小胞輸送において膜融合をつかさどるタンパク質ファミリーおよびそのメンバーである。最初に同定されたアイソフォームは、シナプス小胞タンパク質シナプトタグミンと結合する分子量約35,000の膜タンパク質p35Aおよびp35Bとしてラット脳から単離された[2]。両者は異なる遺伝子によりコードされているが、どちらも288個のアミノ酸からなり、その配列は約80%の相同性をもつ。シナプス小胞のドッキングと開口放出に関わるとの予測から、「順番に整理して一緒に並べること」を意味する古代ギリシャ語σψνταξισ (syntaxis) にちなみシンタキシンsyntaxinと命名された。ほぼ同時期に複数のグループにより同定されたので、HPC-1[3]あるいはsynaptocanalin[4]とも呼ばれる。
シンタキシンファミリーは、SNARE (soluble ''N''-etylmaleimide sensitive fusion protein attachment protein receptorの略) と総称される膜融合関連タンパク質スーパーファミリーの一員でもある。SNAREは、輸送小胞に局在するv-SNARE (vはvesicularのv) と、標的膜に存在しv-SNAREの受容体となるt-SNARE (tはtarget-membraneのt) の2種類に大別される[5]。シンタキシンはその局在(後述)からt-SNAREに属するとともに、SNAREモチーフの中央にグルタミン残基を持つことから、そのアミノ酸一文字表記にならいQ-SNAREとも分類される[6]。
ファミリーメンバー
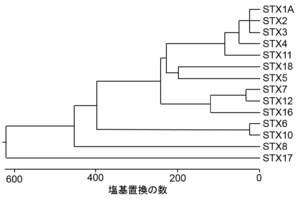
文献[7]の図を基に改変、作成。
ヒトでは少なくとも16種類のアイソフォームが存在し、そのうちの多くが線虫から哺乳類に至るまで進化的に保存されている(図1、表)[7]。なお、シンタキシン12、13、および14はオルソログである。また、ESTデータベースの検索結果から2種類のcDNA断片がシンタキシンのアイソフォームとして同定され、それぞれシンタキシン9(AA150357)および15(AA244750)と命名されている[8]。
| アイソフォーム注) | 生体内分布 | 細胞内局在 | ヒト | マウス | ラット | ショウジョウバエ | 線虫 |
| 1A[2] | 神経組織、分泌組織 | 細胞膜 | 6804 | 20907 | 116470 | 42854 | 176743 |
| 1B[2] | 神経組織、分泌組織 | 細胞膜 | 112755 | 56216 | 24923 | なし | なし |
| 2[9]
(別名エピモルフィン) |
広範な器官 | 細胞膜 | 2054 | 13852 | 25130 | なし | 181505 |
| 3[9] | 広範な器官
(特に脾臓、肺、腎臓) |
細胞膜 | 6809 | 20908 | 81802 | なし | 3565871 |
| 4[9] | 広範な器官
(特に心臓) |
細胞膜 | 6810 | 20909 | 81803 | 31269 | 177647 |
| 5[9] | 広範な器官
(特に脾臓、肝臓、精巣) |
小胞体–ゴルジ体中間区画 | 6811 | 56389 | 65134 | 34966 | 179611 |
| 6[10] | 広範な器官 | トランスゴルジ網(TGN) | 10228 | 58244 | 60562 | 40373 | 259698 |
| 7[11] | 広範な器官 | 初期および後期エンドソーム | 8417 | 53331 | 60466 | 36173 | 172718 |
| 8[12] | 広範な器官
(特に心臓) |
初期および後期エンドソーム | 9482 | 55943 | 59074 | 39847 | なし |
| 10[13] | 広範な器官 | トランスゴルジ網(TGN) | 8677 | なし | なし | なし | なし |
| 11[14] | 広範な器官
(特に心臓、胎盤) |
トランスゴルジ網(TGN)
後期エンドソーム |
8676 | 74732 | 292483 | なし | なし |
| 12[15]/13[16]/14 | 広範な器官 | 初期エンドソーム | 23673 | 100226 | 65033 | 39485 | なし |
| 16[17] | 広範な器官
(特に心臓、膵臓) |
トランスゴルジ網(TGN) | 8675 | 228960 | 362283 | 33034 | 175712 |
| 17[12] | 広範な器官
(特に肝臓、精巣) |
小胞体 | 55014 | 67727 | 252853 | 38541 | 172663 |
| 18[18] | 少なくとも脳 | 小胞体 | 53407 | 71116 | 360953 | 42933 | 179055 |
| 19 | 不明 | 不明 | 415117 | 68159 | 685180 | なし | なし |
注)太字は脳での発現が確認されているものを示す。
構造
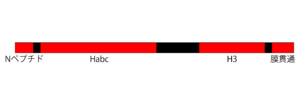
シンタキシンは、約250から300アミノ酸からなる膜タンパク質(膜貫通ドメインを欠くアイソフォーム11を除く)である。主にαへリックスからなる複数のドメインがリンカーでつながれた構造をしている(図2)。カルボキシ末端の一箇所の膜貫通ドメイン(アイソフォーム7は二箇所)が膜に埋め込まれ、分子の大部分を細胞質に向けて存在している。
アイソフォーム6、8、10以外のシンタキシンは、アミノ末端にMunc-18との結合に関わる約20のアミノ酸残基からなるNペプチドモチーフをもつ(後述)[19]。
アミノ末端側のHabcと呼ばれるドメインでは、3本のαへリックスが逆平行に結合し束になっている[1][20]。Habcに続くリンカーはフレキシブルで[21]、Habcは次のH3ドメインに折り重なることよりシンタキシンの膜融合能を制御する負の調節ドメインとして働く[22]。
シンタキシンのカルボキシ末端側3分の1は、膜融合能を発揮するのに必要最小限の領域である。SNAREモチーフを含むH3ドメインは対になる他のSNAREと結合し、膜融合能をもつSNARE複合体を形成する[23]。実際、H3ドメインと膜貫通ドメインからなるシンタキシン1の組換えフラグメントをSNAP-25ととともに再構成した人工脂質小胞は、シナプトブレビン2を再構成した人工脂質小胞と自発的に融合する[24]。
単量体のシンタキシンは、活性化状態と不活性状態を移行する[25]。活性化状態では、HabcとH3が解離したいわゆる開いた構造をとり、対になるSNAREと結合できる。これに対し、HabcがH3に折り重なった閉じた構造になると不活性型となり、SNARE複合体を形成できない[26][27]。
生体内および細胞内分布
生体内においてシンタキシンの大部分のアイソフォームは広範な器官に分布しており、そのうちアイソフォーム3、4、6、7、8、12/13、16、17および18は脳にも発現している(表)。一方、シンタキシン1Aおよび1Bは、脳などの神経組織および副腎髄質などの分泌組織に特異的に発現している。
神経系においてシンタキシン1は、大脳皮質、海馬、小脳、脊髄、網膜のシナプスが豊富な領域に観察される[28]。有郭乳頭味蕾[29]、蝸牛内のコルチ器[30]、松果体細胞[31] にも存在する。神経系だけでなく、発生学的にニューロンと同じ外胚葉由来の副腎髄質にも発現している[32]。中枢神経系および末梢神経系の両方において、1Aと1Bの分布は異なる[33][34]。
細胞内において、16種類のアイソフォームのうちシンタキシン1(AおよびB)から4までの5種類は形質膜に局在しており、残りは小胞体、ゴルジ体、トランスゴルジ網、エンドソームなどに局在している(表)。
ニューロンにおいてシンタキシン1は、主にシナプス前膜を含む細胞膜に局在する一方、シナプス小胞膜にも認められる[35][36][37]。小脳皮質においては、ほとんどのグルタミン酸作動性終末と、一部のGABA作動性シナプスに局在する[38]。その他にも、視索上核のオキシトシンニューロンでは軸索終末だけでなく細胞体や樹状突起に発現が見られるとともに[39]、ヒヨコの毛様体神経節の杯状シナプス前部[40]、カエルの運動神経終末[41]にも存在する。アストロサイトにも発現している[42][43]。
初代培養した海馬ニューロンにおいて、シンタキシン3は細胞体や樹状突起に加え成長円錐にも[44]、シンタキシン4[45]および12/13[46]および16[47]はスパインを含め樹状突起に存在する。金魚の網膜のリボンシナプスには、シンタキシン3の選択的スプライシングアイソフォームBが発現している[48]。
翻訳後修飾
シンタキシン1は、PKCおよびCaMKII[49][50] 、カゼインキナーゼ1および2[51][2][50][52][53]によりリン酸化される。PKAについては議論が分かれている[49][50]。リン酸化以外に、ニトロ化[54]、Sニトロシル化[55]、パルミトイル化[56]を受け、ユビキチン-プロテアソーム経路により分解される[57]。
結合タンパク質
シンタキシンは自身と同じ膜に局在する別のt-SNAREと結合するとともに、さらに輸送されて来る小胞に局在するv-SNAREとも結合してSNARE複合体を形成し膜融合能を発揮する。さらにシンタキシンには、SNARE複合体形成を制御するタンパク質の多くが結合する。この節では、他の分子との結合が最も良く調べられているシンタキシン1の主な結合タンパク質を紹介する。他のアイソフォームでは、シンタキシ4はFアクチンと[58]、シンタキシン13はシナプス後部の足場タンパク質Homer1c(別名Vesl-1L)[59]、NEEP21(neuron-enriched endosomal protein of 21 kDa)[60]、およびGRASP-1(GRIP-associated protein-1))[46]と結合することが報告されている。
SNARE(SNAP-25およびシナプトブレビン)
シンタキシン1は、同じくt-SNAREであるSNAP-25と自身のH3ドメインを介し結合する[23]。会合比により2種類の複合体が存在する。1:1で結合したt-SNAREヘテロニ量体は、v-SNAREであるシナプトブレビン(別名VAMP)と結合しSNARE複合体を形成する。一方、シンタキシン二分子にSNAP-25が一分子結合した2:1複合体(通称)は、シナプトブレビンと結合できない[61]。したがって、シナプス前終末の放出部位では、別の分子により1:1複合体の状態が維持されていると予想される。
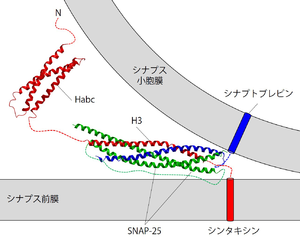
シンタキシンは赤で描いている。緑はSNAP-25を、青はシナプトブレビンをそれぞれ示す。明らかにされているSNARE複合体とHabcドメインの立体構造に、膜貫通ドメインを表す円柱とリンカー等を表す点線を書き加えた。
シンタキシン1、SNAP-25、およびシナプトブレビンが1:1:1の比で結合したSNARE複合体は、コイルドコイル構造をもつ[62]。よく目にするシナプス小胞膜とシナプス前膜との間で形成されているSNARE複合体の模式図は、シンタキシンのH3ドメインとSNAP-25およびシナプトブレビンの細胞質フラグメントからなる複合体の立体構造解析結果に膜貫通領域などを描き足したものである(図3)。組織を可溶化した後などに溶液中に存在するSNARE複合体は強固に結合しており、強力な界面活性剤に対しても耐性を持ち、ラウリル硫酸ナトリウム(SDS)存在下でも煮沸しない限り解離しない[63]。
シナプトタグミン
シンタキシン1は、H3ドメインを介して神経伝達物質放出のカルシウムイオンセンサーと考えられているシナプトタグミン1と結合する[64][65]。カルシウムイオン非存在下では、シナプトタグミンのC2Bドメインと結合する[66][67]。大腸菌で発現させた組換えタンパク質同士の結合は、結合実験に用いるフラグメントの大きさや付加するタグによって、特にカルシウムイオンの要求性に、大きな影響を受ける[68]。ある条件下ではシンタキシンとシナプトタグミンの結合はカルシウム依存性であり[69]、シナプトタグミンのC2Aドメインへのカルシウムイオンの結合が必須である[70]。しかし、C2Aのカルシウム結合能を欠失させた変異シナプトタグミンを発現させたニューロンで神経伝達物質の放出に異常が認められないことから[71]、シンタキシンとシナプトグミンのカルシウム依存性結合の伝達物質放出における意義は不明である。
コンプレキシン
シンタキシンは、SNARE複合体による膜融合を一時停止させる役割を持つとされるシナプスタンパク質コンプレキシン(別名シナフィン)とH3を介して結合する[72][73]。シンタキシン1を含むSNARE複合体とコンプレキシンの中央部分の結合状態の立体構造が明らかにされている[74]。シンタキシン1と同じく細胞膜に局在するシンタキシン2および3もコンプレキシンと結合するが、シンタキシン4は結合能を欠く[75]。
Munc-18
小胞のドッキングあるいはプライミングに関与するMunc-18(別名n-Sec1)のシンタキシンへの結合は、当初SNARE複合体の形成を阻害するとされていた[76][77]。これは、単純化された結合実験において、シンタキシン1のNペプチドにMunc18が結合している時はその閉構造が安定化し[78]、SNAP-25と結合できないためである[79] 。しかしその後、Munc-18と結合したシンタキシン1でもMunc-13存在下では開構造へと変形し[80]、SNARE複合体を形成できることが明らかにされた(後述)[81][82][83]。このように、Munc-18は、シンタキシン1の開閉構造に応じた二種類の結合様式でモノメリックなシンタキシン1とSNARE複合体中のシンタキシン1の両方に結合することができる。シンタキシン1とMunc-18の結合は、両者のリン酸化[84][85][86][87]や、アラキドン酸[88]およびスフィンゴシン[89]により制御される。シンタキシンとMunc-18の複合体の立体構造も明らかにされている[90] 。
Munc-13
Munc-13は、シンタキシンを閉構造から開構造へ変換することで、Munc18と結合したシンタキシンをSNARE複合体が形成できるようにする[91][92]。このタンパク質間相互作用は、シナプス小胞のドッキングおよびプライミングに関与するとされている[93][94]。
カルシウムチャネル
シンタキシン1は多様なカルシウムチャネルと結合する[95] [96] [97] 。中でもN型カルシウムチャネルとの結合は良く調べられていて[98][99]、チャネルの細胞質内ループ中のシンプリントsynprintと呼ばれる部位とシンタキシン1のNペプチドがカルシウムイオン濃度依存性に結合する[100][101][102]。また、これとは別にシンタキシン1の膜貫通領域とその直前の細胞質領域が調節に関与している[103]。Gタンパク質によるカルシウムチャネルの機能調節は、シンタキシン1とGβとGγからなるヘテロ二量体との直接結合により促進される[104]。
その他にもシンタキシン1は、アミシン、α-ホドリン、α-SNAP、CAPS、CaMKII、CCCrel-1、CSP (cysteine-string protein) 、D53、 DAP(death-associated protein) キナーゼ、DCC (deleted in colorectal cancer)、グラニュフィリン、HSP70、IP3受容体、Mチャネル、RACK1 (the receptor for activated C kinases)、 PRIP (phospholipase C-related but catalytically inactive protein)、プレセニリン-1、スタリング、シンコリン、シンタブリン、シンタフィリン、タキシリン、トモシン、VAP-A、ある種のKチャネル、オトフェリン、モノアミントランスポーター、グリシントランスポーター、クラスC-Vps複合体、シナプトブレビン、ダイナミン、チューブリン、あるいはミオシンVaと結合する。
機能
神経系において細胞体に発現しているシンタキシンは、他の細胞においてと同様、小胞体膜同士の融合、小胞体からゴルジ体への膜輸送、エンドソームからゴルジ体への膜輸送などの細胞内膜輸送に関与していると思われる[7]。一方、神経系に特異的に発現しているアイソフォームを含めいくつかのシンタキシンは、神経突起に局在しニューロンに特異的な機能を担っている。
神経伝達物質の放出
シナプス前膜に存在するシンタキシン1は、エンドサイトーシスを含め[105]シナプス小胞の循環のいくつかの過程に直接または間接的に関わる。その中でもカルシウム依存性の小胞開口放出過程における役割について最も研究が進んでおり、シンタキシン1はシナプス前膜と小胞膜との間でSNAP-25およびシナプトブレビンとSNARE複合体を形成し、両方の膜を限りなく近づけて融合させ神経伝達物質を開口放出させると考えられている[106]。マウスの内耳有毛細胞からの伝達物質放出には関与しないという例外はあるが[107]、実験材料として使われる多くの神経標本および開口放出のモデル細胞における伝達物質放出にはシンタキシン1が必須である[32][108][109][110][111]。金魚の網膜のリボンシナプスにおけるシナプス小胞の開口放出には、シンタキシン3の選択的スプライシングバリアント3Bが関与する[48]。
シンタキシン1は、開口放出に先立ちシナプス小胞や有芯小胞を放出部位へドッキングさせる。実際、カエルの神経筋接合部[112]ならびに副腎髄質クロマフィン細胞[113]においてシンタキシンを切断あるいは破壊すると小胞のドッキングが阻害される。一方、ニューロン間のシナプスではシンタキシンの機能を阻害してもドッキングに影響はない[112][113][111]。
刺激に応じた小胞の開口放出はカルシウム依存性だが、シンタキシン1を含むSNAREにはカルシウムイオン結合能はない。しかし、シンタキシン自身は、カルシウムチャネルへの結合を介して小胞を放出部位へドッキングさせる[114]。一方で、カルシウムチャネルの機能を抑制することから[115][116]、伝達物質放出のカルシウムイオンによる制御において相反する二種類の働きを併せ持つ[117]。
それ以外にも、開口放出時に形成されると考えられているフュージョンポアへの関与[118] 、学習と記憶に関与する可能性[119][120][121][122]が示唆されている。
AMPA型グルタミン酸受容体の輸送
シナプスの長期増強が生じる際、AMPA型グルタミン酸受容体がそれらを含むリサイクリングエンドソームの開口放出によりシナプス後膜へ組み込まれる。いくつかのシンタキシンはこのシナプス後部におけるAMPA受容体の輸送に関与し、シナプスの伝達効率を調節している。
シンタキシン3および4は、海馬ニューロンにおいて長期増強など神経活動の亢進時に、AMPA受容体のスパインへの組込みに関与し、シナプス可塑性に重要な役割を果たしている[45][123][124]。シンタキシン4については議論が分かれており[124]、長期増強誘導時ではなくレチノイン酸によるシナプス可塑性においてAMPA受容体の組み込みに関与するという説もある[125]。
シンタキシン13は、AMPA受容体の細胞内輸送に関与するGRIP-associated protein 1 (GRASP-1)と協働して、エンドサイトーシスにより取込まれた初期エンドソームからリサイクリングエンドソームへの輸送に関与する可能性が示されている[46]。
神経突起の伸長
シンタキシン1[126][127][128]、3[44]、13[129]、および16[130]は神経突起の伸長に関与する。
疾患との関わり
ボツリヌス中毒の主な症状である弛緩性麻痺は、運動神経終末からのアセチルコリンの放出阻害による。これは、中毒の原因であるボツリヌス菌が産生する神経毒素のもつタンパク質分解酵素活性によるSNAREの切断に起因する。7種類存在するボツリヌス毒素の中、C型毒素はシンタキシ1をカルボキシ末端付近の1箇所、リジン残基とアラニン残基(1Aでは253番目と254番目、1Bでは252番目と253番目)の間で切断する[131][132]。
中枢ならびに末梢神経系疾患との関連性も示唆されている。統合失調症[133][134][135]、高機能自閉症[136]、脳虚血後[137]においてシンタキシン1の発現量が増加していることが報告されている。末梢神経障害による異痛症にシンタキシン1の発現低下が関与している可能性も言われている[138]。
遺伝子操作動物
シンタキシン1Aのノックアウトマウスは生育可能だが、恐怖条件づけ記憶の阻害に加え、セロトニン作動性神経系の異常と考えられる行動異常と視床下部-下垂体-副腎系の機能不全を呈す[139][140][141]。
これに対し、シンタキシン1Bのノックアウトマウスは生後2週間までしか生存できず、グルタミン酸あるいはGABAの放出においてシナプス小胞の正常な開口放出と即時放出可能プールの形成が阻害されている[142]。恒常的に開構造をとる変異シンタキシン1B遺伝子を強制発現させたノックインマウスは生育可能だが、2-3ヶ月齢で全身痙攣を呈し死にいたる[143]。ショウジョウバエでは、遺伝子破壊体[144][145][146][147]、温度感受性変異体[148]、SNAREモチーフ中に変異を導入した変異体[149]が作製されており、いずれもシナプス伝達が著しく阻害されている。
関連項目
- AMPA型グルタミン酸受容体
- SNAP-25
- SNARE複合体
- エクソサイトーシス
- コンプレキシン
- シナプス顆粒
- シナプス前終末
- シナプトタグミン
- シナプトブレビン
- 長期増強
- ボツリヌス毒素
- 膜融合
- 有芯顆粒
参考文献
- ↑ 1.0 1.1
Fernandez, I., Ubach, J., Dulubova, I., Zhang, X., Südhof, T.C., & Rizo, J. (1998).
Three-dimensional structure of an evolutionarily conserved N-terminal domain of syntaxin 1A. Cell, 94(6), 841-9. [PubMed:9753330] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2 2.3
Bennett, M.K., Calakos, N., & Scheller, R.H. (1992).
Syntaxin: a synaptic protein implicated in docking of synaptic vesicles at presynaptic active zones. Science (New York, N.Y.), 257(5067), 255-9. [PubMed:1321498] [WorldCat] [DOI] - ↑
Inoue, A., Obata, K., & Akagawa, K. (1992).
Cloning and sequence analysis of cDNA for a neuronal cell membrane antigen, HPC-1. The Journal of biological chemistry, 267(15), 10613-9. [PubMed:1587842] [WorldCat] - ↑
Abe, T., Saisu, H., & Horikawa, H.P. (1993).
Synaptocanalins (N-type Ca channel-associated proteins) form a complex with SNAP-25 and synaptotagmin. Annals of the New York Academy of Sciences, 707, 373-5. [PubMed:9137572] [WorldCat] [DOI] - ↑
Söllner, T., Whiteheart, S.W., Brunner, M., Erdjument-Bromage, H., Geromanos, S., Tempst, P., & Rothman, J.E. (1993).
SNAP receptors implicated in vesicle targeting and fusion. Nature, 362(6418), 318-24. [PubMed:8455717] [WorldCat] [DOI] - ↑
Fasshauer, D., Sutton, R.B., Brunger, A.T., & Jahn, R. (1998).
Conserved structural features of the synaptic fusion complex: SNARE proteins reclassified as Q- and R-SNAREs. Proceedings of the National Academy of Sciences of the United States of America, 95(26), 15781-6. [PubMed:9861047] [PMC] [WorldCat] [DOI] - ↑ 7.0 7.1 7.2
Teng, F.Y., Wang, Y., & Tang, B.L. (2001).
The syntaxins. Genome biology, 2(11), REVIEWS3012. [PubMed:11737951] [PMC] [WorldCat] [DOI] - ↑
Bock, J.B., & Scheller, R.H. (1997).
Protein transport. A fusion of new ideas. Nature, 387(6629), 133-5. [PubMed:9144278] [WorldCat] [DOI] - ↑ 9.0 9.1 9.2 9.3
Bennett, M.K., García-Arrarás, J.E., Elferink, L.A., Peterson, K., Fleming, A.M., Hazuka, C.D., & Scheller, R.H. (1993).
The syntaxin family of vesicular transport receptors. Cell, 74(5), 863-73. [PubMed:7690687] [WorldCat] [DOI] - ↑
Bock, J.B., Lin, R.C., & Scheller, R.H. (1996).
A new syntaxin family member implicated in targeting of intracellular transport vesicles. The Journal of biological chemistry, 271(30), 17961-5. [PubMed:8663448] [WorldCat] [DOI] - ↑
Wang, H., Frelin, L., & Pevsner, J. (1997).
Human syntaxin 7: a Pep12p/Vps6p homologue implicated in vesicle trafficking to lysosomes. Gene, 199(1-2), 39-48. [PubMed:9358037] [WorldCat] [DOI] - ↑ 12.0 12.1
Steegmaier, M., Yang, B., Yoo, J.S., Huang, B., Shen, M., Yu, S., ..., & Scheller, R.H. (1998).
Three novel proteins of the syntaxin/SNAP-25 family. The Journal of biological chemistry, 273(51), 34171-9. [PubMed:9852078] [WorldCat] [DOI] - ↑
Tang, B.L., Low, D.Y., Tan, A.E., & Hong, W. (1998).
Syntaxin 10: a member of the syntaxin family localized to the trans-Golgi network. Biochemical and biophysical research communications, 242(2), 345-50. [PubMed:9446797] [WorldCat] [DOI] - ↑
Tang, B.L., Low, D.Y., & Hong, W. (1998).
Syntaxin 11: a member of the syntaxin family without a carboxyl terminal transmembrane domain. Biochemical and biophysical research communications, 245(2), 627-32. [PubMed:9571206] [WorldCat] [DOI] - ↑
Tang, B.L., Tan, A.E., Lim, L.K., Lee, S.S., Low, D.Y., & Hong, W. (1998).
Syntaxin 12, a member of the syntaxin family localized to the endosome. The Journal of biological chemistry, 273(12), 6944-50. [PubMed:9507000] [WorldCat] [DOI] - ↑
Advani, R.J., Bae, H.R., Bock, J.B., Chao, D.S., Doung, Y.C., Prekeris, R., ..., & Scheller, R.H. (1998).
Seven novel mammalian SNARE proteins localize to distinct membrane compartments. The Journal of biological chemistry, 273(17), 10317-24. [PubMed:9553086] [WorldCat] [DOI] - ↑
Tang, B.L., Low, D.Y., Lee, S.S., Tan, A.E., & Hong, W. (1998).
Molecular cloning and localization of human syntaxin 16, a member of the syntaxin family of SNARE proteins. Biochemical and biophysical research communications, 242(3), 673-9. [PubMed:9464276] [WorldCat] [DOI] - ↑
Hatsuzawa, K., Hirose, H., Tani, K., Yamamoto, A., Scheller, R.H., & Tagaya, M. (2000).
Syntaxin 18, a SNAP receptor that functions in the endoplasmic reticulum, intermediate compartment, and cis-Golgi vesicle trafficking. The Journal of biological chemistry, 275(18), 13713-20. [PubMed:10788491] [WorldCat] [DOI] - ↑
Rathore, S.S., Bend, E.G., Yu, H., Hammarlund, M., Jorgensen, E.M., & Shen, J. (2010).
Syntaxin N-terminal peptide motif is an initiation factor for the assembly of the SNARE-Sec1/Munc18 membrane fusion complex. Proceedings of the National Academy of Sciences of the United States of America, 107(52), 22399-406. [PubMed:21139055] [PMC] [WorldCat] [DOI] - ↑
Lerman, J.C., Robblee, J., Fairman, R., & Hughson, F.M. (2000).
Structural analysis of the neuronal SNARE protein syntaxin-1A. Biochemistry, 39(29), 8470-9. [PubMed:10913252] [WorldCat] [DOI] - ↑
Margittai, M., Fasshauer, D., Jahn, R., & Langen, R. (2003).
The Habc domain and the SNARE core complex are connected by a highly flexible linker. Biochemistry, 42(14), 4009-14. [PubMed:12680753] [WorldCat] [DOI] - ↑
Parlati, F., Weber, T., McNew, J.A., Westermann, B., Söllner, T.H., & Rothman, J.E. (1999).
Rapid and efficient fusion of phospholipid vesicles by the alpha-helical core of a SNARE complex in the absence of an N-terminal regulatory domain. Proceedings of the National Academy of Sciences of the United States of America, 96(22), 12565-70. [PubMed:10535962] [PMC] [WorldCat] [DOI] - ↑ 23.0 23.1
Zhong, P., Chen, Y.A., Tam, D., Chung, D., Scheller, R.H., & Miljanich, G.P. (1997).
An alpha-helical minimal binding domain within the H3 domain of syntaxin is required for SNAP-25 binding. Biochemistry, 36(14), 4317-26. [PubMed:9100028] [WorldCat] [DOI] - ↑
Weber, T., Zemelman, B.V., McNew, J.A., Westermann, B., Gmachl, M., Parlati, F., ..., & Rothman, J.E. (1998).
SNAREpins: minimal machinery for membrane fusion. Cell, 92(6), 759-72. [PubMed:9529252] [WorldCat] [DOI] - ↑
Margittai, M., Widengren, J., Schweinberger, E., Schröder, G.F., Felekyan, S., Haustein, E., ..., & Seidel, C.A. (2003).
Single-molecule fluorescence resonance energy transfer reveals a dynamic equilibrium between closed and open conformations of syntaxin 1. Proceedings of the National Academy of Sciences of the United States of America, 100(26), 15516-21. [PubMed:14668446] [PMC] [WorldCat] [DOI] - ↑
Chen, X., Lu, J., Dulubova, I., & Rizo, J. (2008).
NMR analysis of the closed conformation of syntaxin-1. Journal of biomolecular NMR, 41(1), 43-54. [PubMed:18458823] [PMC] [WorldCat] [DOI] - ↑
Dulubova, I., Sugita, S., Hill, S., Hosaka, M., Fernandez, I., Südhof, T.C., & Rizo, J. (1999).
A conformational switch in syntaxin during exocytosis: role of munc18. The EMBO journal, 18(16), 4372-82. [PubMed:10449403] [PMC] [WorldCat] [DOI] - ↑
Inoue, A., & Akagawa, K. (1993).
Neuron specific expression of a membrane protein, HPC-1: tissue distribution, and cellular and subcellular localization of immunoreactivity and mRNA. Brain research. Molecular brain research, 19(1-2), 121-8. [PubMed:8361334] [WorldCat] [DOI] - ↑
Yang, R., Ma, H., Thomas, S.M., & Kinnamon, J.C. (2007).
Immunocytochemical analysis of syntaxin-1 in rat circumvallate taste buds. The Journal of comparative neurology, 502(6), 883-93. [PubMed:17447252] [WorldCat] [DOI] - ↑
Safieddine, S., & Wenthold, R.J. (1999).
SNARE complex at the ribbon synapses of cochlear hair cells: analysis of synaptic vesicle- and synaptic membrane-associated proteins. The European journal of neuroscience, 11(3), 803-12. [PubMed:10103074] [WorldCat] [DOI] - ↑
Redecker, P. (1996).
Synaptotagmin I, synaptobrevin II, and syntaxin I are coexpressed in rat and gerbil pinealocytes. Cell and tissue research, 283(3), 443-54. [PubMed:8593674] [WorldCat] [DOI] - ↑ 32.0 32.1
Gutierrez, L.M., Quintanar, J.L., Viniegra, S., Salinas, E., Moya, F., & Reig, J.A. (1995).
Anti-syntaxin antibodies inhibit calcium-dependent catecholamine secretion from permeabilized chromaffin cells. Biochemical and biophysical research communications, 206(1), 1-7. [PubMed:7818508] [WorldCat] [DOI] - ↑
Aguado, F., Majó, G., Ruiz-Montasell, B., Llorens, J., Marsal, J., & Blasi, J. (1999).
Syntaxin 1A and 1B display distinct distribution patterns in the rat peripheral nervous system. Neuroscience, 88(2), 437-46. [PubMed:10197765] [WorldCat] [DOI] - ↑
Ruiz-Montasell, B., Aguado, F., Majó, G., Chapman, E.R., Canals, J.M., Marsal, J., & Blasi, J. (1996).
Differential distribution of syntaxin isoforms 1A and 1B in the rat central nervous system. The European journal of neuroscience, 8(12), 2544-52. [PubMed:8996803] [WorldCat] [DOI] - ↑
Koh, S., Yamamoto, A., Inoue, A., Inoue, Y., Akagawa, K., Kawamura, Y., ..., & Tashiro, Y. (1993).
Immunoelectron microscopic localization of the HPC-1 antigen in rat cerebellum. Journal of neurocytology, 22(11), 995-1005. [PubMed:8301329] [WorldCat] [DOI] - ↑
Garcia, E.P., McPherson, P.S., Chilcote, T.J., Takei, K., & De Camilli, P. (1995).
rbSec1A and B colocalize with syntaxin 1 and SNAP-25 throughout the axon, but are not in a stable complex with syntaxin. The Journal of cell biology, 129(1), 105-20. [PubMed:7698978] [PMC] [WorldCat] [DOI] - ↑
Pertsinidis, A., Mukherjee, K., Sharma, M., Pang, Z.P., Park, S.R., Zhang, Y., ..., & Chu, S. (2013).
Ultrahigh-resolution imaging reveals formation of neuronal SNARE/Munc18 complexes in situ. Proceedings of the National Academy of Sciences of the United States of America, 110(30), E2812-20. [PubMed:23821748] [PMC] [WorldCat] [DOI] - ↑
Benagiano, V., Lorusso, L., Flace, P., Girolamo, F., Rizzi, A., Bosco, L., ..., & Ambrosi, G. (2011).
VAMP-2, SNAP-25A/B and syntaxin-1 in glutamatergic and GABAergic synapses of the rat cerebellar cortex. BMC neuroscience, 12, 118. [PubMed:22094010] [PMC] [WorldCat] [DOI] - ↑
Tobin, V., Schwab, Y., Lelos, N., Onaka, T., Pittman, Q.J., & Ludwig, M. (2012).
Expression of exocytosis proteins in rat supraoptic nucleus neurones. Journal of neuroendocrinology, 24(4), 629-41. [PubMed:21988098] [PMC] [WorldCat] [DOI] - ↑
Li, Q., Lau, A., Morris, T.J., Guo, L., Fordyce, C.B., & Stanley, E.F. (2004).
A syntaxin 1, Galpha(o), and N-type calcium channel complex at a presynaptic nerve terminal: analysis by quantitative immunocolocalization. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(16), 4070-81. [PubMed:15102922] [PMC] [WorldCat] [DOI] - ↑
Boudier, J.A., Charvin, N., Boudier, J.L., Fathallah, M., Tagaya, M., Takahashi, M., & Seagar, M.J. (1996).
Distribution of components of the SNARE complex in relation to transmitter release sites at the frog neuromuscular junction. The European journal of neuroscience, 8(3), 545-52. [PubMed:8963446] [WorldCat] [DOI] - ↑
Jeftinija, S.D., Jeftinija, K.V., & Stefanovic, G. (1997).
Cultured astrocytes express proteins involved in vesicular glutamate release. Brain research, 750(1-2), 41-7. [PubMed:9098527] [WorldCat] [DOI] - ↑
Schubert, V., Bouvier, D., & Volterra, A. (2011).
SNARE protein expression in synaptic terminals and astrocytes in the adult hippocampus: a comparative analysis. Glia, 59(10), 1472-88. [PubMed:21656854] [WorldCat] [DOI] - ↑ 44.0 44.1
Darios, F., & Davletov, B. (2006).
Omega-3 and omega-6 fatty acids stimulate cell membrane expansion by acting on syntaxin 3. Nature, 440(7085), 813-7. [PubMed:16598260] [WorldCat] [DOI] - ↑ 45.0 45.1
Kennedy, M.J., Davison, I.G., Robinson, C.G., & Ehlers, M.D. (2010).
Syntaxin-4 defines a domain for activity-dependent exocytosis in dendritic spines. Cell, 141(3), 524-35. [PubMed:20434989] [PMC] [WorldCat] [DOI] - ↑ 46.0 46.1 46.2
Hoogenraad, C.C., Popa, I., Futai, K., Martinez-Sanchez, E., Sanchez-Martinez, E., Wulf, P.S., ..., & van der Sluijs, P. (2010).
Neuron specific Rab4 effector GRASP-1 coordinates membrane specialization and maturation of recycling endosomes. PLoS biology, 8(1), e1000283. [PubMed:20098723] [PMC] [WorldCat] [DOI] - ↑
Chua, C.E., & Tang, B.L. (2008).
Syntaxin 16 is enriched in neuronal dendrites and may have a role in neurite outgrowth. Molecular membrane biology, 25(1), 35-45. [PubMed:17852734] [WorldCat] [DOI] - ↑ 48.0 48.1
Curtis, L., Datta, P., Liu, X., Bogdanova, N., Heidelberger, R., & Janz, R. (2010).
Syntaxin 3B is essential for the exocytosis of synaptic vesicles in ribbon synapses of the retina. Neuroscience, 166(3), 832-41. [PubMed:20060037] [PMC] [WorldCat] [DOI] - ↑ 49.0 49.1
Hirling, H., & Scheller, R.H. (1996).
Phosphorylation of synaptic vesicle proteins: modulation of the alpha SNAP interaction with the core complex. Proceedings of the National Academy of Sciences of the United States of America, 93(21), 11945-9. [PubMed:8876242] [PMC] [WorldCat] [DOI] - ↑ 50.0 50.1 50.2
Risinger, C., & Bennett, M.K. (1999).
Differential phosphorylation of syntaxin and synaptosome-associated protein of 25 kDa (SNAP-25) isoforms. Journal of neurochemistry, 72(2), 614-24. [PubMed:9930733] [WorldCat] [DOI] - ↑
Dubois, T., Kerai, P., Learmonth, M., Cronshaw, A., & Aitken, A. (2002).
Identification of syntaxin-1A sites of phosphorylation by casein kinase I and casein kinase II. European journal of biochemistry, 269(3), 909-14. [PubMed:11846792] [WorldCat] [DOI] - ↑
Foletti, D.L., Lin, R., Finley, M.A., & Scheller, R.H. (2000).
Phosphorylated syntaxin 1 is localized to discrete domains along a subset of axons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 20(12), 4535-44. [PubMed:10844023] [PMC] [WorldCat] - ↑
DeGiorgis, J.A., Jaffe, H., Moreira, J.E., Carlotti, C.G., Leite, J.P., Pant, H.C., & Dosemeci, A. (2005).
Phosphoproteomic analysis of synaptosomes from human cerebral cortex. Journal of proteome research, 4(2), 306-15. [PubMed:15822905] [WorldCat] [DOI] - ↑
Prior, I.A., & Clague, M.J. (2000).
Detection of thiol modification following generation of reactive nitrogen species: analysis of synaptic vesicle proteins. Biochimica et biophysica acta, 1475(3), 281-6. [PubMed:10913827] [WorldCat] [DOI] - ↑
Palmer, Z.J., Duncan, R.R., Johnson, J.R., Lian, L.Y., Mello, L.V., Booth, D., ..., & Morgan, A. (2008).
S-nitrosylation of syntaxin 1 at Cys(145) is a regulatory switch controlling Munc18-1 binding. The Biochemical journal, 413(3), 479-91. [PubMed:18452404] [WorldCat] [DOI] - ↑
Prescott, G.R., Gorleku, O.A., Greaves, J., & Chamberlain, L.H. (2009).
Palmitoylation of the synaptic vesicle fusion machinery. Journal of neurochemistry, 110(4), 1135-49. [PubMed:19508429] [WorldCat] [DOI] - ↑
Chin, L.S., Vavalle, J.P., & Li, L. (2002).
Staring, a novel E3 ubiquitin-protein ligase that targets syntaxin 1 for degradation. The Journal of biological chemistry, 277(38), 35071-9. [PubMed:12121982] [WorldCat] [DOI] - ↑
Jewell, J.L., Luo, W., Oh, E., Wang, Z., & Thurmond, D.C. (2008).
Filamentous actin regulates insulin exocytosis through direct interaction with Syntaxin 4. The Journal of biological chemistry, 283(16), 10716-26. [PubMed:18285343] [PMC] [WorldCat] [DOI] - ↑
Minakami, R., Kato, A., & Sugiyama, H. (2000).
Interaction of Vesl-1L/Homer 1c with syntaxin 13. Biochemical and biophysical research communications, 272(2), 466-71. [PubMed:10833436] [WorldCat] [DOI] - ↑
Steiner, P., Sarria, J.C., Glauser, L., Magnin, S., Catsicas, S., & Hirling, H. (2002).
Modulation of receptor cycling by neuron-enriched endosomal protein of 21 kD. The Journal of cell biology, 157(7), 1197-209. [PubMed:12070131] [PMC] [WorldCat] [DOI] - ↑
Fasshauer, D., Otto, H., Eliason, W.K., Jahn, R., & Brünger, A.T. (1997).
Structural changes are associated with soluble N-ethylmaleimide-sensitive fusion protein attachment protein receptor complex formation. The Journal of biological chemistry, 272(44), 28036-41. [PubMed:9346956] [WorldCat] [DOI] - ↑
Sutton, R.B., Fasshauer, D., Jahn, R., & Brunger, A.T. (1998).
Crystal structure of a SNARE complex involved in synaptic exocytosis at 2.4 A resolution. Nature, 395(6700), 347-53. [PubMed:9759724] [WorldCat] [DOI] - ↑
Hayashi, T., McMahon, H., Yamasaki, S., Binz, T., Hata, Y., Südhof, T.C., & Niemann, H. (1994).
Synaptic vesicle membrane fusion complex: action of clostridial neurotoxins on assembly. The EMBO journal, 13(21), 5051-61. [PubMed:7957071] [PMC] [WorldCat] - ↑
Chapman, E.R. (2008).
How does synaptotagmin trigger neurotransmitter release? Annual review of biochemistry, 77, 615-41. [PubMed:18275379] [WorldCat] [DOI] - ↑
Südhof, T.C. (2012).
Calcium control of neurotransmitter release. Cold Spring Harbor perspectives in biology, 4(1), a011353. [PubMed:22068972] [PMC] [WorldCat] [DOI] - ↑
Rickman, C., & Davletov, B. (2003).
Mechanism of calcium-independent synaptotagmin binding to target SNAREs. The Journal of biological chemistry, 278(8), 5501-4. [PubMed:12496268] [WorldCat] [DOI] - ↑
Masumoto, T., Suzuki, K., Ohmori, I., Michiue, H., Tomizawa, K., Fujimura, A., ..., & Matsui, H. (2012).
Ca(2+)-independent syntaxin binding to the C(2)B effector region of synaptotagmin. Molecular and cellular neurosciences, 49(1), 1-8. [PubMed:22008253] [WorldCat] [DOI] - ↑
Kee, Y., & Scheller, R.H. (1996).
Localization of synaptotagmin-binding domains on syntaxin. The Journal of neuroscience : the official journal of the Society for Neuroscience, 16(6), 1975-81. [PubMed:8604041] [WorldCat] - ↑
Li, C., Ullrich, B., Zhang, J.Z., Anderson, R.G., Brose, N., & Südhof, T.C. (1995).
Ca(2+)-dependent and -independent activities of neural and non-neural synaptotagmins. Nature, 375(6532), 594-9. [PubMed:7791877] [WorldCat] [DOI] - ↑
Shao, X., Li, C., Fernandez, I., Zhang, X., Südhof, T.C., & Rizo, J. (1997).
Synaptotagmin-syntaxin interaction: the C2 domain as a Ca2+-dependent electrostatic switch. Neuron, 18(1), 133-42. [PubMed:9010211] [WorldCat] [DOI] - ↑
Robinson, I.M., Ranjan, R., & Schwarz, T.L. (2002).
Synaptotagmins I and IV promote transmitter release independently of Ca(2+) binding in the C(2)A domain. Nature, 418(6895), 336-40. [PubMed:12110845] [WorldCat] [DOI] - ↑
McMahon, H.T., Missler, M., Li, C., & Südhof, T.C. (1995).
Complexins: cytosolic proteins that regulate SNAP receptor function. Cell, 83(1), 111-9. [PubMed:7553862] [WorldCat] [DOI] - ↑
Ishizuka, T., Saisu, H., Suzuki, T., Kirino, Y., & Abe, T. (1997).
Molecular cloning of synaphins/complexins, cytosolic proteins involved in transmitter release, in the electric organ of an electric ray (Narke japonica). Neuroscience letters, 232(2), 107-10. [PubMed:9302098] [WorldCat] [DOI] - ↑
Chen, X., Tomchick, D.R., Kovrigin, E., Araç, D., Machius, M., Südhof, T.C., & Rizo, J. (2002).
Three-dimensional structure of the complexin/SNARE complex. Neuron, 33(3), 397-409. [PubMed:11832227] [WorldCat] [DOI] - ↑
Pabst, S., Hazzard, J.W., Antonin, W., Südhof, T.C., Jahn, R., Rizo, J., & Fasshauer, D. (2000).
Selective interaction of complexin with the neuronal SNARE complex. Determination of the binding regions. The Journal of biological chemistry, 275(26), 19808-18. [PubMed:10777504] [WorldCat] [DOI] - ↑
Hata, Y., Slaughter, C.A., & Südhof, T.C. (1993).
Synaptic vesicle fusion complex contains unc-18 homologue bound to syntaxin. Nature, 366(6453), 347-51. [PubMed:8247129] [WorldCat] [DOI] - ↑
Pevsner, J., Hsu, S.C., & Scheller, R.H. (1994).
n-Sec1: a neural-specific syntaxin-binding protein. Proceedings of the National Academy of Sciences of the United States of America, 91(4), 1445-9. [PubMed:8108429] [PMC] [WorldCat] [DOI] - ↑
Dawidowski, D., & Cafiso, D.S. (2013).
Allosteric control of syntaxin 1a by Munc18-1: characterization of the open and closed conformations of syntaxin. Biophysical journal, 104(7), 1585-94. [PubMed:23561535] [PMC] [WorldCat] [DOI] - ↑
Burkhardt, P., Hattendorf, D.A., Weis, W.I., & Fasshauer, D. (2008).
Munc18a controls SNARE assembly through its interaction with the syntaxin N-peptide. The EMBO journal, 27(7), 923-33. [PubMed:18337752] [PMC] [WorldCat] [DOI] - ↑
Sassa, T., Harada, S., Ogawa, H., Rand, J.B., Maruyama, I.N., & Hosono, R. (1999).
Regulation of the UNC-18-Caenorhabditis elegans syntaxin complex by UNC-13. The Journal of neuroscience : the official journal of the Society for Neuroscience, 19(12), 4772-7. [PubMed:10366611] [PMC] [WorldCat] - ↑
Zilly, F.E., Sørensen, J.B., Jahn, R., & Lang, T. (2006).
Munc18-bound syntaxin readily forms SNARE complexes with synaptobrevin in native plasma membranes. PLoS biology, 4(10), e330. [PubMed:17002520] [PMC] [WorldCat] [DOI] - ↑
Dulubova, I., Khvotchev, M., Liu, S., Huryeva, I., Südhof, T.C., & Rizo, J. (2007).
Munc18-1 binds directly to the neuronal SNARE complex. Proceedings of the National Academy of Sciences of the United States of America, 104(8), 2697-702. [PubMed:17301226] [PMC] [WorldCat] [DOI] - ↑
Rickman, C., Medine, C.N., Bergmann, A., & Duncan, R.R. (2007).
Functionally and spatially distinct modes of munc18-syntaxin 1 interaction. The Journal of biological chemistry, 282(16), 12097-103. [PubMed:17264080] [PMC] [WorldCat] [DOI] - ↑
Fujita, Y., Sasaki, T., Fukui, K., Kotani, H., Kimura, T., Hata, Y., ..., & Takai, Y. (1996).
Phosphorylation of Munc-18/n-Sec1/rbSec1 by protein kinase C: its implication in regulating the interaction of Munc-18/n-Sec1/rbSec1 with syntaxin. The Journal of biological chemistry, 271(13), 7265-8. [PubMed:8631738] [WorldCat] [DOI] - ↑
Shuang, R., Zhang, L., Fletcher, A., Groblewski, G.E., Pevsner, J., & Stuenkel, E.L. (1998).
Regulation of Munc-18/syntaxin 1A interaction by cyclin-dependent kinase 5 in nerve endings. The Journal of biological chemistry, 273(9), 4957-66. [PubMed:9478941] [WorldCat] [DOI] - ↑
Tian, J.H., Das, S., & Sheng, Z.H. (2003).
Ca2+-dependent phosphorylation of syntaxin-1A by the death-associated protein (DAP) kinase regulates its interaction with Munc18. The Journal of biological chemistry, 278(28), 26265-74. [PubMed:12730201] [WorldCat] [DOI] - ↑
Rickman, C., & Duncan, R.R. (2010).
Munc18/Syntaxin interaction kinetics control secretory vesicle dynamics. The Journal of biological chemistry, 285(6), 3965-72. [PubMed:19748891] [PMC] [WorldCat] [DOI] - ↑
Connell, E., Darios, F., Broersen, K., Gatsby, N., Peak-Chew, S.Y., Rickman, C., & Davletov, B. (2007).
Mechanism of arachidonic acid action on syntaxin-Munc18. EMBO reports, 8(4), 414-9. [PubMed:17363971] [PMC] [WorldCat] [DOI] - ↑
Camoletto, P.G., Vara, H., Morando, L., Connell, E., Marletto, F.P., Giustetto, M., ..., & Ledesma, M.D. (2009).
Synaptic vesicle docking: sphingosine regulates syntaxin1 interaction with Munc18. PloS one, 4(4), e5310. [PubMed:19390577] [PMC] [WorldCat] [DOI] - ↑
Misura, K.M., Scheller, R.H., & Weis, W.I. (2000).
Three-dimensional structure of the neuronal-Sec1-syntaxin 1a complex. Nature, 404(6776), 355-62. [PubMed:10746715] [WorldCat] [DOI] - ↑
Hammarlund, M., Palfreyman, M.T., Watanabe, S., Olsen, S., & Jorgensen, E.M. (2007).
Open syntaxin docks synaptic vesicles. PLoS biology, 5(8), e198. [PubMed:17645391] [PMC] [WorldCat] [DOI] - ↑
Ma, C., Li, W., Xu, Y., & Rizo, J. (2011).
Munc13 mediates the transition from the closed syntaxin-Munc18 complex to the SNARE complex. Nature structural & molecular biology, 18(5), 542-9. [PubMed:21499244] [PMC] [WorldCat] [DOI] - ↑
Hammarlund, M., Watanabe, S., Schuske, K., & Jorgensen, E.M. (2008).
CAPS and syntaxin dock dense core vesicles to the plasma membrane in neurons. The Journal of cell biology, 180(3), 483-91. [PubMed:18250196] [PMC] [WorldCat] [DOI] - ↑
Richmond, J.E., Weimer, R.M., & Jorgensen, E.M. (2001).
An open form of syntaxin bypasses the requirement for UNC-13 in vesicle priming. Nature, 412(6844), 338-41. [PubMed:11460165] [PMC] [WorldCat] [DOI] - ↑
Seagar, M., Lévêque, C., Charvin, N., Marquèze, B., Martin-Moutot, N., Boudier, J.A., ..., & Takahashi, M. (1999).
Interactions between proteins implicated in exocytosis and voltage-gated calcium channels. Philosophical transactions of the Royal Society of London. Series B, Biological sciences, 354(1381), 289-97. [PubMed:10212477] [PMC] [WorldCat] [DOI] - ↑
Catterall, W.A. (1999).
Interactions of presynaptic Ca2+ channels and snare proteins in neurotransmitter release. Annals of the New York Academy of Sciences, 868, 144-59. [PubMed:10414292] [WorldCat] [DOI] - ↑
Zamponi, G.W. (2003).
Regulation of presynaptic calcium channels by synaptic proteins. Journal of pharmacological sciences, 92(2), 79-83. [PubMed:12832834] [WorldCat] [DOI] - ↑
Lévêque, C., el Far, O., Martin-Moutot, N., Sato, K., Kato, R., Takahashi, M., & Seagar, M.J. (1994).
Purification of the N-type calcium channel associated with syntaxin and synaptotagmin. A complex implicated in synaptic vesicle exocytosis. The Journal of biological chemistry, 269(9), 6306-12. [PubMed:8119979] [WorldCat] - ↑
Yoshida, A., Oho, C., Omori, A., Kuwahara, R., Ito, T., & Takahashi, M. (1992).
HPC-1 is associated with synaptotagmin and omega-conotoxin receptor. The Journal of biological chemistry, 267(35), 24925-8. [PubMed:1334074] [WorldCat] - ↑
Sheng, Z.H., Rettig, J., Takahashi, M., & Catterall, W.A. (1994).
Identification of a syntaxin-binding site on N-type calcium channels. Neuron, 13(6), 1303-13. [PubMed:7993624] [WorldCat] [DOI] - ↑
Jarvis, S.E., Barr, W., Feng, Z.P., Hamid, J., & Zamponi, G.W. (2002).
Molecular determinants of syntaxin 1 modulation of N-type calcium channels. The Journal of biological chemistry, 277(46), 44399-407. [PubMed:12221094] [WorldCat] [DOI] - ↑
Sheng, Z.H., Rettig, J., Cook, T., & Catterall, W.A. (1996).
Calcium-dependent interaction of N-type calcium channels with the synaptic core complex. Nature, 379(6564), 451-4. [PubMed:8559250] [WorldCat] [DOI] - ↑
Bezprozvanny, I., Zhong, P., Scheller, R.H., & Tsien, R.W. (2000).
Molecular determinants of the functional interaction between syntaxin and N-type Ca2+ channel gating. Proceedings of the National Academy of Sciences of the United States of America, 97(25), 13943-8. [PubMed:11087812] [PMC] [WorldCat] [DOI] - ↑
Jarvis, S.E., Magga, J.M., Beedle, A.M., Braun, J.E., & Zamponi, G.W. (2000).
G protein modulation of N-type calcium channels is facilitated by physical interactions between syntaxin 1A and Gbetagamma. The Journal of biological chemistry, 275(9), 6388-94. [PubMed:10692440] [WorldCat] [DOI] - ↑
Xu, J., Luo, F., Zhang, Z., Xue, L., Wu, X.S., Chiang, H.C., ..., & Wu, L.G. (2013).
SNARE proteins synaptobrevin, SNAP-25, and syntaxin are involved in rapid and slow endocytosis at synapses. Cell reports, 3(5), 1414-21. [PubMed:23643538] [PMC] [WorldCat] [DOI] - ↑
Chen, Y.A., Scales, S.J., Patel, S.M., Doung, Y.C., & Scheller, R.H. (1999).
SNARE complex formation is triggered by Ca2+ and drives membrane fusion. Cell, 97(2), 165-74. [PubMed:10219238] [WorldCat] [DOI] - ↑
Nouvian, R., Neef, J., Bulankina, A.V., Reisinger, E., Pangršič, T., Frank, T., ..., & Moser, T. (2011).
Exocytosis at the hair cell ribbon synapse apparently operates without neuronal SNARE proteins. Nature neuroscience, 14(4), 411-3. [PubMed:21378973] [WorldCat] [DOI] - ↑
Mochida, S., Saisu, H., Kobayashi, H., & Abe, T. (1995).
Impairment of syntaxin by botulinum neurotoxin C1 or antibodies inhibits acetylcholine release but not Ca2+ channel activity. Neuroscience, 65(3), 905-15. [PubMed:7609887] [WorldCat] [DOI] - ↑
Sugimori, M., Tong, C.K., Fukuda, M., Moreira, J.E., Kojima, T., Mikoshiba, K., & Llinás, R. (1998).
Presynaptic injection of syntaxin-specific antibodies blocks transmission in the squid giant synapse. Neuroscience, 86(1), 39-51. [PubMed:9692742] [WorldCat] [DOI] - ↑
Kushima, Y., Fujiwara, T., Morimoto, T., & Akagawa, K. (1995).
Involvement of HPC-1/syntaxin-1A antigen in transmitter release from PC12h cells. Biochemical and biophysical research communications, 212(1), 97-103. [PubMed:7612024] [WorldCat] [DOI] - ↑ 111.0 111.1
O'Connor, V., Heuss, C., De Bello, W.M., Dresbach, T., Charlton, M.P., Hunt, J.H., ..., & Schäfer, T. (1997).
Disruption of syntaxin-mediated protein interactions blocks neurotransmitter secretion. Proceedings of the National Academy of Sciences of the United States of America, 94(22), 12186-91. [PubMed:9342384] [PMC] [WorldCat] [DOI] - ↑ 112.0 112.1
Stanley, E.F., Reese, T.S., & Wang, G.Z. (2003).
Molecular scaffold reorganization at the transmitter release site with vesicle exocytosis or botulinum toxin C1. The European journal of neuroscience, 18(8), 2403-7. [PubMed:14622203] [WorldCat] [DOI] - ↑ 113.0 113.1
de Wit, H., Cornelisse, L.N., Toonen, R.F., & Verhage, M. (2006).
Docking of secretory vesicles is syntaxin dependent. PloS one, 1, e126. [PubMed:17205130] [PMC] [WorldCat] [DOI] - ↑
Cohen, R., Marom, M., & Atlas, D. (2007).
Depolarization-evoked secretion requires two vicinal transmembrane cysteines of syntaxin 1A. PloS one, 2(12), e1273. [PubMed:18060067] [PMC] [WorldCat] [DOI] - ↑
Bezprozvanny, I., Scheller, R.H., & Tsien, R.W. (1995).
Functional impact of syntaxin on gating of N-type and Q-type calcium channels. Nature, 378(6557), 623-6. [PubMed:8524397] [WorldCat] [DOI] - ↑
Sutton, K.G., McRory, J.E., Guthrie, H., Murphy, T.H., & Snutch, T.P. (1999).
P/Q-type calcium channels mediate the activity-dependent feedback of syntaxin-1A. Nature, 401(6755), 800-4. [PubMed:10548106] [WorldCat] [DOI] - ↑
Keith, R.K., Poage, R.E., Yokoyama, C.T., Catterall, W.A., & Meriney, S.D. (2007).
Bidirectional modulation of transmitter release by calcium channel/syntaxin interactions in vivo. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(2), 265-9. [PubMed:17215385] [PMC] [WorldCat] [DOI] - ↑
Han, X., Wang, C.T., Bai, J., Chapman, E.R., & Jackson, M.B. (2004).
Transmembrane segments of syntaxin line the fusion pore of Ca2+-triggered exocytosis. Science (New York, N.Y.), 304(5668), 289-92. [PubMed:15016962] [WorldCat] [DOI] - ↑
Davis, S., Rodger, J., Hicks, A., Mallet, J., & Laroche, S. (1996).
Brain structure and task-specific increase in expression of the gene encoding syntaxin 1B during learning in the rat: a potential molecular marker for learning-induced synaptic plasticity in neural networks. The European journal of neuroscience, 8(10), 2068-74. [PubMed:8921297] [WorldCat] [DOI] - ↑
Hicks, A., Davis, S., Rodger, J., Helme-Guizon, A., Laroche, S., & Mallet, J. (1997).
Synapsin I and syntaxin 1B: key elements in the control of neurotransmitter release are regulated by neuronal activation and long-term potentiation in vivo. Neuroscience, 79(2), 329-40. [PubMed:9200718] [WorldCat] [DOI] - ↑
Helme-Guizon, A., Davis, S., Israel, M., Lesbats, B., Mallet, J., Laroche, S., & Hicks, A. (1998).
Increase in syntaxin 1B and glutamate release in mossy fibre terminals following induction of LTP in the dentate gyrus: a candidate molecular mechanism underlying transsynaptic plasticity. The European journal of neuroscience, 10(7), 2231-7. [PubMed:9749751] [WorldCat] [DOI] - ↑
Guo, C.H., Senzel, A., Li, K., & Feng, Z.P. (2010).
De novo protein synthesis of syntaxin-1 and dynamin-1 in long-term memory formation requires CREB1 gene transcription in Lymnaea stagnalis. Behavior genetics, 40(5), 680-93. [PubMed:20563839] [WorldCat] [DOI] - ↑
Mohanasundaram, P., & Shanmugam, M.M. (2010).
Role of syntaxin 4 in activity-dependent exocytosis and synaptic plasticity in hippocampal neurons. Science signaling, 3(144), jc7. [PubMed:20959521] [WorldCat] [DOI] - ↑ 124.0 124.1
Jurado, S., Goswami, D., Zhang, Y., Molina, A.J., Südhof, T.C., & Malenka, R.C. (2013).
LTP requires a unique postsynaptic SNARE fusion machinery. Neuron, 77(3), 542-58. [PubMed:23395379] [PMC] [WorldCat] [DOI] - ↑
Arendt, K.L., Zhang, Y., Jurado, S., Malenka, R.C., Südhof, T.C., & Chen, L. (2015).
Retinoic Acid and LTP Recruit Postsynaptic AMPA Receptors Using Distinct SNARE-Dependent Mechanisms. Neuron, 86(2), 442-56. [PubMed:25843403] [PMC] [WorldCat] [DOI] - ↑
Igarashi, M., Kozaki, S., Terakawa, S., Kawano, S., Ide, C., & Komiya, Y. (1996).
Growth cone collapse and inhibition of neurite growth by Botulinum neurotoxin C1: a t-SNARE is involved in axonal growth. The Journal of cell biology, 134(1), 205-15. [PubMed:8698815] [PMC] [WorldCat] [DOI] - ↑
Zhou, Q., Xiao, J., & Liu, Y. (2000).
Participation of syntaxin 1A in membrane trafficking involving neurite elongation and membrane expansion. Journal of neuroscience research, 61(3), 321-8. [PubMed:10900079] [WorldCat] [DOI] - ↑
Kabayama, H., Takeuchi, M., Taniguchi, M., Tokushige, N., Kozaki, S., Mizutani, A., ..., & Mikoshiba, K. (2011).
Syntaxin 1B suppresses macropinocytosis and semaphorin 3A-induced growth cone collapse. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(20), 7357-64. [PubMed:21593320] [PMC] [WorldCat] [DOI] - ↑
Hirling, H., Steiner, P., Chaperon, C., Marsault, R., Regazzi, R., & Catsicas, S. (2000).
Syntaxin 13 is a developmentally regulated SNARE involved in neurite outgrowth and endosomal trafficking. The European journal of neuroscience, 12(6), 1913-23. [PubMed:10886332] [WorldCat] [DOI] - ↑
Chen, Y., Gan, B.Q., & Tang, B.L. (2010).
Syntaxin 16: unraveling cellular physiology through a ubiquitous SNARE molecule. Journal of cellular physiology, 225(2), 326-32. [PubMed:20589833] [WorldCat] [DOI] - ↑
Blasi, J., Chapman, E.R., Yamasaki, S., Binz, T., Niemann, H., & Jahn, R. (1993).
Botulinum neurotoxin C1 blocks neurotransmitter release by means of cleaving HPC-1/syntaxin. The EMBO journal, 12(12), 4821-8. [PubMed:7901002] [PMC] [WorldCat] - ↑
Schiavo, G., Shone, C.C., Bennett, M.K., Scheller, R.H., & Montecucco, C. (1995).
Botulinum neurotoxin type C cleaves a single Lys-Ala bond within the carboxyl-terminal region of syntaxins. The Journal of biological chemistry, 270(18), 10566-70. [PubMed:7737992] [WorldCat] [DOI] - ↑
Wong, A.H., Trakalo, J., Likhodi, O., Yusuf, M., Macedo, A., Azevedo, M.H., ..., & Kennedy, J.L. (2004).
Association between schizophrenia and the syntaxin 1A gene. Biological psychiatry, 56(1), 24-9. [PubMed:15219469] [WorldCat] [DOI] - ↑
Castillo, M.A., Ghose, S., Tamminga, C.A., & Ulery-Reynolds, P.G. (2010).
Deficits in syntaxin 1 phosphorylation in schizophrenia prefrontal cortex. Biological psychiatry, 67(3), 208-16. [PubMed:19748077] [WorldCat] [DOI] - ↑
Gil-Pisa, I., Munarriz-Cuezva, E., Ramos-Miguel, A., Urigüen, L., Meana, J.J., & García-Sevilla, J.A. (2012).
Regulation of munc18-1 and syntaxin-1A interactive partners in schizophrenia prefrontal cortex: down-regulation of munc18-1a isoform and 75 kDa SNARE complex after antipsychotic treatment. The international journal of neuropsychopharmacology, 15(5), 573-88. [PubMed:21669024] [WorldCat] [DOI] - ↑
Nakamura, K., Anitha, A., Yamada, K., Tsujii, M., Iwayama, Y., Hattori, E., ..., & Mori, N. (2008).
Genetic and expression analyses reveal elevated expression of syntaxin 1A ( STX1A) in high functioning autism. The international journal of neuropsychopharmacology, 11(8), 1073-84. [PubMed:18593506] [WorldCat] [DOI] - ↑
Cao, F., Hata, R., Zhu, P., Niinobe, M., & Sakanaka, M. (2009).
Up-regulation of syntaxin1 in ischemic cortex after permanent focal ischemia in rats. Brain research, 1272, 52-61. [PubMed:19344701] [WorldCat] [DOI] - ↑
Fukushima, T., Takasusuki, T., Tomitori, H., & Hori, Y. (2011).
Possible involvement of syntaxin 1A downregulation in the late phase of allodynia induced by peripheral nerve injury. Neuroscience, 175, 344-57. [PubMed:21129445] [WorldCat] [DOI] - ↑
Fujiwara, T., Mishima, T., Kofuji, T., Chiba, T., Tanaka, K., Yamamoto, A., & Akagawa, K. (2006).
Analysis of knock-out mice to determine the role of HPC-1/syntaxin 1A in expressing synaptic plasticity. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(21), 5767-76. [PubMed:16723534] [PMC] [WorldCat] [DOI] - ↑
Fujiwara, T., Snada, M., Kofuji, T., Yoshikawa, T., & Akagawa, K. (2010).
HPC-1/syntaxin 1A gene knockout mice show abnormal behavior possibly related to a disruption in 5-HTergic systems. The European journal of neuroscience, 32(1), 99-107. [PubMed:20576034] [WorldCat] [DOI] - ↑
Fujiwara, T., Kofuji, T., & Akagawa, K. (2011).
Dysfunction of the hypothalamic-pituitary-adrenal axis in STX1A knockout mice. Journal of neuroendocrinology, 23(12), 1222-30. [PubMed:21910766] [WorldCat] [DOI] - ↑
Mishima, T., Fujiwara, T., Sanada, M., Kofuji, T., Kanai-Azuma, M., & Akagawa, K. (2014).
Syntaxin 1B, but not syntaxin 1A, is necessary for the regulation of synaptic vesicle exocytosis and of the readily releasable pool at central synapses. PloS one, 9(2), e90004. [PubMed:24587181] [PMC] [WorldCat] [DOI] - ↑
Gerber, S.H., Rah, J.C., Min, S.W., Liu, X., de Wit, H., Dulubova, I., ..., & Südhof, T.C. (2008).
Conformational switch of syntaxin-1 controls synaptic vesicle fusion. Science (New York, N.Y.), 321(5895), 1507-10. [PubMed:18703708] [PMC] [WorldCat] [DOI] - ↑
Schulze, K.L., Broadie, K., Perin, M.S., & Bellen, H.J. (1995).
Genetic and electrophysiological studies of Drosophila syntaxin-1A demonstrate its role in nonneuronal secretion and neurotransmission. Cell, 80(2), 311-20. [PubMed:7834751] [WorldCat] [DOI] - ↑
Broadie, K., Prokop, A., Bellen, H.J., O'Kane, C.J., Schulze, K.L., & Sweeney, S.T. (1995).
Syntaxin and synaptobrevin function downstream of vesicle docking in Drosophila. Neuron, 15(3), 663-73. [PubMed:7546745] [WorldCat] [DOI] - ↑
Wu, M.N., Fergestad, T., Lloyd, T.E., He, Y., Broadie, K., & Bellen, H.J. (1999).
Syntaxin 1A interacts with multiple exocytic proteins to regulate neurotransmitter release in vivo. Neuron, 23(3), 593-605. [PubMed:10433270] [WorldCat] [DOI] - ↑
Stewart, B.A., Mohtashami, M., Trimble, W.S., & Boulianne, G.L. (2000).
SNARE proteins contribute to calcium cooperativity of synaptic transmission. Proceedings of the National Academy of Sciences of the United States of America, 97(25), 13955-60. [PubMed:11095753] [PMC] [WorldCat] [DOI] - ↑
Littleton, J.T., Chapman, E.R., Kreber, R., Garment, M.B., Carlson, S.D., & Ganetzky, B. (1998).
Temperature-sensitive paralytic mutations demonstrate that synaptic exocytosis requires SNARE complex assembly and disassembly. Neuron, 21(2), 401-13. [PubMed:9728921] [WorldCat] [DOI] - ↑
Fergestad, T., Wu, M.N., Schulze, K.L., Lloyd, T.E., Bellen, H.J., & Broadie, K. (2001).
Targeted mutations in the syntaxin H3 domain specifically disrupt SNARE complex function in synaptic transmission. The Journal of neuroscience : the official journal of the Society for Neuroscience, 21(23), 9142-50. [PubMed:11717347] [PMC] [WorldCat]
