間脳の発生
村上 安則
愛媛大学大学院理工学研究科
DOI:10.14931/bsd.7597 原稿受付日:2018年3月26日 原稿完成日:2018年X月X日
担当編集委員:大隅 典子(東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)
英語名:development of diencephalon 独:Entwicklung von Diencephalon 仏:développement de diencéphale
間脳は脊椎動物の神経管の前端において、終脳と中脳の間に発生する領域である。胚発生期の間脳原基には様々な遺伝子が特徴的なパターンで発現し、前後軸や背腹軸に沿ったパターニングがなされる。その過程で間脳にはプロソメアと呼ばれる分節構造が生じる[1][2][3][4]。その後、間脳からは目(の網膜)や松果体、視床など、様々な構造が発生する。また、視床と終脳をつなぐ軸索路などの重要な神経回路もつくられる。
(編集部コメント:長い段落は適宜改行するか、小見出しを付けて頂ければと思います。)
脊椎動物の成体の間脳形態
間脳は、その後方の視蓋前域(視蓋前域を中脳に含める場合もある)で中脳と接し、前方では視神経交叉のところで終脳と接している脳領域である。この構築は現在知られている全ての脊椎動物で共通している。一般的な神経解剖学の教科書では哺乳類の間脳は比較的小さな視床上部、巨大な視床複合体(以下、視床と呼ぶ)、腹側視床、視床下部が区別される。ただし、後に述べるようにこの区分けは発生学的知見などを基に提唱されている領域とは合致しない部分がある。 (編集部コメント:以下小見出しを付けました。ご確認下さい。村上:ありがとうございます。これで問題ありません)
視床上部
手綱核群、上生体(松果体)、視蓋前域などから構成される。基底核や辺縁系と連絡する手綱核群は、手綱交連によって互いに連絡している。多くの脊椎動物では、手綱核の背側に光受容やサーカディアンリズムにかかわる上生体(松果体)が発生する。これはヒトでは単一の構造であるが、脊椎動物のいくつかの系統では上生体の他に、副松果体(parapineal organ;魚類)、前頭器官(pineal organ; 両生類)、頭頂眼(parietal eye;爬虫類)が生じる[5][6]。これらは上生体と共に松果体複合体と呼ばれている。また、多くの脊椎動物では手綱核に左右非対称性が見られる。間脳背側にこのような左右非対称な構造が形成される仕組みについては、Nodalシグナルが発生期の視床上部の左側で特異的に働いていることが真骨類(Teleosts)のゼブラフィッシュ、軟骨魚類(Chondrichthyes)のトラザメ、円口類(Cyclostomes)のヤツメウナギで知られている。トラザメではNodalの下流標的因子であるPitx2が手綱核で左右非対称に発現し、トラザメとヤツメウナギではMAPK-ERKの活性が右の手綱核で見られる[7]。こうしたことから、手綱核群と松果体複合体の非対称性形成に関わる分子機構の起源は脊椎動物の共通祖先にまで遡る可能性が指摘されている。
視床
羊膜類でよく発達し、他の間脳領域に比べて肥大している。哺乳類では一般的に、視床は新皮質へ入力する神経線維の最も重要な中継地の一つとなり、嗅覚を除く全ての感覚系の上行性経路は特定の視床核に入力する。そしてそれらの神経核は終脳の新皮質領域と相互に連絡する。視床が終脳と密接な連絡をもつことは他の羊膜類(爬虫類と鳥類)でも同様である。しかしながら、無羊膜類では視床はそれほど発達しない。
腹側視床
視床と視床下部の間に位置する。視床網様核、不確帯、視床下核などの神経核がある。
視床下部
漏斗、灰白隆起、乳頭体など多くの神経要素を含み、自律神経系の中枢として内分泌系と密接に関係し、自律神経機能、摂食、日周期リズムなど生物の生存に必須な機能(いわゆる植物神経系としての機能)を担う。睡眠と覚醒の制御に関わることでも知られる。視床下部は下垂体と結合していることから血液を介して内分泌系にも影響を及ぼしている。視床下部は無羊膜類ではよく発達し、一般的には視床よりも大きな領域を占める。羊膜類の段階になると、視床のサイズが視床下部を凌駕するようになる[8]。
初期発生
(編集部コメント:高橋先生の項目から図を引用しました。村上先生の方でOKでしたら、高橋先生には編集部からご許可をお願い致します。村上:OKです。ありがとうございます)
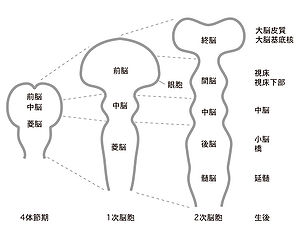
哺乳類や鳥類では発生の過程で神経管の前端が膨らみ、前脳胞、中脳胞、後脳胞(菱脳胞)となり、それらから各脳領域が形成される(図1)。これらのうち前脳胞から間脳と終脳が分化する。このとき、終脳は前脳胞の前方に、間脳はその後方に生ずる。間脳の原基は左右に突出して眼胞を生じ、そこには層状の網膜が発生して、神経節細胞やアマクリン細胞などのニューロンの形成が行われる。神経管の内腔のうち、間脳の部分は第三脳室となる。神経管の脳室側(脳室帯)からは間脳の前駆細胞が発生し、それらが分裂して生じた神経細胞は外側へと移動して神経核を形成する。ニワトリを用いた研究から、間脳と中脳の境界はPax6とEn1/Pax2の間での抑制的な相互作用により決定されることがわかっている[10]。神経管の背側には蓋板と翼板があり、腹側には基板と底板がある。この構成は間脳でも他の脳領域と同様である。
前脳分節
プロソメア:prosomeres
間脳では発生の進行につれ前後軸に沿った形態学的、組織学的な領域化が起こり、分節的な構造(神経分節:neuromeres)が生じ、その中から様々な神経核が発生していく。この構造はRubenstein、 Martinez、 嶋村、Puellesによってプロソメア(p1, p2, p3)と名付けられている[1][12][2][3][4]。
これまでの発生学的研究から、各々のプロソメアを規定するいくつかの指標が提示されている。脊椎動物の発生初期に現れる軸索路として知られる基本的神経回路(後交連:p1;手綱交連:p2)や、転写因子の発現(Lhx1/5とPax3/7が共発現していればp1;Ebf1が発現していればp1;Lhx2/9やDlx2が発現していればp2;Lhx1/5とDlx1/6が共発現していればp3;Gbx2が発現していればp2;Tcf4の発現の前端がp2とp3の境界)などがそれにあたる[1][13][14][15]。
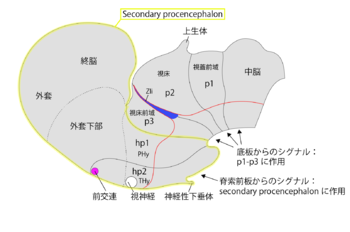
また重要な点として、神経管腹側のShhの発現が背側に伸びてきて峡部オーガナイザー(Zona limitans intrathalamica: Zli)を形成し、峡部オーガナイザーからのShhシグナルがプロソメア2とプロソメア3の分化に関わり、峡部オーガナイザーがp2とp3の境界となる(図2)[16][17]。また、峡部オーガナイザーの背側で発現するFgf8も間脳のパターニングに関与している[18][19]。同様にWntシグナルも重要な役割を担う[20]。Shhのシグナルは間脳の神経前駆細胞の配置様式にも大きな影響を及ぼす[21]。
神経回路形成
基本的神経路
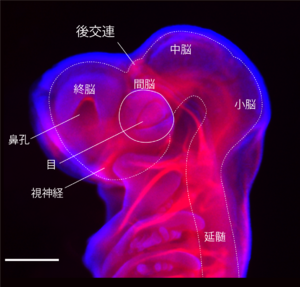
間脳の発生の進行に伴い、その内部には様々な神経回路が生じる。発生初期には基本的神経路(early axon scaffold)として、脊椎動物で高度に保存された神経路が形成され、発生後期に作られる多くの神経路の足場としても重要な役割を担う[22][23]。これらのうち、間脳では後交連や手綱交連、tract of postoptic commissure(TPOC)などが発生する(図3)。後交連は、間脳の後方背側、中脳と接するところに生じ、プロソメア1を特徴づける構造となる。手綱交連は間脳の背側で後交連の前方に生じ、プロソメア2の特徴の一つとなる。これらの交連は円口類の段階から見られるため、脊椎動物の共通祖先の段階ですでに獲得されていた可能性がある。後交連と手綱交連はクジラ類では融合して交連複合体を形成する[24]。後交連やTPOCの形成にはPax6が関わるとされる[25][26]。
視床ー終脳軸索投射
間脳からは終脳に向けて数多くの神経が伸びていく。特に羊膜類では視床に嗅覚以外の全ての感覚が集められ、そこから終脳に多くの軸索が入力する。これらの線維は一般的に「視床-終脳路」と呼ばれている。これらの神経がどのような仕組みで終脳に入力するのかについてはこれまでに主にマウスを用いて多くの研究がなされている。視床-終脳路の道筋には軸索をガイドするタンパク質群があり、視床の神経核から伸びる軸索は、それらのシグナルを受け取り応答することによって迷うことなく正確に目的地にたどり着く。例えば,視床下部に発現するNkx2.1 は,神経ガイド分子の一種Slitの発現を調節しており、この分子の反発作用によって視床から終脳に伸びていく軸索は終脳の方向に向きを変える[27]。その他にも,視床の神経核では、膜結合型のタンパク質でありチロシンキナーゼドメインを持つ神経ガイド因子のEph(EphA3, EphA4, EphA7)が勾配をもって発現している。そのため、そこから伸びる軸索にはEphを多く発現しているものから少なく発現しているものがあり、それらの軸索は終脳側にあるリガンドである膜タンパク質エフリンA5の勾配に応答し、反発性相互作用により、Ephの濃度に応じて振り分けられることで特異的な投射が形成される[28]。また、誘因性のガイド因子であるネトリン1が視床の軸索を終脳へ誘引していくことにより多くの軸索が終脳へ入力できるようになるという報告がある[29]。ただし、ネトリン1は視床前部のニューロンには誘因性に作用するが、視床後部のニューロンに対しては反発性に作用する。
視床―終脳路は哺乳類では内包を形成し終脳半球の内側部を通るが、これは羊膜類では例外的であり、他の羊膜類では線条体の外側を抜けるような経路をとる。この進路決定には、哺乳類の終脳で発現するSlit2が関与していることが知られている[30]。哺乳類のマウスでは、軸索を誘引する働きを有する細胞群(コリドール・ガイドポスト細胞)が外側基底核原基(LGE)から内側基底核原基(MGE)の方向へ向けて移動するが、この際にSlit2が終脳の腹側から背側に拡大して発現することにより、その細胞群はSlit2の反発作用を受け、視床軸索と近接する領域に移動する。これにより、視床から伸長する軸索はこれら細胞群の誘引作用を受けられるようになり、終脳の内側を通るようになる。一方、主竜類のようにSlit2が終脳腹側に限局して発現をしていた場合、ガイドポスト細胞はSlit2による反発作用を受けず、視床軸索とは離れた位置に移動する。その結果、視床軸索はこれら細胞群の誘引作用を受けず、終脳の外側を通る。
体性感覚地図
脊椎動物の脳にある感覚性神経回路には、末梢にある受容器の配置がそのままニューロン配置に変換されることで局所対応性地図(トポグラフィックマップ)がつくられる。これは視覚系、聴覚系、体性感覚系、味覚系など様々な感覚系で見られる。間脳の神経核にもそのような地図が発生するが、それらの中ではマウスの体性感覚地図に関する研究が進んでいる。
哺乳類の多くでは口の周りに長い毛が見られる。それらはその付け根に血管が入るために空洞になっていることから洞毛と呼ばれる.これらのヒゲは上顎に規則正しい配置で並んでおり、鰓弓神経の一つである三叉神経の上顎枝によって支配されている。三叉神経の軸索は菱脳(後脳)のロンボメア2にある神経根を通って菱脳に入り,菱脳の前方にある三叉神経主知覚核と、後方にある三叉神経脊髄路核に入力する.これらの神経核の中では,神経細胞が洞毛の空間的な配置をそっくりそのまま写し取ったかのように配置されており、その形態はバレレット(barrelettes)と呼ばれている。哺乳類の三叉神経系では,菱脳のニューロンの配置によってつくられた地図がその位置関係を保ったまま間脳の視床へ、そして最終的に終脳の体性感覚野へ伝えられている。間脳の視床後内側腹側核で見られるパターンはバレロイド(barreloids)、終脳で見られるものはバレル(barrels)と呼ばれている。こうした地図は生後に神経活動依存的な仕組みによって形成されるが、発生期に発現する転写因子もその形成に間接的に関わることが知られている。視床腹側内側核のバレロイドの形成はDRG11やNMDA型グルタミン酸受容体の変異体で異常が生じる[31]。また、菱脳(後脳)に発現するHoxa2のコンディショナルノックアウトマウスでもその形成が妨げられるが、これは後脳の三叉神経主知覚核にできるバレレットの形成が妨げられたことによる二次的な影響であると考えられる。
網膜視蓋投射
網膜は前脳の一部が左右に突出して眼胞を形成し、そこから発生する構造である。したがって、網膜やそこにある神経節細胞などのニューロン形成も間脳の発生に含められるべきであるが、それらの詳細は他の項「視覚系の発生」などに譲り、本項では網膜から出力する求心性神経の発生について概説する。
脊椎動物では、視覚の情報が視蓋(上丘)に投射する過程(網膜視蓋投射)では、鼻側の網膜の軸索は視蓋の尾側へ投射し,側頭部側の網膜の軸索は視蓋の吻側へ投射することで、トポグラフィックマップが形成される。この過程ではEphとエフリンとの反発的な相互作用が重要な役割を担っている[32][33]。前後軸方向の軸索投射においては、EphA3を強く発現する側頭部側の視神経は,視蓋に入るとリガンドであるエフリンA2とA5と反発的に作用するためこれの強く発現する場所には入れず,エフリンの発現の弱い吻側でシナプスを作る。一方,EphA3をあまり発現していない鼻側の視神経は、視蓋に入ってもエフリンと相互作用があまり起こらないため尾側の方にまで伸長できる。また、背原軸方向の軸索投射にはEphBとエフリンBのシステムが関わる[34]。こうしたトポグラフィックマップ形成には神経活動依存的な仕組みも必須である。
間脳の形態に関する最近の考え
間脳の領域構成については、形態学、組織学、そして発生学の観点から様々な研究が行われてきた。Rendahl(1924)は間脳がsynencephalonとposterior/anterior parencephalonに分けられることを指摘している[35]。近年の分子発生学の発展に伴い、ニワトリやマウス、アフリカツメガエル等を用いて、間脳の領域が転写因子などの領域マーカー遺伝子の発現と照らし合わせて調べられ、発生期にみられるプロソメアとの対応関係が示されてきた。synencephalonとposterior/anterior parencephalonはプロソメア1とプロソメア2/3におおよそ対応している。プロソメア1に含まれる領域はさらにprecommissural、juxtacommissural、commissuralの三つの領域に細分されている[15][36]。
こうした知見を基に、現在では、成体の羊膜類、両生類、魚類の間脳は後ろから視蓋前域(pretectum)、視床(thalamus)、視床前域(prethalamus)に分けられており、これらはそれぞれプロソメア1、2、3の背側要素(翼板)に対応している[1][2][13][14][15][36][37][38][39]。これらの構成は解剖学の教科書に見られる形態学的単位と対応しない場合がある。例えば従来の考えでは視蓋前域と松果体は共に視床上部に含まれているが、後者では視蓋前域(プロソメア1)と松果体(プロソメア2)は異なる領域である。また、腹側視床と視床(背側視床)は視床前域と視床という名称に変更されている[2]。最近の比較形態学的研究や発生学的研究ではプロソメアに基づくモデルが使われる場合が多いようである。プロソメアはPuellesとRubensteinによって提唱され幾度かの改訂がなされていくうちに、間脳から終脳をカバーする大規模な分節として、菱脳のロンボメアと同じく重要な脳分節として捉えられるようになった。現在では、プロソメア1から3の三つの領域については、その存在が多くの研究者によって認められている。ただし、プロソメア3より前方にあるコンパートメントについては、現在も議論が続けられている(以下参照)。
視床下部と終脳に関する発生基盤
視床下部は、前脳の前方腹側で発生するが、他の間脳領域(プロソメア1〜3)とは発現する遺伝子の種類が異なる例が多い。視床下部は少なくともその一部は神経管の腹側の要素(基板)であると考えられており、基板を特徴づけるShhの発現が見られる。ただしShhは視床下部の全域に発現するわけではない。また、転写因子であるNkx2.1が発現していることも視床下部の特徴である[40]。この遺伝子は実際に前脳腹側の形成に関わっている[41][42]。そして、視床下部領域と終脳とを合わせたものをひとつのコンパートメントと捉える考えが、プロソメアモデルを提唱したPuellesらの研究グループから出されている[2][11](図2)。この視床下部−終脳コンパートメントはsecondary procencephalonと名付けられている。このモデルでは発生期の前脳は間脳(プロソメア1〜3)とsecondary procencephalonに分化するとされる。つまり、従来のモデルでは視床下部は間脳に含まれるが、このモデルでは視床下部はsecondary procencephalonに含まれる。前脳が後方の「間脳」と前方の「secondary procencephalon」にわかれるとする形態発生学的な根拠として、「間脳」領域の発生は腹側にある脊索の影響を受け、「secondary procencephalon」は脊索前板(prechordal plate)の影響を受けることが挙げられる。このモデルに従うなら、secondary procencephalonの背側部分が終脳で、その腹側部分が視床下部となり、同時に視床下部が神経管の最も前方の領域となる[11]。secondary procencephalonはさらにhypotyalamo-telencephalic prosomere 1と2(HP1とHP2)に細分されている。HP1が後方でHP2が前方である。視床下部はHP1に含まれる部分がpeduncular hypothalamus(PHy)、HP2に含まれる部分がterminal hypothalamus(THy)と名付けられている(図1:発生期の間脳の模式図)。終脳ではHP1が外套(pallium)と外套下部(subpallium)の多くの領域を占め、HP2は視索前野と前交連を含む領域を占める。さらに真骨魚類では終脳と視床下部の間にあるoptic recess region(視交叉陥凹部;目の網膜も含む)を一つのユニットとして認め、secondary procencephalonを三つのパートに分ける考えも出されている[43]。
魚類の間脳の形態と発生
魚類(条鰭魚類)の間脳の発生過程では,マウスや他の脊椎動物と同様にプロソメア1〜3と視床下部の領域が分化する.しかしながら,その後に分化していく神経核については他の脊椎動物には見られないようなものが出現する.その代表的なものが、間脳の腹側に発生するPG複合体(preglomerular complex)である。この神経核は発生期に視床などの間脳翼板領域の細胞が移動してくることによってできると考えられている[44][45]。この神経核複合体からの軸索は哺乳類の視床の神経核のように終脳外套に投射している[46][47]。しかしその投射先は哺乳類の新皮質(背側外套)とは必ずしも相同ではないらしい。
間脳発生機構の起源と進化
峡部オーガナイザーの起源
発生期の間脳に存在する峡部オーガナイザーはこれまで調べられてきた脊椎動物の多くの種において、脳形成に関わるオーガナイザーとして重要な役割を担っている。峡部オーガナイザーに相同な構造は、脊椎動物の姉妹群であるナメクジウオやホヤでは認められないものの、脊索動物の外群に当たる半索動物のギボシムシ(最近では半索動物と棘皮動物の類縁性が指摘され、これらは歩帯動物Ambulacrariaというクレードを構成する)で峡部オーガナイザーでのShhの発現に関わるエンハンサーの存在を示唆するデータが得られている[48][49]。そうであれば、このオーガナイザーの起源は歩帯動物と脊索動物の分岐以前に遡ることになる。
脊椎動物における間脳発生機構の多様化
間脳のプロソメア領域の起源については、現生脊椎動物の系統のうち、最も初期に分岐したとされる円口類(ヤツメウナギ類、ヌタウナギ類)において研究が進んでいる。発生期のヤツメウナギ前脳では、プロソメアを規定する遺伝子発現(Pax6、Pax3/7、Lhxなどの相同遺伝子)が見られ、峡部オーガナイザーにはShhに相同な遺伝子(HhB)が発現しており、視床下部の原基ではNkx2.1の相同遺伝子の発現が見られる。それらの領域から発生する神経要素も他の脊椎動物のものと対応している[50]。そして円口類のもう一つの系統であるヌタウナギでも、遺伝子の発現様式が他の脊椎動物やヤツメウナギとよく似ていることが明らかとなっている[51]。このことから、脊椎動物の歴史において、円口類と顎口類(Gnathostomes)の分岐以前の段階(すなわち脊椎動物の共通の祖先に極めて近い段階)で間脳のプロソメアを規定する分子基盤は成立していたと考えられる。現生脊椎動物の祖先が誕生したのはおよそ5億年前とされていることから、脊椎動物の間脳発生機構の起源は極めて古いといえる。ただし、間脳に入出力する神経路は動物ごとに多かれ少なかれ相違が見られる。例えば視覚系については、哺乳類以外の羊膜類では視神経は間脳の腹側でほぼ全てが交叉し(全交叉)、視神経は視床と中脳の視蓋に入力する(視神経の多くは視蓋に入力する)。そして視蓋から出た神経が視床の神経核(円形核)に入り、そこからの軸索が終脳の背側脳室稜(dorsal ventricular ridge: DVR)に投射する。一方、哺乳類では、視神経は間脳の腹側で完全には交叉しない(部分交叉あるいは半交叉)。ただし哺乳類でもクジラ類の視神経は全交叉あるいはそれに近い形態となる[52]。視神経は間脳の外側膝状体と中脳の上丘(視蓋に相同な領域)に入力し、外側膝状体からの軸索は新皮質の一次視覚野に投射する。このとき、視神経が部分交叉する哺乳類(食肉目や霊長目)では右目由来と左目由来の外側膝状体の軸索は混じり合うこと無く視覚野に入力し、眼優位性カラム(ocular domincance column)を形成する。視覚系のみならず、聴覚系の投射様式も哺乳類と鳥類・爬虫類では異なっている。魚類でも異なる感覚の求心性投射は終脳の特定の場所に局在しているが[47]、その投射領域は羊膜類とは異なる可能性がある。つまり、間脳はその発生メカニズムが確立された後、その基本形を維持しつつも、進化の過程で系統ごとに様々な改変がなされてきたと考えられる。
関連項目
参考文献
- ↑ 1.0 1.1 1.2 1.3
Puelles, L., & Rubenstein, J.L. (1993).
Expression patterns of homeobox and other putative regulatory genes in the embryonic mouse forebrain suggest a neuromeric organization. Trends in neurosciences, 16(11), 472-9. [PubMed:7507621] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2 2.3 2.4
Puelles, L., & Rubenstein, J.L. (2003).
Forebrain gene expression domains and the evolving prosomeric model. Trends in neurosciences, 26(9), 469-76. [PubMed:12948657] [WorldCat] [DOI] - ↑ 3.0 3.1
Rubenstein, J.L., Martinez, S., Shimamura, K., & Puelles, L. (1994).
The embryonic vertebrate forebrain: the prosomeric model. Science (New York, N.Y.), 266(5185), 578-80. [PubMed:7939711] [WorldCat] [DOI] - ↑ 4.0 4.1
Puelles, L. (1995).
A segmental morphological paradigm for understanding vertebrate forebrains. Brain, behavior and evolution, 46(4-5), 319-37. [PubMed:8564469] [WorldCat] [DOI] - ↑ Grande L, Liem KF, Walker WF
Functional anatomy of vertebrates: An Evolutionary Perspective, Third edition. Chapter 12
Harcourt college publishers, Florida:2000 - ↑ 保 智己
『見える光,見えない光』(寺北明久・蟻川謙太郎 編) pp. 135-153.
共立出版(東京):2009 - ↑
Lagadec, R., Laguerre, L., Menuet, A., Amara, A., Rocancourt, C., Péricard, P., ..., & Boutet, A. (2015).
The ancestral role of nodal signalling in breaking L/R symmetry in the vertebrate forebrain. Nature communications, 6, 6686. [PubMed:25819227] [WorldCat] [DOI] - ↑ ポルトマン A
ポルトマン脊椎動物比較形態学(島崎三郎訳)
岩波書店(東京):1979 - ↑ 佐藤&大隅
脳の領域化と転写因子
脳神経科学入門講座 下、2002 - ↑
Matsunaga, E., Araki, I., & Nakamura, H. (2000).
Pax6 defines the di-mesencephalic boundary by repressing En1 and Pax2. Development (Cambridge, England), 127(11), 2357-65. [PubMed:10804178] [WorldCat] - ↑ 11.0 11.1 11.2
Puelles, L., & Rubenstein, J.L. (2015).
A new scenario of hypothalamic organization: rationale of new hypotheses introduced in the updated prosomeric model. Frontiers in neuroanatomy, 9, 27. [PubMed:25852489] [PMC] [WorldCat] [DOI] - ↑
Shimamura, K., Hartigan, D.J., Martinez, S., Puelles, L., & Rubenstein, J.L. (1995).
Longitudinal organization of the anterior neural plate and neural tube. Development (Cambridge, England), 121(12), 3923-33. [PubMed:8575293] [WorldCat] - ↑ 13.0 13.1
Figdor, M.C., & Stern, C.D. (1993).
Segmental organization of embryonic diencephalon. Nature, 363(6430), 630-4. [PubMed:8510755] [WorldCat] [DOI] - ↑ 14.0 14.1
Bulfone, A., Puelles, L., Porteus, M.H., Frohman, M.A., Martin, G.R., & Rubenstein, J.L. (1993).
Spatially restricted expression of Dlx-1, Dlx-2 (Tes-1), Gbx-2, and Wnt-3 in the embryonic day 12.5 mouse forebrain defines potential transverse and longitudinal segmental boundaries. The Journal of neuroscience : the official journal of the Society for Neuroscience, 13(7), 3155-72. [PubMed:7687285] [WorldCat] - ↑ 15.0 15.1 15.2
Ferran, J.L., Sánchez-Arrones, L., Sandoval, J.E., & Puelles, L. (2007).
A model of early molecular regionalization in the chicken embryonic pretectum. The Journal of comparative neurology, 505(4), 379-403. [PubMed:17912743] [WorldCat] [DOI] - ↑
Vieira, C., Garda, A.L., Shimamura, K., & Martinez, S. (2005).
Thalamic development induced by Shh in the chick embryo. Developmental biology, 284(2), 351-63. [PubMed:16026780] [WorldCat] [DOI] - ↑
Kiecker, C., & Lumsden, A. (2004).
Hedgehog signaling from the ZLI regulates diencephalic regional identity. Nature neuroscience, 7(11), 1242-9. [PubMed:15494730] [WorldCat] [DOI] - ↑
Kataoka, A., & Shimogori, T. (2008).
Fgf8 controls regional identity in the developing thalamus. Development (Cambridge, England), 135(17), 2873-81. [PubMed:18653561] [WorldCat] [DOI] - ↑
Martinez-Ferre, A., & Martinez, S. (2009).
The development of the thalamic motor learning area is regulated by Fgf8 expression. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(42), 13389-400. [PubMed:19846726] [PMC] [WorldCat] [DOI] - ↑
Braun, M.M., Etheridge, A., Bernard, A., Robertson, C.P., & Roelink, H. (2003).
Wnt signaling is required at distinct stages of development for the induction of the posterior forebrain. Development (Cambridge, England), 130(23), 5579-87. [PubMed:14522868] [WorldCat] [DOI] - ↑
Vue, T.Y., Bluske, K., Alishahi, A., Yang, L.L., Koyano-Nakagawa, N., Novitch, B., & Nakagawa, Y. (2009).
Sonic hedgehog signaling controls thalamic progenitor identity and nuclei specification in mice. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(14), 4484-97. [PubMed:19357274] [PMC] [WorldCat] [DOI] - ↑
Wilson, S.W., Ross, L.S., Parrett, T., & Easter, S.S. (1990).
The development of a simple scaffold of axon tracts in the brain of the embryonic zebrafish, Brachydanio rerio. Development (Cambridge, England), 108(1), 121-45. [PubMed:2351059] [WorldCat] - ↑
Barreiro-Iglesias, A., Villar-Cheda, B., Abalo, X.M., Anadón, R., & Rodicio, M.C. (2008).
The early scaffold of axon tracts in the brain of a primitive vertebrate, the sea lamprey. Brain research bulletin, 75(1), 42-52. [PubMed:18158094] [WorldCat] [DOI] - ↑
Oelschläger, H.H., Haas-Rioth, M., Fung, C., Ridgway, S.H., & Knauth, M. (2008).
Morphology and evolutionary biology of the dolphin (Delphinus sp.) brain--MR imaging and conventional histology. Brain, behavior and evolution, 71(1), 68-86. [PubMed:17975302] [WorldCat] [DOI] - ↑
Mastick, G.S., Davis, N.M., Andrew, G.L., & Easter, S.S. (1997).
Pax-6 functions in boundary formation and axon guidance in the embryonic mouse forebrain. Development (Cambridge, England), 124(10), 1985-97. [PubMed:9169845] [WorldCat] - ↑
Nural, H.F., & Mastick, G.S. (2004).
Pax6 guides a relay of pioneer longitudinal axons in the embryonic mouse forebrain. The Journal of comparative neurology, 479(4), 399-409. [PubMed:15514979] [PMC] [WorldCat] [DOI] - ↑
Marín, O., Baker, J., Puelles, L., & Rubenstein, J.L. (2002).
Patterning of the basal telencephalon and hypothalamus is essential for guidance of cortical projections. Development (Cambridge, England), 129(3), 761-73. [PubMed:11830575] [WorldCat] - ↑
Vanderhaeghen, P., & Polleux, F. (2004).
Developmental mechanisms patterning thalamocortical projections: intrinsic, extrinsic and in between. Trends in neurosciences, 27(7), 384-91. [PubMed:15219737] [WorldCat] [DOI] - ↑
Powell, A.W., Sassa, T., Wu, Y., Tessier-Lavigne, M., & Polleux, F. (2008).
Topography of thalamic projections requires attractive and repulsive functions of Netrin-1 in the ventral telencephalon. PLoS biology, 6(5), e116. [PubMed:18479186] [PMC] [WorldCat] [DOI] - ↑
Bielle, F., Marcos-Mondejar, P., Keita, M., Mailhes, C., Verney, C., Nguyen Ba-Charvet, K., ..., & Garel, S. (2011).
Slit2 activity in the migration of guidepost neurons shapes thalamic projections during development and evolution. Neuron, 69(6), 1085-98. [PubMed:21435555] [WorldCat] [DOI] - ↑
Erzurumlu, R.S., Murakami, Y., & Rijli, F.M. (2010).
Mapping the face in the somatosensory brainstem. Nature reviews. Neuroscience, 11(4), 252-63. [PubMed:20179712] [PMC] [WorldCat] [DOI] - ↑
Cheng, H.J., Nakamoto, M., Bergemann, A.D., & Flanagan, J.G. (1995).
Complementary gradients in expression and binding of ELF-1 and Mek4 in development of the topographic retinotectal projection map. Cell, 82(3), 371-81. [PubMed:7634327] [WorldCat] [DOI] - ↑
Drescher, U., Kremoser, C., Handwerker, C., Löschinger, J., Noda, M., & Bonhoeffer, F. (1995).
In vitro guidance of retinal ganglion cell axons by RAGS, a 25 kDa tectal protein related to ligands for Eph receptor tyrosine kinases. Cell, 82(3), 359-70. [PubMed:7634326] [WorldCat] [DOI] - ↑
Hindges, R., McLaughlin, T., Genoud, N., Henkemeyer, M., & O'Leary, D. (2002).
EphB forward signaling controls directional branch extension and arborization required for dorsal-ventral retinotopic mapping. Neuron, 35(3), 475-87. [PubMed:12165470] [WorldCat] [DOI] - ↑ Rendahl H
Embryologische und morphologische Studien über das Zwischenhirn beim Huhn
Acta Zool 5:241–344.:1924 PDF - ↑ 36.0 36.1
Lauter, G., Söll, I., & Hauptmann, G. (2013).
Molecular characterization of prosomeric and intraprosomeric subdivisions of the embryonic zebrafish diencephalon. The Journal of comparative neurology, 521(5), 1093-118. [PubMed:22949352] [WorldCat] [DOI] - ↑
Wullimann, M.F., & Puelles, L. (1999).
Postembryonic neural proliferation in the zebrafish forebrain and its relationship to prosomeric domains. Anatomy and embryology, 199(4), 329-48. [PubMed:10195307] [WorldCat] [DOI] - ↑
Wullimann, M.F., Puelles, L., & Wicht, H. (1999).
Early postembryonic neural development in the zebrafish: a 3-D reconstruction of forebrain proliferation zones shows their relation to prosomeres. European journal of morphology, 37(2-3), 117-21. [PubMed:10342441] [WorldCat] - ↑
Bachy, I., Vernier, P., & Retaux, S. (2001).
The LIM-homeodomain gene family in the developing Xenopus brain: conservation and divergences with the mouse related to the evolution of the forebrain. The Journal of neuroscience : the official journal of the Society for Neuroscience, 21(19), 7620-9. [PubMed:11567052] [PMC] [WorldCat] - ↑
Lazzaro, D., Price, M., de Felice, M., & Di Lauro, R. (1991).
The transcription factor TTF-1 is expressed at the onset of thyroid and lung morphogenesis and in restricted regions of the foetal brain. Development (Cambridge, England), 113(4), 1093-104. [PubMed:1811929] [WorldCat] - ↑
Kimura, S., Hara, Y., Pineau, T., Fernandez-Salguero, P., Fox, C.H., Ward, J.M., & Gonzalez, F.J. (1996).
The T/ebp null mouse: thyroid-specific enhancer-binding protein is essential for the organogenesis of the thyroid, lung, ventral forebrain, and pituitary. Genes & development, 10(1), 60-9. [PubMed:8557195] [WorldCat] [DOI] - ↑
Sussel, L., Marin, O., Kimura, S., & Rubenstein, J.L. (1999).
Loss of Nkx2.1 homeobox gene function results in a ventral to dorsal molecular respecification within the basal telencephalon: evidence for a transformation of the pallidum into the striatum. Development (Cambridge, England), 126(15), 3359-70. [PubMed:10393115] [WorldCat] - ↑
Affaticati, P., Yamamoto, K., Rizzi, B., Bureau, C., Peyriéras, N., Pasqualini, C., ..., & Vernier, P. (2015).
Identification of the optic recess region as a morphogenetic entity in the zebrafish forebrain. Scientific reports, 5, 8738. [PubMed:25736911] [PMC] [WorldCat] [DOI] - ↑
Ishikawa, Y., Yamamoto, N., Yoshimoto, M., Yasuda, T., Maruyama, K., Kage, T., ..., & Ito, H. (2007).
Developmental origin of diencephalic sensory relay nuclei in teleosts. Brain, behavior and evolution, 69(2), 87-95. [PubMed:17230016] [WorldCat] [DOI] - ↑
Mueller, T. (2012).
What is the Thalamus in Zebrafish? Frontiers in neuroscience, 6, 64. [PubMed:22586363] [PMC] [WorldCat] [DOI] - ↑
Yamamoto, N., & Ito, H. (2005).
Fiber connections of the anterior preglomerular nucleus in cyprinids with notes on telencephalic connections of the preglomerular complex. The Journal of comparative neurology, 491(3), 212-33. [PubMed:16134137] [WorldCat] [DOI] - ↑ 47.0 47.1
Kato, T., Yamada, Y., & Yamamoto, N. (2012).
Ascending gustatory pathways to the telencephalon in goldfish. The Journal of comparative neurology, 520(11), 2475-99. [PubMed:22247053] [WorldCat] [DOI] - ↑
Pani, A.M., Mullarkey, E.E., Aronowicz, J., Assimacopoulos, S., Grove, E.A., & Lowe, C.J. (2012).
Ancient deuterostome origins of vertebrate brain signalling centres. Nature, 483(7389), 289-94. [PubMed:22422262] [PMC] [WorldCat] [DOI] - ↑
Yao, Y., Minor, P.J., Zhao, Y.T., Jeong, Y., Pani, A.M., King, A.N., ..., & Epstein, D.J. (2016).
Cis-regulatory architecture of a brain signaling center predates the origin of chordates. Nature genetics, 48(5), 575-80. [PubMed:27064252] [PMC] [WorldCat] [DOI] - ↑
Pombal, M.A., Megías, M., Bardet, S.M., & Puelles, L. (2009).
New and old thoughts on the segmental organization of the forebrain in lampreys. Brain, behavior and evolution, 74(1), 7-19. [PubMed:19729892] [WorldCat] [DOI] - ↑
Sugahara, F., Pascual-Anaya, J., Oisi, Y., Kuraku, S., Aota, S., Adachi, N., ..., & Kuratani, S. (2016).
Evidence from cyclostomes for complex regionalization of the ancestral vertebrate brain. Nature, 531(7592), 97-100. [PubMed:26878236] [WorldCat] [DOI] - ↑ Ridgway SH
The central nervous system of the bottlenose dolphin. In: Leatherwood, S., Reeves, R.R. (Eds.), The Bottlenose Dolphin. pp. 69–97.
Academic Press, San Diego, CA:1990