「カテニン」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (3人の利用者による、間の31版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">林 華子、[http://researchmap.jp/read0118149/?lang=japanese 米村 重信]</font><br> | <font size="+1">林 華子、[http://researchmap.jp/read0118149/?lang=japanese 米村 重信]</font><br> | ||
''理化学研究所 発生・再生科学総合研究センター 電子顕微鏡解析室''<br> | ''理化学研究所 発生・再生科学総合研究センター 電子顕微鏡解析室''<br> | ||
DOI [[XXXX]]/XXXX 原稿受付日:2012年11月28日 原稿完成日:2014年xx月XX日<br> | |||
担当編集委員:[http://researchmap.jp/ | 担当編集委員:[http://researchmap.jp/Bito/?lang=japanese 尾藤晴彦](東京大学大学院医学系研究科 神経生化学分野)<br> | ||
</div> | </div> | ||
英語名:catenin 独:Catenin | |||
{{box|text= カテニンは、細胞間接着の必須因子である[[接着分子]][[カドヘリン]]の中の古典的カドヘリンと複合体(カドヘリン・カテニン複合体)を形成するタンパク質の総称である。カドヘリン・カテニン複合体中のカテニンのうち、α | {{box|text= | ||
カテニンは、細胞間接着の必須因子である[[接着分子]][[カドヘリン]]の中の古典的カドヘリンと複合体(カドヘリン・カテニン複合体)を形成するタンパク質の総称である。カドヘリン・カテニン複合体中のカテニンのうち、α–カテニンは[[細胞骨格]]との連結、β–カテニンはカドヘリンとα–カテニンとの結合を担っており、どちらもカドヘリンによる細胞接着に必須である。p120–カテニンは[[エンドサイトーシス]]を介してカドヘリンの発現量の調節を行っている。細胞接着とは別の働きとして、β–カテニンは[[Wnt]]/β–カテニンシグナルにおいて重要な役割を果たし、遺伝子発現調節を行う。α–カテニンも増殖のシグナルを調節する因子として研究が進んでいる。カテニンは脳の形態形成、神経細胞の伸長、[[シナプス]]形成などにも重要な働きをしている。 | |||
}} | |||
[[ファイル:fig1hh.jpg|right|thumb|350px|'''図1.アドヘレンス・ジャンクションにおけるカドヘリン・カテニン複合体の模式図''']] | |||
[[ファイル:fig2hh.jpg|right|thumb|350px|'''図2.カテニン分子群の主な機能''']] | |||
[[ファイル:Fig3_catenin_structure_HH02.jpg|right|thumb|350px|'''図3.カテニン分子群のタンパク質一次構造''']] | |||
==カテニンとは== | ==カテニンとは== | ||
カテニンは、古典的カドヘリンの中の[[E-カドヘリン]]との複合体の構成因子の総称である(図1)。 | カテニンは、古典的カドヘリンの中の[[E-カドヘリン]]との複合体の構成因子の総称である(図1)。 | ||
接着間接着の必須分子であるE–カドヘリンの抗体を用いた[[wikipedia:ja:免疫沈降反応|免疫沈降反応]]でE–カドヘリンとともに共沈してくる複数のタンパク質がとれ、それらはE–カドヘリンの細胞質ドメインに 結合して複合体を形成していることが小沢らによって初めて示された<ref name=ref1><pubmed> 2788574 </pubmed></ref>。カドヘリンは[[アクチン]]フィラメントを結合している細胞間接着装置、アドへレンス・ジャンクションの形成に必須な接着分子であり、カテニンはカドヘリンと細胞骨格アクチンフィラメントとの連結を担うものと予想され、ラテン語のcatena(chain)からカテニン(catenin)と命名された。 | |||
このような背景からカテニンの機能解析は、主に細胞間接着に着目して進められてきた。カテニンはカドヘリンを介した十分な接着活性に必須であることが明らかにされ、細胞間接着における接着分子カドヘリンの制御因子としての重要性が提示されている<ref name=ref2><pubmed> 20164302 </pubmed></ref>。 | |||
カテニンの発現は、多くの組織で認められるものと組織特異的なものとがあり(表)、細胞レベルでは通常、カドヘリンと同様の分布を示す(以下の「発現」の項目を参照)。カテニンはカドヘリンの細胞質領域と結合してカドヘリン・カテニン複合体を作るが、カテニンが結合しうるカドヘリンはE–, N–, VE–カドヘリン等のクラッシックカドヘリンのみである<ref name=ref3><pubmed> 19401831 </pubmed></ref>。 | |||
β–カテニンとp120-カテニンとに相当する分子は、上述した小沢らによるカテニン分子群の発見とは独立してほぼ同時に異なる研究者による異なる研究の中からも発見された経緯がある。[[ショウジョウバエ]]の[[アルマジロ]]遺伝子は胚の[[体節]]形成に異常を示す変異体のスクリーニングから発見され、[[Wntシグナル]]伝達系の[[転写制御因子]]として核内においても機能することが知られていた。のちに[[哺乳類]]のカドヘリン・カテニン複合体中のβ–カテニンがアルマジロ遺伝子のオーソログであることが判明し、脊椎動物のβ–カテニンにも発生における遺伝子発現において重要な役割があることがわかった<ref name=ref4><pubmed> 22617422 </pubmed></ref>。 | |||
p120-カテニンは、[[src]]による形質転換特異的にみられるチロシン残基のリン酸化をうける分子としてReynoldsらによって同定されており、アクチン細胞骨格動態への影響が見られていたこともあり、細胞/細胞外基質間接着との関連性についての解析も展開されていった<ref name=ref5><pubmed> 17175391 </pubmed></ref>。そのような流れの中で、細胞接着だけでなく、発生・再生における遺伝子発現制御因子としての重要性が示されている(図2)。タンパク質の一次構造レベルでは、β–カテニンとp120-カテニンはアルマジロ反復配列を有するタンパク質として類似性を示し、その配列はさまざまな因子の結合領域として働く(図3)<ref name=ref2><pubmed> 20164302 </pubmed></ref>。このようにカテニン分子は細胞間接着という共通の機能を担う一方で、分子としての性質は多様であり、その性質が各々のカテニン分子の多機能性を生み出していると考えられている。 | |||
==種類== | ==種類== | ||
カテニンの主要な種類には、α | カテニンの主要な種類には、α–カテニン、β–カテニン、γ–カテニン/プラコグロビン、δ–カテニンがある。それぞれにサブタイプが存在する。 | ||
{| class="wikitable" style="text-align:center" | {| class="wikitable" style="text-align:center" | ||
|+ | |+ カテニンの主要な種類 | ||
|- style="background-color:#ddf" | |- style="background-color:#ddf" | ||
| rowspan="2" | タイプ | | rowspan="2" | タイプ | ||
| 42行目: | 48行目: | ||
| [http://www.genenames.org/ HUGO] | | [http://www.genenames.org/ HUGO] | ||
|- | |- | ||
| rowspan="3" | '''α | | rowspan="3" | '''α–カテニン''' | ||
| α | | αE–カテニン | ||
| ''CTNNA1'' | | ''CTNNA1'' | ||
| [http://www.ncbi.nlm.nih.gov/nuccore/NM_001903.2 NM_001903] | | [http://www.ncbi.nlm.nih.gov/nuccore/NM_001903.2 NM_001903] | ||
| [http://www.uniprot.org/uniprot/P35221 P35221] | | [http://www.uniprot.org/uniprot/P35221 P35221] | ||
| [http://www.genenames.org/data/hgnc_data.php?hgnc_id=2509 ID2509] | | [http://www.genenames.org/data/hgnc_data.php?hgnc_id=2509 ID2509] | ||
| [http://www.ebi.ac.uk/pdbe/searchResults.html?display=both&term=CTNNA1 CTNNA1] | | [http://www.ebi.ac.uk/pdbe/searchResults.html?display=both&term=CTNNA1 CTNNA1]||全身の多くの組織。扁桃腺での発現は検出されていない。 | ||
| | |||
|- | |- | ||
| α | | αN–カテニン | ||
| ''CTNNA2'' | | ''CTNNA2'' | ||
| [http://www.ncbi.nlm.nih.gov/nuccore/NM_004389 NM_004389] | | [http://www.ncbi.nlm.nih.gov/nuccore/NM_004389 NM_004389] | ||
| [http://www.uniprot.org/uniprot/P26232 P26232] | | [http://www.uniprot.org/uniprot/P26232 P26232] | ||
| [http://www.genenames.org/data/hgnc_data.php?hgnc_id=2510 ID2510] | | [http://www.genenames.org/data/hgnc_data.php?hgnc_id=2510 ID2510] | ||
| [http://www.ebi.ac.uk/pdbe/searchResults.html?display=both&term=%E2%80%98%E2%80%98CTNNA2%E2%80%99%E2%80%99 CTNNA2] | | [http://www.ebi.ac.uk/pdbe/searchResults.html?display=both&term=%E2%80%98%E2%80%98CTNNA2%E2%80%99%E2%80%99 CTNNA2] ||中枢神経系特異的な発現。 | ||
| | |||
|- | |- | ||
| α | | αT–カテニン | ||
| ''CTNNA3'' | | ''CTNNA3'' | ||
| [http://www.ncbi.nlm.nih.gov/nuccore/NM_013266 NM_013266] | | [http://www.ncbi.nlm.nih.gov/nuccore/NM_013266 NM_013266] | ||
| [http://www.uniprot.org/uniprot/Q9UI47 Q9UI47] | | [http://www.uniprot.org/uniprot/Q9UI47 Q9UI47] | ||
| [http://www.genenames.org/data/hgnc_data.php?hgnc_id=2511 ID2511] | | [http://www.genenames.org/data/hgnc_data.php?hgnc_id=2511 ID2511] | ||
| データなし | | データなし||心臓、結合組織や脳において特に発現が高い。 | ||
| | |||
|- | |- | ||
| '''β | | '''β–カテニン''' | ||
| β | | β–カテニン | ||
| ''CTNNB1'' | | ''CTNNB1'' | ||
| [http://www.ncbi.nlm.nih.gov/protein/NP_001091679 NP_001091679] | | [http://www.ncbi.nlm.nih.gov/protein/NP_001091679 NP_001091679] | ||
| [http://www.uniprot.org/uniprot/P35222 P35222] | | [http://www.uniprot.org/uniprot/P35222 P35222] | ||
| [http://www.genenames.org/data/hgnc_data.php?hgnc_id=2514 ID2514] | | [http://www.genenames.org/data/hgnc_data.php?hgnc_id=2514 ID2514] | ||
| [http://www.ebi.ac.uk/pdbe/searchResults.html?display=both&term=P35222%20or%20Q0VCX4%20or%20Q02248%20or%20Q9WU82%20or%20O42486%20or%20Q7ZU14%20or%20P18824%20or%20O44326 CTNNB1] | | [http://www.ebi.ac.uk/pdbe/searchResults.html?display=both&term=P35222%20or%20Q0VCX4%20or%20Q02248%20or%20Q9WU82%20or%20O42486%20or%20Q7ZU14%20or%20P18824%20or%20O44326 CTNNB1]||全身の多くの組織にて発現あり。脂肪組織や副甲状腺、扁桃腺などでは発現は認められていない。 | ||
| | |||
|- | |- | ||
| '''γ | | '''γ–カテニン''' | ||
| γ | | γ–カテニン<br>([[プラコグロビン]]) | ||
| ''JUP'' | | ''JUP'' | ||
| [http://www.ncbi.nlm.nih.gov/nuccore/XM_005257316 XM_005257316] | | [http://www.ncbi.nlm.nih.gov/nuccore/XM_005257316 XM_005257316] | ||
| [http://www.uniprot.org/uniprot/P14923 P14923] | | [http://www.uniprot.org/uniprot/P14923 P14923] | ||
| [http://www.genenames.org/data/hgnc_data.php?hgnc_id=6207 ID6207] | | [http://www.genenames.org/data/hgnc_data.php?hgnc_id=6207 ID6207] | ||
| [http://www.ebi.ac.uk/pdbe/searchResults.html?display=both&term=jup JUP] | | [http://www.ebi.ac.uk/pdbe/searchResults.html?display=both&term=jup JUP]||全身の多くの組織にて発現あり。脂肪組織や副甲状腺、扁桃腺などでは発現は認められていない。 | ||
| | |||
|- | |- | ||
| rowspan="2" | ''' | | rowspan="2" | '''p120–カテニン''' | ||
| | | p120–カテニン | ||
| ''CTNND1'' | | ''CTNND1'' | ||
| [http://www.ncbi.nlm.nih.gov/nuccore/NM_001331 NM_001331] | | [http://www.ncbi.nlm.nih.gov/nuccore/NM_001331 NM_001331] | ||
| [http://www.uniprot.org/uniprot/O60716 O60716] | | [http://www.uniprot.org/uniprot/O60716 O60716] | ||
| [http://www.genenames.org/data/hgnc_data.php?hgnc_id=2515 ID2515] | | [http://www.genenames.org/data/hgnc_data.php?hgnc_id=2515 ID2515] | ||
| [http://www.ebi.ac.uk/pdbe/searchResults.html?display=both&term=CTNND1 CTNND1] | | [http://www.ebi.ac.uk/pdbe/searchResults.html?display=both&term=CTNND1 CTNND1]||全身の多くの組織で発現。ただし、脾臓やへその緒などでは発現が認められていない。 | ||
| | |||
|- | |- | ||
| δ | | δ–カテニン | ||
| ''CTNND2'' | | ''CTNND2'' | ||
| [http://www.ncbi.nlm.nih.gov/nuccore/NM_001332 NM_001332] | | [http://www.ncbi.nlm.nih.gov/nuccore/NM_001332 NM_001332] | ||
| [http://www.uniprot.org/uniprot/Q9UQB3 Q9UQB3] | | [http://www.uniprot.org/uniprot/Q9UQB3 Q9UQB3] | ||
| [http://www.genenames.org/data/hgnc_data.php?hgnc_id=2516 ID2516] | | [http://www.genenames.org/data/hgnc_data.php?hgnc_id=2516 ID2516] | ||
| データなし | | データなし||脳組織に特異的な発現。 | ||
| | |||
|} | |} | ||
==α | それぞれのカテニン分子のタンパク質発現については、[[UniGene]]の中のEST(expressed sequence tag)を用いて調べたmRNA相対発現量のプロファイルにおいてゼロと報告されているもののみについて発現がみとめられないと記載したことに留意していただきたい。 | ||
脊椎動物においては、 | |||
==α–カテニン== | |||
脊椎動物においては、αE–カテニン、αN–カテニン、αT–カテニンがこのグループに属する。 | |||
===構造=== | ===構造=== | ||
α | α–カテニンは、β-カテニンやγ-カテニンに共通してみられるアルマジロ反復配列をもたないといったタンパク質一次構造レベルにおける他のカテニンとの類似性は持ち合わせていない<ref name=ref6><pubmed> 22084304 </pubmed></ref>。アクチン結合タンパク質である[[ビンキュリン]]と塩基配列において相同性(約30%程度)を示す3つの領域(VH1, VH2, VH3)を含んでいる<ref name=ref7><pubmed> 1904011 </pubmed></ref>。最もN末に位置するVH1では、β-カテニンと結合し、VH3はアクチン線維との結合に必要である。また、VH2には、ビンキュリンや[[アファディン]]といった他のアクチン結合タンパク質との結合、加えてビンキュリンの結合阻害領域も存在し、VH2の構造変化がVH2におけるタンパク質結合の制御に重要であると示唆されている。α–カテニンの立体構造については、VH1やVH2といった断片についてはα–カテニン単体やビンキュリンとの結合状態などの条件において精度よい[[X線結晶構造解析]]が行われている<ref name=ref8><pubmed> 23589308 </pubmed></ref>。全長については[[αE–カテニン]]や[[αN–カテニン]]どちらにおいても十分に高い分解能での結晶構造が得られていないものの、近年においても精力的に解析が続けられている<ref name=ref8><pubmed> 23589308 </pubmed></ref>。全長の構造が理解できれば、α–カテニン分子全体としての構造変化の制御についての理解がより進むと期待される。 | ||
===発現=== | ===発現=== | ||
αE–カテニンは、[[wikipedia:ja:扁桃腺|扁桃腺]]での発現は認められていないが、体全身にわたる多くの組織に発現している。αN–カテニンは[[中枢神経系]]には特異的に発現している。発生中の中枢神経系では、[[神経前駆細胞]]にはαE–カテニンが発現しているが、それが神経細胞に[[分化]]するとαE–カテニンの発現は見られなくなり、αN–カテニンが発現するようになる<ref name=ref9><pubmed> 1638632 </pubmed></ref>。 UniGeneのデータを参考にすると、αT–カテニンは[[wikipedia:ja:心臓|心臓]]だけでなく[[wikipedia:ja:結合組織|結合組織]]や脳において高い発現が示されている。細胞レベルではα–カテニンは、細胞質タンパク質として存在するが、主には膜タンパク質であるカドヘリンと細胞質タンパク質β–カテニンとともに複合体を形成することにより、隣接する細胞に接触している[[細胞膜]]への局在が顕著である。 | |||
α | |||
===機能=== | ===機能=== | ||
上述したように、α–カテニンはカドヘリン接着活性に必須な機能をもつ。α–カテニンがβ–カテニンとアクチン線維とに結合するので、アドへレンス・ジャンクションにおいてカドヘリン・カテニン複合体とアクチン線維との結合を担うと考えられている<ref name=ref9><pubmed> 1638632 </pubmed></ref><ref name=ref10><pubmed> 9700171 </pubmed></ref>。α–カテニンが発現していなければ、カドヘリンが発現していても、[[接着分子]]としてのカドヘリンは実質的に機能せず、アドへレンス・ジャンクションも形成されない。 | |||
α | α–カテニンはβ–カテニンとはN末端で結合し、C末端ではアクチン線維と結合する。このC末端のアクチン線維結合領域の重要性は、ショウジョウバエの形態形成<ref name=ref11><pubmed> 23417122 </pubmed></ref>や[[マウス]]の発生<ref name=ref11><pubmed> 9023354 </pubmed></ref>において示されている。α–カテニンはビンキュリン、[[エプリン]]、[[ZO-1]]、[[αアクチニン]]などのアクチン結合タンパク質とも結合するので、それらの結合を介して間接的にアクチン線維を連結している可能性もある<ref name=ref6><pubmed> 22084304 </pubmed></ref>。 | ||
さらに、α–カテニンは、アドヘレンス・ジャンクションにおいて細胞間の張力を感知・伝達する分子であることが示され、動的なアドへレンス・ジャンクション形成に重要であると考えられる<ref name=ref12><pubmed> 20453849 </pubmed></ref>。 | |||
また、αE–カテニンは、細胞間接着の機能とは別に、[[細胞増殖]]を負に制御することが知られている。細胞増殖の接触阻止に対する調節に重要な[[Hippoシグナル伝達]]においては、転写制御を通じて増殖を抑制する<ref name=ref13><pubmed> 22075429 </pubmed></ref>。後述するように中枢神経系では、αN–カテニンが神経回路形成を担うシナプス形成や安定性に必要である。[[大脳皮質]]における細胞増殖、[[神経突起]]の伸長の制御を行っているという報告もある<ref name=ref14><pubmed> 22535893 </pubmed></ref>。 | |||
==β | ==β–カテニン、γ–カテニン== | ||
β | β–カテニンとγ–カテニン(プラコグロビンとも呼ばれる)がこのグループに属する。ヒトにおいて両者は高い相同性(76%以上の相同性)をもつ。また、ショウジョウバエのアルマジロとも高い相同性をもつ。 | ||
===構造=== | ===構造=== | ||
β | β–カテニンの一次構造についてはショウジョウバエのアルマジロで見つかった42アミノ酸残基の繰り返し配列(アルマジロ反復配列)が分子のN末端とC末端を除いた大部分を占める。β–カテニンタンパク質の全長の立体構造は、近年、解かれた<ref name=ref15><pubmed> 18334222 </pubmed></ref>。この反復配列のほぼその全体にカドヘリンの細胞質領域の細胞膜より遠い部分が結合する。 | ||
E–カドヘリンは、細胞質領域の細胞膜より遠い部分を介して、β–カテニンのアルマジロ配列のほぼ全体に結合する<ref name=ref16><pubmed> 15112230 </pubmed></ref>。α–カテニンとは、そのアルマジロ反復配列のもっともN末よりの部分で結合する<ref name=ref16><pubmed> 15112230 </pubmed></ref>。他にも、アルマジロ反復配列領域では、[[転写因子]]である[[TCF]]/[[LEF]]に結合することで、[[WNT|Wnt]]シグナル伝達における転写制御に、また、[[APC]]、[[Axin]]もその反復配列へ結合することで、β–カテニンの分解に関与している。また、アルマジロ反復配列よりもN末側の領域と[[GSK3β]]との結合も存在し、β–カテニンの分解促進に重要であると考えられている。 | |||
プラコグロビンはβ | プラコグロビンはβ–カテニンの機能を相補しうるが、特徴としてそのN末端部分を介して[[デスモソームカドヘリン]]の細胞質部分に結合する。プラコグロビンもβ–カテニンと同様にその中央部分にアルマジロ反復配列をもち、その領域は[[デスモプラーキン]]と呼ばれる[[中間径フィラメント]]結合タンパク質との結合サイトをもつ。このデスモプラーキンとの結合はデスモソームと中間径線維との連結役として機能していると考えられている<ref name=ref17><pubmed> 17854763 </pubmed></ref>。 | ||
===発現=== | ===発現=== | ||
β | β–カテニンは一般的に体全身の多くの組織において発現が認められているが、[[wikipedia:ja:脂肪組織|脂肪組織]]や[[wikipedia:ja:副甲状腺|副甲状腺]]、扁桃腺といって一部の組織では発現が確認されていない。細胞レベルにおいては、β–カテニンは、α–カテニンと同様、細胞質タンパク質であるため、細胞質に一様な局在も示すが、カドヘリンを介した膜への局在が主である。[[Wnt]]シグナルの活性化状態では、β–カテニンは[[wikipedia:ja:核|核]]への局在が見られるようになる。 | ||
プラコグロビン(γ–カテニン)も、β–カテニンと同様に多くの組織では発現が確認されているが、[[wikipedia:ja:副腎|副腎]]や、[[wikipedia:ja:耳|耳]]、[[wikipedia:ja:唾液腺|唾液腺]]、[[wikipedia:ja:脾臓|脾臓]]、[[wikipedia:ja:へその緒|へその緒]]、[[wikipedia:ja:血管|血管]]といった一部の組織には発現が確認されていない。細胞レベルでは、デスモソームへの局在が顕著である。 | |||
===機能=== | ===機能=== | ||
β | β–カテニンにはカドヘリン・カテニン複合体中のメンバーとしての細胞間接着への必須な役割と、Wnt/β–カテニンシグナルの転写制御因子としての役割とがある。 | ||
細胞間接着におけるβ–カテニンの役割は、カドヘリンとα–カテニンとの連結にある<ref name=ref4><pubmed> 22617422 </pubmed></ref>。α–カテニンの結合は生化学的に確認されており、E–カドヘリンとともにアドへレンス・ジャンクションに局在するという細胞レベルの知見からも支持されている<ref name=ref16><pubmed> 15112230 </pubmed></ref>。F9細胞ではβ–カテニンをノックアウトしてもプラコグロビン(γ–カテニンとも呼ばれる)の発現が増加し、カドヘリンによる接着能は維持されるが、プラコグロビンもあわせてノックアウトするとその接着能は失われることが示されている<ref name=ref18><pubmed> 16357441 </pubmed></ref>。しかし、カドヘリンが発現していない細胞に、カドヘリンとα–カテニンとを融合したタンパク質を発現させれば、β–カテニンが存在しなくてもカドヘリンの機能は発揮される<ref name=ref19><pubmed> 7929566 </pubmed></ref>。これらは、細胞間接着においてプラコグロビンがβ–カテニンの機能を補完する役割を担っており、またβ–カテニンの機能は、α–カテニンをカドヘリンに結合させることであることを示している。 | |||
細胞接着においてプラコグロビンはデスモソ-ムカドヘリンと細胞骨格の一つである中間径フィラメントの結合タンパク質である[[プラモプラーキン]] | 細胞接着においてプラコグロビンはデスモソ-ムカドヘリンと細胞骨格の一つである中間径フィラメントの結合タンパク質である[[プラモプラーキン]]の両方と同時に結合し、デスモソームの構造体として機能する。プラコグロビンのC末端領域の欠損した培養細胞では、細胞のラテラル面でのデスモソームの融合が見られ、結果としてデスモソームのサイズの増大が起こる。また、プラコグロビンは、アドへレンス・ジャンクションとデスモソーム間の分子のクロストークの制御に寄与していることが示唆されている。プラコグロビンの[[ノックアウトマウス]]の[[wikipedia:ja:心筋|心筋]]組織ではアドへレンス・ジャンクションの構成因子とデスモソームの構成因子とが混在してラテラル面に局在するようになってしまう<ref name=ref20><pubmed> 19262118 </pubmed></ref>。 | ||
β–カテニンは、発生における遺伝子発現の制御にも重要な役割がある。Wntシグナルがない状態では、細胞質のβ–カテニン(カドヘリン・カテニン複合体中のものとは別である)はGSK3βによりリン酸化され、それを標的とした[[ユビキチン化]]により、プロテアソームによるタンパク質分解をうけることで、その量が低く保たれている。WntシグナルがやってくればGSK3βによる[[リン酸化]]が抑制され、β–カテニンは核内へ移行し、TCF/LEFと複合体を形成し、[[細胞周期]]関連因子や体軸決定因子などの標的遺伝子を活性化する<ref name=ref4><pubmed> 22617422 </pubmed></ref>。これは、[[wikipedia:ja:ウニ|ウニ]]の発生を初めとし[[wikipedia:ja:無脊椎動物|無脊椎動物]]、[[wikipedia:ja:脊椎動物|脊椎動物]]両方において報告されている<ref name=ref4><pubmed> 22617422 </pubmed></ref>。 | |||
== | 神経系においても、[[シナプス形成]]と[[可塑性]]や[[神経幹細胞]]の未分化状態の維持など多岐にわたる寄与が報告されている<ref>'''Elkouby, Y. M., Frank, D. '''<br>Wnt/beta-Catenin Signaling in Vertebrate Posterior Neural Development<br>''Developmental Biology (San Rafael (CA))'':2010</ref><ref name=ref21><pubmed> 23377854 </pubmed></ref>。また、プロコグロビンも先に挙げたTCF/LEFと結合でき、核内への局在がみられる状況では、Wnt/β–カテニンシグナル伝達の抑制が同時にみられていることから、実際にはプロコグロビンはβ–カテニンと相互排他的にTCF/LEFへ結合しうり、その結果としてWnt/β–カテニンシグナル伝達の制御を実現していると解釈できる。 | ||
==p120–カテニン== | |||
p120–カテニンとδ–カテニンがこのグループに属する(p120–カテニンファミリーにはその他複数のタンパク質があるが、ここでは比較的研究歴史の長い2つのカテニンについてのみ紹介する。それ以外のタンパク質については総説<ref name=ref5><pubmed> 17175391 </pubmed></ref><ref name=ref22><pubmed> 15489912 </pubmed></ref>を参照していただきたい。)。 | |||
===構造=== | ===構造=== | ||
p120–カテニンファミリータンパク質の中央領域に見られる10個のアルマジロ反復配列は、カドヘリンの細胞膜に近接した細胞質領域と結合する<ref name=ref22><pubmed> 15489912 </pubmed></ref>。p120–カテニンのアルマジロ反復配列に隣接するN末端側の領域は、[[スレオニン]]残基のリン酸化サイトが複数存在している。そのさらに隣に位置するN末端には[[コイルドコイル配列]]が存在している。加えて、δ–カテニンは、そのC末端に[[PDZタンパク質]]との結合領域を有す。その一例として、[[グルタミン酸受容体]]結合タンパク質[[GRIP]]やシナプス後膜直下に形成される[[シナプス後部肥厚]]([[Postsynaptic density]]: [[PSD]])に局在化する[[PSD-95]]などがそこに結合する<ref name=ref14><pubmed> 22535893 </pubmed></ref>。 | |||
===発現=== | ===発現=== | ||
p120–カテニンは、多くの組織において強い発現が認められるが、他のカテニンと同様に扁桃腺やへその緒での発現は検出されていない。δ–カテニンは、神経系での強い発現が特徴である。[[wikipedia:ja:上皮細胞|上皮細胞]]では、p120–カテニンはアドへレンス・ジャンクションを含む、隣接する細胞に接触している細胞膜に濃縮する。δ–カテニンは、成熟した[[樹状突起]]のシナプスに強く観察されるが、脳組織の中でもその発現度合いは異なる。[[大脳皮質]]や、[[海馬]]、[[嗅球]]では強く発現するが、[[小脳]]や[[視床]]の発現はやや落ちる傾向がみられている([[Allen Brain Atlas]])。 | |||
===機能=== | ===機能=== | ||
==== | ====p120–カテニン==== | ||
p120–カテニンは、カドヘリンとの結合を介してカドヘリンのエンドサイトーシスを 抑制し、細胞膜上のカドヘリン量を維持する。p120–カテニンの[[チロシンリン酸化]]はp120–カテニンのカドヘリンとの結合解除に寄与する。このカドヘリンのp120–カテニン結合領域内には、そのエンドサイトーシスシグナルが存在し、カドヘリンにp120–カテニンが結合することによって、そのシグナルがマスクされ、その結果としてカドヘリンは細胞内に取り込まれないようになっているという機構が近年示されている<ref name=ref23><pubmed> 20371349 </pubmed></ref> <ref name=ref24><pubmed> 23071156 </pubmed></ref>。カドヘリンの接着活性がない[[wikipedia:ja:大腸癌|大腸癌]]由来の[[細胞株]]を用いた解析からは、p120–カテニンはカドヘリンと結合することで接着活性を抑制する結合因子であることが示された<ref name=ref25><pubmed> 10225956 </pubmed></ref>。カドヘリンの発現量の低下は[[wikipedia:ja:悪性腫瘍|悪性腫瘍]]組織でみられる特徴の一つあるが<ref name=ref25><pubmed> 10647931 </pubmed></ref>、そのような腫瘍組織のいくつかの種類では、p120–カテニンが細胞膜に局在できないことによってカドヘリンのエンドサイトーシスが亢進されると解釈される<ref name=ref26><pubmed> 12492499 </pubmed></ref>。 | |||
また、p120–カテニンは細胞膜直下のアクチン線維動態も制御している。p120–カテニンはアクチン細胞骨格動態の主要な制御因子である[[低分子量Gタンパク質]][[RhoA]]と結合し、RhoAの活性化を抑制し、一方で[[糸状仮足]]や[[葉状仮足]]の発達につながる膜直下のアクチン細胞骨格の再編成に必要な他の低分子量Gタンパク質[[Rac]]や[[Cdc42]]を活性化することで、細胞接着形成の初期段階においてアクチン細胞骨格の再編成を促進すると考えられている<ref name=ref27><pubmed>17194753</pubmed></ref>。細胞質におけるRhoAとの結合はp120–カテニンのリン酸化に依存している<ref name=ref27><pubmed>17194753</pubmed></ref>が、先に述べたように、p120–カテニンのリン酸化の増加がカドヘリンの接着活性の低下に働くことを考えあわせると、p120–カテニンのリン酸化の制御は細胞接着と細胞運動の適切な均衡をとるという機構の一つになると考えられる。[[ラット]]海馬由来の培養神経細胞においても、上述したp120–カテニンのRhoA、Rac、そしてCdc42の活性制御を介してアクチン細胞骨格動態を活性化させ、神経樹状突起伸長の促進やシナプス可塑性の適切な制御に寄与している<ref name=ref28><pubmed> 17936606 </pubmed></ref>。 | |||
p120–カテニンは、[[PLEKHA7]]タンパク質、そして微小管マイナス端に局在する[[Nezha]]タンパク質を介してアドへレンス・ジャンクションへの微小管を繫ぎとめることが示されている<ref name=ref29><pubmed> 19041755 </pubmed></ref>。また、[[アフリカツメガエル]]胚では、p120–カテニンが核内で[[転写抑制因子]][[Kaiso]]と結合し、[[脊椎動物]]の形態形成に必須な[[Wnt/PCPシグナル伝達系]](Wnt/β–カテニンシグナル伝達系とは違うWntシグナル)の[[xWnt11]]の遺伝子発現を活性化することが示された<ref name=ref30><pubmed> 15543138 </pubmed></ref>。しかし、p120–カテニンの核移行の分子機構(核移行の生理的な場合のトリガーの同定やp120–カテニンのリン酸化との関連など)やxWnt11以外の標的の遺伝子群についてはわかっていない点が多い<ref name=ref31><pubmed> 22583808 </pubmed></ref>。 | |||
====δ–カテニン==== | |||
マウスの脳組織における免疫沈降実験から、δ–カテニンはN–カドヘリンとβ–カテニンと結合することが確認され、樹状突起のシナプスに強く観察される。シナプスにおいてカドヘリン・カテニン複合体の一員として機能することが予想される<ref name=ref32><pubmed> 9971746 </pubmed></ref>。また、ラット神経組織の初代培養細胞では、δ–カテニンはGSK3β、β–カテニンと複合体を形成し、β–カテニンの分解を促進させる機能も有する<ref name=ref33><pubmed> 20623542 </pubmed></ref>。 また、シナプス後方細胞では、[[グルタミン酸]]受容体結合タンパク質GRIPやシナプスシナプス後部肥厚部分に局在化するPDS–95との結合が報告されているが、成熟したシナプスにおいてのみδ–カテニンはそれらと局在化する。一方で、シナプスの形成初期では、δ–カテニンの代わりにp120–カテニンがシナプス構造部分に局在する。このようにシナプスの形成過程の中で時期特異的に異なるカテニンが働いて、シグナル伝達の制御をしうる成熟したシナプスが構築されると考えられる<ref name=ref34><pubmed> 15752981 </pubmed></ref>。 | |||
==脳におけるカテニンの機能== | ==脳におけるカテニンの機能== | ||
| 187行目: | 172行目: | ||
===神経発生=== | ===神経発生=== | ||
神経発生時には、神経管の[[ | 神経発生時には、神経管の[[脳室側]]で未分化細胞が分裂し、表層方向へと移動し、適材適所に細胞が多種のニューロンへと分化し、その種類ごとに住みわけるように脳室面から表層方向に層構造を形成する。ニューロンはネットワークを形成し、神経活動を伝達する。αN–カテニンの欠損マウスでは小脳や海馬において層構造の形成がうまくいかない<ref name=ref35><pubmed> 12089526 </pubmed></ref>。[[ゼブラフィッシュ]]の中脳では、Wnt/β–カテニンシグナル伝達系が[[中脳視蓋]]のサイズの制御に寄与していることが示されている。[[LEF]]による転写が活性化すると、中脳領域での神経前駆細胞の増殖が促進する。その転写活性の制御が神経前駆細胞の増殖制御を介して中脳視蓋の大きさに影響をもたらすのではないかと考えられている<ref name=ref36><pubmed> 22373574 </pubmed></ref>。成体の海馬にも、[[神経幹細胞]]が存在しており、自己複製する一方で、神経細胞などへ分化することで新たな神経細胞となる。Wnt/β–カテニンシグナル伝達系は、海馬では神経幹細胞が神経前駆細胞へと分化するために必須であることがマウスやラットを用いた解析から示されている<ref name=ref37><pubmed> 19701198 </pubmed></ref>。海馬の神経幹細胞では、幹細胞から神経細胞への分化を決定する遺伝子の発現を制御するDNA配列があり、[[転写因子]][[Sox2]]がそのDNA配列を認識することによりその下流にある遺伝子発現が抑制され、未分化のままを維持できる。しかし、隣接する[[アストロサイト]]細胞で産生されたWntにより幹細胞のWnt/β–カテニンシグナル伝達系が活性化すると、β–カテニンが核へ移行し、TCF/LEFとの複合体として、Sox2の認識配列とオーバーラップした領域に結合するようになる。その結果として、その下流の遺伝子発現が活性化され、神経前駆細胞へと分化が誘導される。 | ||
===成長円錐の伸長=== | ===成長円錐の伸長=== | ||
[[成長円錐]] | [[成長円錐]]の伸長には、その先端でのアクチン分子の重合の力が利用されている。アクチンの重合が有効に成長円錐の伸長に使われるためには、形成されたアクチン線維が細胞外基質と間接的に連結し、基質に対して動かない必要がある。基質に結合する接着分子とアクチン線維との結合を担う分子をクラッチ分子と呼ぶが(実際にはアクチン線維と接着分子とを強固に結合するのではなく、結合解離を繰り返してアクチン線維は後方へ動くが、そのスピードがアクチン重合よりも遅ければ、成長円錐は伸長できる)、αN–カテニンは[[クラッチ分子]]として働くという報告がある。カドヘリン・カテニン複合体とアクチン線維との連結の適切な調節は成長円錐の伸長にも重要である<ref name=ref38><pubmed> 18524892 </pubmed></ref>。 | ||
===シナプス形成と可塑性=== | ===シナプス形成と可塑性=== | ||
シナプスは、神経回路内の情報伝達の場である。樹状突起表面には[[スパイン]]という突起構造が無数にあり、スパイン上ではシナプスが形成されている。シナプスを介した情報伝達に伴ってスパインの形態変化が見られ、それはシナプス形成やシナプス可塑性に関わると考えられている。スパインを形づくる主要な細胞骨格はアクチン線維であり、そこでのアクチン動態はスパインの運動性や形態を動的に変化させ、複数のアクチン結合タンパク質によってそのアクチン動態が制御されている。α–カテニンはスパインの安定化に働いている。αN–カテニン欠損マウスから得られた海馬の神経培養細胞では、N–カドヘリンやβ–カテニンは他のスパインマーカーとともにスパインに局在するが、スパインの形態やその時間変化に異常がみられ、安定的なシナプス構造が維持できない。一方で、αN–カテニンの過剰発現によって、樹状突起上のスパインの数の増加、さらにはスパインのターンオーバーが低下する。これらには、αN–カテニンのN末とC末の領域が必要であり、ここでもN–カドヘリン・β–カテニン・αN–カテニン、そしてアクチン線維が一連に繋がることが必須であることが示唆されている<ref name=ref39><pubmed> 15817378 </pubmed></ref>。 | |||
スパインのシナプス周辺領域では、N–カドヘリン・カテニン複合体による接着構造が形成され、シナプスの安定化に寄与していると考えられる。樹状突起と軸索とがシナプスを形成する際、スパインはもともと動的な糸状仮足様の構造をとっているが、[[軸索]]からの[[活動電位]]が伝わり、シナプス後膜が興奮性の活動電位を示すようになると、マッシュルーム型の構造へと変化し、安定化する。逆に、[[ナトリウムチャネル]]をブロックすることで、興奮性の活動電位を阻害すると、スパインは安定的な構造から動的な糸状仮足のような構造へと変化する。それと同時に、シナプスからαN–カテニンが消失する。αN–カテニンの過剰発現により、このナトリウムチャネル阻害依存的なスパインの形態変化が緩和される<ref name=ref40><pubmed> 12123610 </pubmed></ref><ref name=ref41><pubmed> 14622577 </pubmed></ref><ref name=ref42><pubmed> 15034585 </pubmed></ref>。このように神経活動によってシナプス接合部においてカドヘリン・カテニン、そして細胞骨格の連結が制御を受け、その結果としてシナプス構造やその安定性の変化、そしてシナプス伝達の制御に寄与しているという考えが提唱されている<ref name=ref39><pubmed> 15817378 </pubmed></ref>。変異型β–カテニンを発現させたマウスの海馬から分離した神経培養細胞では、活性化されたシナプス前膜直下に集積しているシナプス小胞の数の維持にβ–カテニンが重要であることが示された。ここでは、α–カテニンとの結合領域は必要ないので、β–カテニンが細胞接着構造を制御することだけに寄与しているのではないと考えられる<ref name=ref41><pubmed> 14622577 </pubmed></ref>。加えて、細胞接着やWnt/β–カテニンシグナル伝達経路とは別に、β–カテニンの新たなシグナル伝達経路が神経情報伝達において利用されていることが、神経初代培養細胞の解析から明らかになった。[[NMDA型グルタミン受容体]]が活性化すると、Wntとは関係なく、β–カテニンが切断され、その後はWnt/β–カテニンシグナル伝達経路と同様に核で機能する<ref name=ref43><pubmed> 17270735 </pubmed></ref>。p120–カテニンによるRhoA活性の抑制は、樹状突起上のスパインの密度の維持に寄与する<ref name=ref44><pubmed> 16815331 </pubmed></ref>。一方で、N–カドヘリンとp120–カテニンとの複合体の構造解析によって明らかになった両者の結合に重要なアミノ酸残基についての点変異体を発現させた海馬の神経培養細胞では、p120–カテニンがN–カドヘリンと結合できず、スパインの密度やスパインの幅が減少する<ref name=ref14><pubmed> 22535893</pubmed></ref>。δ–カテニンはスパインのサイズや数、形態の維持に必要である<ref name=ref22><pubmed>15489912</pubmed></ref>。 | |||
===大脳皮質のサイズ制御=== | |||
中枢神経系の幹/前駆細胞特異的にαE–カテニンを欠失させると、細胞間接着が形成できず、さらに細胞極性がなくなる。加えて、細胞数の増加、細胞周期の短縮、[[アポトーシス]]の減少がみられ、最終的な[[大脳皮質]]の厚みや大きさが増す。このノックアウト細胞では、[[大脳皮質の発生]]過程において細胞増殖を促進する[[ヘッジホッグシグナル伝達経路]]が強く活性化している。以上より、ノックアウト細胞では、細胞接着の崩壊により細胞密度を物理的に感知できなくなり、細胞は低密度であると感じ続け、ヘッジホックシグナル伝達の活性化を介して細胞増殖を促進し、細胞数の増加そして大脳皮質の過形成へとつながると解釈される。正常な場合は、αE–カテニンは発生過程における細胞増殖に関わるシグナル伝達と細胞間接着の制御とをうまく連動させることで、発生時期の大脳皮質の大きさを調節していると示唆される。これは、αE––カテニンの接着構造の制御自体だけでなく、複数のシグナル伝達系を仲介するという新たな機能であると議論されている<ref name=ref45><pubmed> 16543460 </pubmed></ref>。 | |||
==疾患との関わり== | ==疾患との関わり== | ||
もともと、δ–カテニンは[[家族性アルツハイマー病]]の原因遺伝子である[[プレセニリン1]]の相互作用因子の解析から同定された<ref name=ref46><pubmed> 9172160 </pubmed></ref>。染色体上のδ–カテニン遺伝子座を含む領域の欠損は、[[精神発達遅滞]]を起こすヒト遺伝病の一つである[[ネコ鳴き症候群]]患者に多くみられ、その後のδ–カテニンのノックアウトマウスの解析から、δ–カテニンはその症候群でみられる精神発達遅滞との関連が示唆された。そのノックアウトマウスでは、[[視覚]]からの刺激に対する[[視覚野]]の応答に障害がみられ、海馬の[[短期増強]]と[[長期増強]]の異常を示す。このノックアウトマウスの発生期のシナプス形成には異常はみられず、生存可能であるが、10週齢になると、大脳皮質のシナプスの密度の減少やシナプスの維持の欠落が見られるようになる。その分子機構はまだ不明であるが、δ–カテニンは、シナプスのスパイン構造の維持で機能することで、正常な認知機能やそれに繋がりうる精神発達に寄与すると示唆されている<ref name=ref47><pubmed> 19403811 </pubmed></ref> 。 | |||
また、[[小頭症]]や[[精神遅滞]]、[[痙攣]]をもつ患者において、β–カテニン遺伝子座のヘテロ欠損変異が見つかっている。 | |||
また、[[小頭症]]や[[精神遅滞]]、[[痙攣]]をもつ患者において、β | |||
カテニン全般的には、神経以外の組織における疾患よりもガンとの関連性がよく議論されている。[[wikipedia:ja:結腸直腸ガン|結腸直腸ガン]]や[[wikipedia:ja:黒色腫ガン|黒色腫ガン]]などの患者の組織ではβ–カテニンの遺伝子座にいくつかの異なる変異が見つかっている。これらの変異は、[[APC]]やGSK3βによるβ–カテニンのリン酸化を介したβ–カテニン/Lefによる遺伝子発現の制御不全を引き起こし、細胞の異常な増殖、つまりはがん化へと繋がっているのではないかと推察されている。β–カテニンと疾患との関係は複数の報告があり、OMINにはここに挙げていない情報が掲載されているので、ご参照ください。第5染色体の欠損をもつ骨髄白血病患者からの細胞HL–60の解析から、αE–カテニン遺伝子座の[[メチル化]]と[[ヒストン脱アセチル化]]により、その発現が抑制されないままになることがみられている。このαE–カテニンの発現が維持されたままの細胞では、細胞増殖の低下やアポトーシスによる細胞死が見られている。また、[[wikipedia:ja:アフリカ系アメリカ人|アフリカ系アメリカ人]]の[[wikipedia:ja:乳がん|乳がん]]患者においてもαE–カテニン遺伝子の中に変異が見つかっている。 | |||
p120–カテニンは、多くのがん組織での発現が上昇していることが示されているが、細胞膜にいるE–カドヘリンの量の減少を介して、もしくは細胞接着とは独立した機能を介して起こるのかはまだわかっていない<ref name=ref22><pubmed> 15489912 </pubmed></ref>。 | |||
ヒトのプラコグロビン遺伝子、JUPの変異は、アミノ酸残基の挿入や欠損といった異なる様式の変異がいくつかの疾患患者で発見された。その一つは、[[wikipedia:ja:掌蹠角皮症|掌蹠角皮症]]患者において、JUP遺伝子内でアミノ酸残基の欠損によるフレームシフトが起こっており、そのタンパク質として完成することができていないことが、[[ウェスタンブロット]]により示されている。 | ヒトのプラコグロビン遺伝子、JUPの変異は、アミノ酸残基の挿入や欠損といった異なる様式の変異がいくつかの疾患患者で発見された。その一つは、[[wikipedia:ja:掌蹠角皮症|掌蹠角皮症]]患者において、JUP遺伝子内でアミノ酸残基の欠損によるフレームシフトが起こっており、そのタンパク質として完成することができていないことが、[[ウェスタンブロット]]により示されている。 | ||
[[wikipedia:ja:催不整脈|催不整脈]]性の右室[[wikipedia:ja:心筋症|心筋症]](皮膚への異常は伴わない)を患った人を含むドイツ人の家族において、プラコグロビン遺伝子の変異が見つけられた。その変異は、プラコグロビンのN末端から39番目の場所に余計に[[セリン]]残基が挿入されているものだと予想され、さらにこの変異がある病理組織の[[電子顕微鏡]]像では、[[デスモソーム]]のサイズや数の減少が見つかった。プラコグロビン遺伝子内の挿入変異により、デスモソームの構造の制御がうまくいっていない可能性が示唆された他、Wntシグナルを介した経路の制御を阻害している可能性などが他のいくつかの研究結果をもって議論されている。 | |||
==関連項目== | ==関連項目== | ||
2014年2月6日 (木) 11:31時点における版
林 華子、米村 重信
理化学研究所 発生・再生科学総合研究センター 電子顕微鏡解析室
DOI XXXX/XXXX 原稿受付日:2012年11月28日 原稿完成日:2014年xx月XX日
担当編集委員:尾藤晴彦(東京大学大学院医学系研究科 神経生化学分野)
英語名:catenin 独:Catenin
カテニンは、細胞間接着の必須因子である接着分子カドヘリンの中の古典的カドヘリンと複合体(カドヘリン・カテニン複合体)を形成するタンパク質の総称である。カドヘリン・カテニン複合体中のカテニンのうち、α–カテニンは細胞骨格との連結、β–カテニンはカドヘリンとα–カテニンとの結合を担っており、どちらもカドヘリンによる細胞接着に必須である。p120–カテニンはエンドサイトーシスを介してカドヘリンの発現量の調節を行っている。細胞接着とは別の働きとして、β–カテニンはWnt/β–カテニンシグナルにおいて重要な役割を果たし、遺伝子発現調節を行う。α–カテニンも増殖のシグナルを調節する因子として研究が進んでいる。カテニンは脳の形態形成、神経細胞の伸長、シナプス形成などにも重要な働きをしている。
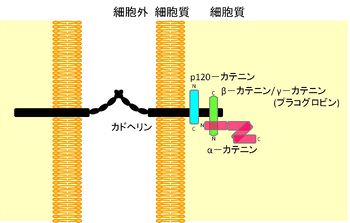
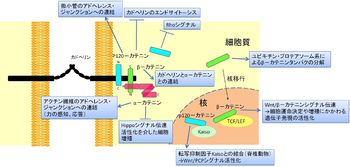
カテニンとは
カテニンは、古典的カドヘリンの中のE-カドヘリンとの複合体の構成因子の総称である(図1)。
接着間接着の必須分子であるE–カドヘリンの抗体を用いた免疫沈降反応でE–カドヘリンとともに共沈してくる複数のタンパク質がとれ、それらはE–カドヘリンの細胞質ドメインに 結合して複合体を形成していることが小沢らによって初めて示された[1]。カドヘリンはアクチンフィラメントを結合している細胞間接着装置、アドへレンス・ジャンクションの形成に必須な接着分子であり、カテニンはカドヘリンと細胞骨格アクチンフィラメントとの連結を担うものと予想され、ラテン語のcatena(chain)からカテニン(catenin)と命名された。
このような背景からカテニンの機能解析は、主に細胞間接着に着目して進められてきた。カテニンはカドヘリンを介した十分な接着活性に必須であることが明らかにされ、細胞間接着における接着分子カドヘリンの制御因子としての重要性が提示されている[2]。
カテニンの発現は、多くの組織で認められるものと組織特異的なものとがあり(表)、細胞レベルでは通常、カドヘリンと同様の分布を示す(以下の「発現」の項目を参照)。カテニンはカドヘリンの細胞質領域と結合してカドヘリン・カテニン複合体を作るが、カテニンが結合しうるカドヘリンはE–, N–, VE–カドヘリン等のクラッシックカドヘリンのみである[3]。
β–カテニンとp120-カテニンとに相当する分子は、上述した小沢らによるカテニン分子群の発見とは独立してほぼ同時に異なる研究者による異なる研究の中からも発見された経緯がある。ショウジョウバエのアルマジロ遺伝子は胚の体節形成に異常を示す変異体のスクリーニングから発見され、Wntシグナル伝達系の転写制御因子として核内においても機能することが知られていた。のちに哺乳類のカドヘリン・カテニン複合体中のβ–カテニンがアルマジロ遺伝子のオーソログであることが判明し、脊椎動物のβ–カテニンにも発生における遺伝子発現において重要な役割があることがわかった[4]。
p120-カテニンは、srcによる形質転換特異的にみられるチロシン残基のリン酸化をうける分子としてReynoldsらによって同定されており、アクチン細胞骨格動態への影響が見られていたこともあり、細胞/細胞外基質間接着との関連性についての解析も展開されていった[5]。そのような流れの中で、細胞接着だけでなく、発生・再生における遺伝子発現制御因子としての重要性が示されている(図2)。タンパク質の一次構造レベルでは、β–カテニンとp120-カテニンはアルマジロ反復配列を有するタンパク質として類似性を示し、その配列はさまざまな因子の結合領域として働く(図3)[2]。このようにカテニン分子は細胞間接着という共通の機能を担う一方で、分子としての性質は多様であり、その性質が各々のカテニン分子の多機能性を生み出していると考えられている。
種類
カテニンの主要な種類には、α–カテニン、β–カテニン、γ–カテニン/プラコグロビン、δ–カテニンがある。それぞれにサブタイプが存在する。
| タイプ | サブタイプ | ヒトにおける遺伝子名 | データベース上での遺伝子、タンパク質情報 | タンパク質立体構造 (Protein Data Bank Europeより) |
組織におけるタンパク質発現(UniGeneより) | ||
| RefSeq | UniProt | HUGO | |||||
| α–カテニン | αE–カテニン | CTNNA1 | NM_001903 | P35221 | ID2509 | CTNNA1 | 全身の多くの組織。扁桃腺での発現は検出されていない。 |
| αN–カテニン | CTNNA2 | NM_004389 | P26232 | ID2510 | CTNNA2 | 中枢神経系特異的な発現。 | |
| αT–カテニン | CTNNA3 | NM_013266 | Q9UI47 | ID2511 | データなし | 心臓、結合組織や脳において特に発現が高い。 | |
| β–カテニン | β–カテニン | CTNNB1 | NP_001091679 | P35222 | ID2514 | CTNNB1 | 全身の多くの組織にて発現あり。脂肪組織や副甲状腺、扁桃腺などでは発現は認められていない。 |
| γ–カテニン | γ–カテニン (プラコグロビン) |
JUP | XM_005257316 | P14923 | ID6207 | JUP | 全身の多くの組織にて発現あり。脂肪組織や副甲状腺、扁桃腺などでは発現は認められていない。 |
| p120–カテニン | p120–カテニン | CTNND1 | NM_001331 | O60716 | ID2515 | CTNND1 | 全身の多くの組織で発現。ただし、脾臓やへその緒などでは発現が認められていない。 |
| δ–カテニン | CTNND2 | NM_001332 | Q9UQB3 | ID2516 | データなし | 脳組織に特異的な発現。 | |
それぞれのカテニン分子のタンパク質発現については、UniGeneの中のEST(expressed sequence tag)を用いて調べたmRNA相対発現量のプロファイルにおいてゼロと報告されているもののみについて発現がみとめられないと記載したことに留意していただきたい。
α–カテニン
脊椎動物においては、αE–カテニン、αN–カテニン、αT–カテニンがこのグループに属する。
構造
α–カテニンは、β-カテニンやγ-カテニンに共通してみられるアルマジロ反復配列をもたないといったタンパク質一次構造レベルにおける他のカテニンとの類似性は持ち合わせていない[6]。アクチン結合タンパク質であるビンキュリンと塩基配列において相同性(約30%程度)を示す3つの領域(VH1, VH2, VH3)を含んでいる[7]。最もN末に位置するVH1では、β-カテニンと結合し、VH3はアクチン線維との結合に必要である。また、VH2には、ビンキュリンやアファディンといった他のアクチン結合タンパク質との結合、加えてビンキュリンの結合阻害領域も存在し、VH2の構造変化がVH2におけるタンパク質結合の制御に重要であると示唆されている。α–カテニンの立体構造については、VH1やVH2といった断片についてはα–カテニン単体やビンキュリンとの結合状態などの条件において精度よいX線結晶構造解析が行われている[8]。全長についてはαE–カテニンやαN–カテニンどちらにおいても十分に高い分解能での結晶構造が得られていないものの、近年においても精力的に解析が続けられている[8]。全長の構造が理解できれば、α–カテニン分子全体としての構造変化の制御についての理解がより進むと期待される。
発現
αE–カテニンは、扁桃腺での発現は認められていないが、体全身にわたる多くの組織に発現している。αN–カテニンは中枢神経系には特異的に発現している。発生中の中枢神経系では、神経前駆細胞にはαE–カテニンが発現しているが、それが神経細胞に分化するとαE–カテニンの発現は見られなくなり、αN–カテニンが発現するようになる[9]。 UniGeneのデータを参考にすると、αT–カテニンは心臓だけでなく結合組織や脳において高い発現が示されている。細胞レベルではα–カテニンは、細胞質タンパク質として存在するが、主には膜タンパク質であるカドヘリンと細胞質タンパク質β–カテニンとともに複合体を形成することにより、隣接する細胞に接触している細胞膜への局在が顕著である。
機能
上述したように、α–カテニンはカドヘリン接着活性に必須な機能をもつ。α–カテニンがβ–カテニンとアクチン線維とに結合するので、アドへレンス・ジャンクションにおいてカドヘリン・カテニン複合体とアクチン線維との結合を担うと考えられている[9][10]。α–カテニンが発現していなければ、カドヘリンが発現していても、接着分子としてのカドヘリンは実質的に機能せず、アドへレンス・ジャンクションも形成されない。
α–カテニンはβ–カテニンとはN末端で結合し、C末端ではアクチン線維と結合する。このC末端のアクチン線維結合領域の重要性は、ショウジョウバエの形態形成[11]やマウスの発生[11]において示されている。α–カテニンはビンキュリン、エプリン、ZO-1、αアクチニンなどのアクチン結合タンパク質とも結合するので、それらの結合を介して間接的にアクチン線維を連結している可能性もある[6]。 さらに、α–カテニンは、アドヘレンス・ジャンクションにおいて細胞間の張力を感知・伝達する分子であることが示され、動的なアドへレンス・ジャンクション形成に重要であると考えられる[12]。
また、αE–カテニンは、細胞間接着の機能とは別に、細胞増殖を負に制御することが知られている。細胞増殖の接触阻止に対する調節に重要なHippoシグナル伝達においては、転写制御を通じて増殖を抑制する[13]。後述するように中枢神経系では、αN–カテニンが神経回路形成を担うシナプス形成や安定性に必要である。大脳皮質における細胞増殖、神経突起の伸長の制御を行っているという報告もある[14]。
β–カテニン、γ–カテニン
β–カテニンとγ–カテニン(プラコグロビンとも呼ばれる)がこのグループに属する。ヒトにおいて両者は高い相同性(76%以上の相同性)をもつ。また、ショウジョウバエのアルマジロとも高い相同性をもつ。
構造
β–カテニンの一次構造についてはショウジョウバエのアルマジロで見つかった42アミノ酸残基の繰り返し配列(アルマジロ反復配列)が分子のN末端とC末端を除いた大部分を占める。β–カテニンタンパク質の全長の立体構造は、近年、解かれた[15]。この反復配列のほぼその全体にカドヘリンの細胞質領域の細胞膜より遠い部分が結合する。
E–カドヘリンは、細胞質領域の細胞膜より遠い部分を介して、β–カテニンのアルマジロ配列のほぼ全体に結合する[16]。α–カテニンとは、そのアルマジロ反復配列のもっともN末よりの部分で結合する[16]。他にも、アルマジロ反復配列領域では、転写因子であるTCF/LEFに結合することで、Wntシグナル伝達における転写制御に、また、APC、Axinもその反復配列へ結合することで、β–カテニンの分解に関与している。また、アルマジロ反復配列よりもN末側の領域とGSK3βとの結合も存在し、β–カテニンの分解促進に重要であると考えられている。
プラコグロビンはβ–カテニンの機能を相補しうるが、特徴としてそのN末端部分を介してデスモソームカドヘリンの細胞質部分に結合する。プラコグロビンもβ–カテニンと同様にその中央部分にアルマジロ反復配列をもち、その領域はデスモプラーキンと呼ばれる中間径フィラメント結合タンパク質との結合サイトをもつ。このデスモプラーキンとの結合はデスモソームと中間径線維との連結役として機能していると考えられている[17]。
発現
β–カテニンは一般的に体全身の多くの組織において発現が認められているが、脂肪組織や副甲状腺、扁桃腺といって一部の組織では発現が確認されていない。細胞レベルにおいては、β–カテニンは、α–カテニンと同様、細胞質タンパク質であるため、細胞質に一様な局在も示すが、カドヘリンを介した膜への局在が主である。Wntシグナルの活性化状態では、β–カテニンは核への局在が見られるようになる。
プラコグロビン(γ–カテニン)も、β–カテニンと同様に多くの組織では発現が確認されているが、副腎や、耳、唾液腺、脾臓、へその緒、血管といった一部の組織には発現が確認されていない。細胞レベルでは、デスモソームへの局在が顕著である。
機能
β–カテニンにはカドヘリン・カテニン複合体中のメンバーとしての細胞間接着への必須な役割と、Wnt/β–カテニンシグナルの転写制御因子としての役割とがある。
細胞間接着におけるβ–カテニンの役割は、カドヘリンとα–カテニンとの連結にある[4]。α–カテニンの結合は生化学的に確認されており、E–カドヘリンとともにアドへレンス・ジャンクションに局在するという細胞レベルの知見からも支持されている[16]。F9細胞ではβ–カテニンをノックアウトしてもプラコグロビン(γ–カテニンとも呼ばれる)の発現が増加し、カドヘリンによる接着能は維持されるが、プラコグロビンもあわせてノックアウトするとその接着能は失われることが示されている[18]。しかし、カドヘリンが発現していない細胞に、カドヘリンとα–カテニンとを融合したタンパク質を発現させれば、β–カテニンが存在しなくてもカドヘリンの機能は発揮される[19]。これらは、細胞間接着においてプラコグロビンがβ–カテニンの機能を補完する役割を担っており、またβ–カテニンの機能は、α–カテニンをカドヘリンに結合させることであることを示している。
細胞接着においてプラコグロビンはデスモソ-ムカドヘリンと細胞骨格の一つである中間径フィラメントの結合タンパク質であるプラモプラーキンの両方と同時に結合し、デスモソームの構造体として機能する。プラコグロビンのC末端領域の欠損した培養細胞では、細胞のラテラル面でのデスモソームの融合が見られ、結果としてデスモソームのサイズの増大が起こる。また、プラコグロビンは、アドへレンス・ジャンクションとデスモソーム間の分子のクロストークの制御に寄与していることが示唆されている。プラコグロビンのノックアウトマウスの心筋組織ではアドへレンス・ジャンクションの構成因子とデスモソームの構成因子とが混在してラテラル面に局在するようになってしまう[20]。
β–カテニンは、発生における遺伝子発現の制御にも重要な役割がある。Wntシグナルがない状態では、細胞質のβ–カテニン(カドヘリン・カテニン複合体中のものとは別である)はGSK3βによりリン酸化され、それを標的としたユビキチン化により、プロテアソームによるタンパク質分解をうけることで、その量が低く保たれている。WntシグナルがやってくればGSK3βによるリン酸化が抑制され、β–カテニンは核内へ移行し、TCF/LEFと複合体を形成し、細胞周期関連因子や体軸決定因子などの標的遺伝子を活性化する[4]。これは、ウニの発生を初めとし無脊椎動物、脊椎動物両方において報告されている[4]。
神経系においても、シナプス形成と可塑性や神経幹細胞の未分化状態の維持など多岐にわたる寄与が報告されている[21][22]。また、プロコグロビンも先に挙げたTCF/LEFと結合でき、核内への局在がみられる状況では、Wnt/β–カテニンシグナル伝達の抑制が同時にみられていることから、実際にはプロコグロビンはβ–カテニンと相互排他的にTCF/LEFへ結合しうり、その結果としてWnt/β–カテニンシグナル伝達の制御を実現していると解釈できる。
p120–カテニン
p120–カテニンとδ–カテニンがこのグループに属する(p120–カテニンファミリーにはその他複数のタンパク質があるが、ここでは比較的研究歴史の長い2つのカテニンについてのみ紹介する。それ以外のタンパク質については総説[5][23]を参照していただきたい。)。
構造
p120–カテニンファミリータンパク質の中央領域に見られる10個のアルマジロ反復配列は、カドヘリンの細胞膜に近接した細胞質領域と結合する[23]。p120–カテニンのアルマジロ反復配列に隣接するN末端側の領域は、スレオニン残基のリン酸化サイトが複数存在している。そのさらに隣に位置するN末端にはコイルドコイル配列が存在している。加えて、δ–カテニンは、そのC末端にPDZタンパク質との結合領域を有す。その一例として、グルタミン酸受容体結合タンパク質GRIPやシナプス後膜直下に形成されるシナプス後部肥厚(Postsynaptic density: PSD)に局在化するPSD-95などがそこに結合する[14]。
発現
p120–カテニンは、多くの組織において強い発現が認められるが、他のカテニンと同様に扁桃腺やへその緒での発現は検出されていない。δ–カテニンは、神経系での強い発現が特徴である。上皮細胞では、p120–カテニンはアドへレンス・ジャンクションを含む、隣接する細胞に接触している細胞膜に濃縮する。δ–カテニンは、成熟した樹状突起のシナプスに強く観察されるが、脳組織の中でもその発現度合いは異なる。大脳皮質や、海馬、嗅球では強く発現するが、小脳や視床の発現はやや落ちる傾向がみられている(Allen Brain Atlas)。
機能
p120–カテニン
p120–カテニンは、カドヘリンとの結合を介してカドヘリンのエンドサイトーシスを 抑制し、細胞膜上のカドヘリン量を維持する。p120–カテニンのチロシンリン酸化はp120–カテニンのカドヘリンとの結合解除に寄与する。このカドヘリンのp120–カテニン結合領域内には、そのエンドサイトーシスシグナルが存在し、カドヘリンにp120–カテニンが結合することによって、そのシグナルがマスクされ、その結果としてカドヘリンは細胞内に取り込まれないようになっているという機構が近年示されている[24] [25]。カドヘリンの接着活性がない大腸癌由来の細胞株を用いた解析からは、p120–カテニンはカドヘリンと結合することで接着活性を抑制する結合因子であることが示された[26]。カドヘリンの発現量の低下は悪性腫瘍組織でみられる特徴の一つあるが[26]、そのような腫瘍組織のいくつかの種類では、p120–カテニンが細胞膜に局在できないことによってカドヘリンのエンドサイトーシスが亢進されると解釈される[27]。
また、p120–カテニンは細胞膜直下のアクチン線維動態も制御している。p120–カテニンはアクチン細胞骨格動態の主要な制御因子である低分子量Gタンパク質RhoAと結合し、RhoAの活性化を抑制し、一方で糸状仮足や葉状仮足の発達につながる膜直下のアクチン細胞骨格の再編成に必要な他の低分子量Gタンパク質RacやCdc42を活性化することで、細胞接着形成の初期段階においてアクチン細胞骨格の再編成を促進すると考えられている[28]。細胞質におけるRhoAとの結合はp120–カテニンのリン酸化に依存している[28]が、先に述べたように、p120–カテニンのリン酸化の増加がカドヘリンの接着活性の低下に働くことを考えあわせると、p120–カテニンのリン酸化の制御は細胞接着と細胞運動の適切な均衡をとるという機構の一つになると考えられる。ラット海馬由来の培養神経細胞においても、上述したp120–カテニンのRhoA、Rac、そしてCdc42の活性制御を介してアクチン細胞骨格動態を活性化させ、神経樹状突起伸長の促進やシナプス可塑性の適切な制御に寄与している[29]。
p120–カテニンは、PLEKHA7タンパク質、そして微小管マイナス端に局在するNezhaタンパク質を介してアドへレンス・ジャンクションへの微小管を繫ぎとめることが示されている[30]。また、アフリカツメガエル胚では、p120–カテニンが核内で転写抑制因子Kaisoと結合し、脊椎動物の形態形成に必須なWnt/PCPシグナル伝達系(Wnt/β–カテニンシグナル伝達系とは違うWntシグナル)のxWnt11の遺伝子発現を活性化することが示された[31]。しかし、p120–カテニンの核移行の分子機構(核移行の生理的な場合のトリガーの同定やp120–カテニンのリン酸化との関連など)やxWnt11以外の標的の遺伝子群についてはわかっていない点が多い[32]。
δ–カテニン
マウスの脳組織における免疫沈降実験から、δ–カテニンはN–カドヘリンとβ–カテニンと結合することが確認され、樹状突起のシナプスに強く観察される。シナプスにおいてカドヘリン・カテニン複合体の一員として機能することが予想される[33]。また、ラット神経組織の初代培養細胞では、δ–カテニンはGSK3β、β–カテニンと複合体を形成し、β–カテニンの分解を促進させる機能も有する[34]。 また、シナプス後方細胞では、グルタミン酸受容体結合タンパク質GRIPやシナプスシナプス後部肥厚部分に局在化するPDS–95との結合が報告されているが、成熟したシナプスにおいてのみδ–カテニンはそれらと局在化する。一方で、シナプスの形成初期では、δ–カテニンの代わりにp120–カテニンがシナプス構造部分に局在する。このようにシナプスの形成過程の中で時期特異的に異なるカテニンが働いて、シグナル伝達の制御をしうる成熟したシナプスが構築されると考えられる[35]。
脳におけるカテニンの機能
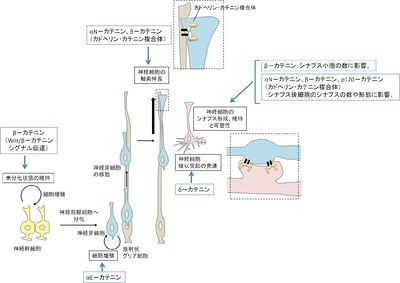
神経発生
神経発生時には、神経管の脳室側で未分化細胞が分裂し、表層方向へと移動し、適材適所に細胞が多種のニューロンへと分化し、その種類ごとに住みわけるように脳室面から表層方向に層構造を形成する。ニューロンはネットワークを形成し、神経活動を伝達する。αN–カテニンの欠損マウスでは小脳や海馬において層構造の形成がうまくいかない[36]。ゼブラフィッシュの中脳では、Wnt/β–カテニンシグナル伝達系が中脳視蓋のサイズの制御に寄与していることが示されている。LEFによる転写が活性化すると、中脳領域での神経前駆細胞の増殖が促進する。その転写活性の制御が神経前駆細胞の増殖制御を介して中脳視蓋の大きさに影響をもたらすのではないかと考えられている[37]。成体の海馬にも、神経幹細胞が存在しており、自己複製する一方で、神経細胞などへ分化することで新たな神経細胞となる。Wnt/β–カテニンシグナル伝達系は、海馬では神経幹細胞が神経前駆細胞へと分化するために必須であることがマウスやラットを用いた解析から示されている[38]。海馬の神経幹細胞では、幹細胞から神経細胞への分化を決定する遺伝子の発現を制御するDNA配列があり、転写因子Sox2がそのDNA配列を認識することによりその下流にある遺伝子発現が抑制され、未分化のままを維持できる。しかし、隣接するアストロサイト細胞で産生されたWntにより幹細胞のWnt/β–カテニンシグナル伝達系が活性化すると、β–カテニンが核へ移行し、TCF/LEFとの複合体として、Sox2の認識配列とオーバーラップした領域に結合するようになる。その結果として、その下流の遺伝子発現が活性化され、神経前駆細胞へと分化が誘導される。
成長円錐の伸長
成長円錐の伸長には、その先端でのアクチン分子の重合の力が利用されている。アクチンの重合が有効に成長円錐の伸長に使われるためには、形成されたアクチン線維が細胞外基質と間接的に連結し、基質に対して動かない必要がある。基質に結合する接着分子とアクチン線維との結合を担う分子をクラッチ分子と呼ぶが(実際にはアクチン線維と接着分子とを強固に結合するのではなく、結合解離を繰り返してアクチン線維は後方へ動くが、そのスピードがアクチン重合よりも遅ければ、成長円錐は伸長できる)、αN–カテニンはクラッチ分子として働くという報告がある。カドヘリン・カテニン複合体とアクチン線維との連結の適切な調節は成長円錐の伸長にも重要である[39]。
シナプス形成と可塑性
シナプスは、神経回路内の情報伝達の場である。樹状突起表面にはスパインという突起構造が無数にあり、スパイン上ではシナプスが形成されている。シナプスを介した情報伝達に伴ってスパインの形態変化が見られ、それはシナプス形成やシナプス可塑性に関わると考えられている。スパインを形づくる主要な細胞骨格はアクチン線維であり、そこでのアクチン動態はスパインの運動性や形態を動的に変化させ、複数のアクチン結合タンパク質によってそのアクチン動態が制御されている。α–カテニンはスパインの安定化に働いている。αN–カテニン欠損マウスから得られた海馬の神経培養細胞では、N–カドヘリンやβ–カテニンは他のスパインマーカーとともにスパインに局在するが、スパインの形態やその時間変化に異常がみられ、安定的なシナプス構造が維持できない。一方で、αN–カテニンの過剰発現によって、樹状突起上のスパインの数の増加、さらにはスパインのターンオーバーが低下する。これらには、αN–カテニンのN末とC末の領域が必要であり、ここでもN–カドヘリン・β–カテニン・αN–カテニン、そしてアクチン線維が一連に繋がることが必須であることが示唆されている[40]。
スパインのシナプス周辺領域では、N–カドヘリン・カテニン複合体による接着構造が形成され、シナプスの安定化に寄与していると考えられる。樹状突起と軸索とがシナプスを形成する際、スパインはもともと動的な糸状仮足様の構造をとっているが、軸索からの活動電位が伝わり、シナプス後膜が興奮性の活動電位を示すようになると、マッシュルーム型の構造へと変化し、安定化する。逆に、ナトリウムチャネルをブロックすることで、興奮性の活動電位を阻害すると、スパインは安定的な構造から動的な糸状仮足のような構造へと変化する。それと同時に、シナプスからαN–カテニンが消失する。αN–カテニンの過剰発現により、このナトリウムチャネル阻害依存的なスパインの形態変化が緩和される[41][42][43]。このように神経活動によってシナプス接合部においてカドヘリン・カテニン、そして細胞骨格の連結が制御を受け、その結果としてシナプス構造やその安定性の変化、そしてシナプス伝達の制御に寄与しているという考えが提唱されている[40]。変異型β–カテニンを発現させたマウスの海馬から分離した神経培養細胞では、活性化されたシナプス前膜直下に集積しているシナプス小胞の数の維持にβ–カテニンが重要であることが示された。ここでは、α–カテニンとの結合領域は必要ないので、β–カテニンが細胞接着構造を制御することだけに寄与しているのではないと考えられる[42]。加えて、細胞接着やWnt/β–カテニンシグナル伝達経路とは別に、β–カテニンの新たなシグナル伝達経路が神経情報伝達において利用されていることが、神経初代培養細胞の解析から明らかになった。NMDA型グルタミン受容体が活性化すると、Wntとは関係なく、β–カテニンが切断され、その後はWnt/β–カテニンシグナル伝達経路と同様に核で機能する[44]。p120–カテニンによるRhoA活性の抑制は、樹状突起上のスパインの密度の維持に寄与する[45]。一方で、N–カドヘリンとp120–カテニンとの複合体の構造解析によって明らかになった両者の結合に重要なアミノ酸残基についての点変異体を発現させた海馬の神経培養細胞では、p120–カテニンがN–カドヘリンと結合できず、スパインの密度やスパインの幅が減少する[14]。δ–カテニンはスパインのサイズや数、形態の維持に必要である[23]。
大脳皮質のサイズ制御
中枢神経系の幹/前駆細胞特異的にαE–カテニンを欠失させると、細胞間接着が形成できず、さらに細胞極性がなくなる。加えて、細胞数の増加、細胞周期の短縮、アポトーシスの減少がみられ、最終的な大脳皮質の厚みや大きさが増す。このノックアウト細胞では、大脳皮質の発生過程において細胞増殖を促進するヘッジホッグシグナル伝達経路が強く活性化している。以上より、ノックアウト細胞では、細胞接着の崩壊により細胞密度を物理的に感知できなくなり、細胞は低密度であると感じ続け、ヘッジホックシグナル伝達の活性化を介して細胞増殖を促進し、細胞数の増加そして大脳皮質の過形成へとつながると解釈される。正常な場合は、αE–カテニンは発生過程における細胞増殖に関わるシグナル伝達と細胞間接着の制御とをうまく連動させることで、発生時期の大脳皮質の大きさを調節していると示唆される。これは、αE––カテニンの接着構造の制御自体だけでなく、複数のシグナル伝達系を仲介するという新たな機能であると議論されている[46]。
疾患との関わり
もともと、δ–カテニンは家族性アルツハイマー病の原因遺伝子であるプレセニリン1の相互作用因子の解析から同定された[47]。染色体上のδ–カテニン遺伝子座を含む領域の欠損は、精神発達遅滞を起こすヒト遺伝病の一つであるネコ鳴き症候群患者に多くみられ、その後のδ–カテニンのノックアウトマウスの解析から、δ–カテニンはその症候群でみられる精神発達遅滞との関連が示唆された。そのノックアウトマウスでは、視覚からの刺激に対する視覚野の応答に障害がみられ、海馬の短期増強と長期増強の異常を示す。このノックアウトマウスの発生期のシナプス形成には異常はみられず、生存可能であるが、10週齢になると、大脳皮質のシナプスの密度の減少やシナプスの維持の欠落が見られるようになる。その分子機構はまだ不明であるが、δ–カテニンは、シナプスのスパイン構造の維持で機能することで、正常な認知機能やそれに繋がりうる精神発達に寄与すると示唆されている[48] 。
また、小頭症や精神遅滞、痙攣をもつ患者において、β–カテニン遺伝子座のヘテロ欠損変異が見つかっている。
カテニン全般的には、神経以外の組織における疾患よりもガンとの関連性がよく議論されている。結腸直腸ガンや黒色腫ガンなどの患者の組織ではβ–カテニンの遺伝子座にいくつかの異なる変異が見つかっている。これらの変異は、APCやGSK3βによるβ–カテニンのリン酸化を介したβ–カテニン/Lefによる遺伝子発現の制御不全を引き起こし、細胞の異常な増殖、つまりはがん化へと繋がっているのではないかと推察されている。β–カテニンと疾患との関係は複数の報告があり、OMINにはここに挙げていない情報が掲載されているので、ご参照ください。第5染色体の欠損をもつ骨髄白血病患者からの細胞HL–60の解析から、αE–カテニン遺伝子座のメチル化とヒストン脱アセチル化により、その発現が抑制されないままになることがみられている。このαE–カテニンの発現が維持されたままの細胞では、細胞増殖の低下やアポトーシスによる細胞死が見られている。また、アフリカ系アメリカ人の乳がん患者においてもαE–カテニン遺伝子の中に変異が見つかっている。
p120–カテニンは、多くのがん組織での発現が上昇していることが示されているが、細胞膜にいるE–カドヘリンの量の減少を介して、もしくは細胞接着とは独立した機能を介して起こるのかはまだわかっていない[23]。
ヒトのプラコグロビン遺伝子、JUPの変異は、アミノ酸残基の挿入や欠損といった異なる様式の変異がいくつかの疾患患者で発見された。その一つは、掌蹠角皮症患者において、JUP遺伝子内でアミノ酸残基の欠損によるフレームシフトが起こっており、そのタンパク質として完成することができていないことが、ウェスタンブロットにより示されている。
催不整脈性の右室心筋症(皮膚への異常は伴わない)を患った人を含むドイツ人の家族において、プラコグロビン遺伝子の変異が見つけられた。その変異は、プラコグロビンのN末端から39番目の場所に余計にセリン残基が挿入されているものだと予想され、さらにこの変異がある病理組織の電子顕微鏡像では、デスモソームのサイズや数の減少が見つかった。プラコグロビン遺伝子内の挿入変異により、デスモソームの構造の制御がうまくいっていない可能性が示唆された他、Wntシグナルを介した経路の制御を阻害している可能性などが他のいくつかの研究結果をもって議論されている。
関連項目
参考文献
- ↑
Ozawa, M., Baribault, H., & Kemler, R. (1989).
The cytoplasmic domain of the cell adhesion molecule uvomorulin associates with three independent proteins structurally related in different species. The EMBO journal, 8(6), 1711-7. [PubMed:2788574] [PMC] [WorldCat] - ↑ 2.0 2.1
McCrea, P.D., & Gu, D. (2010).
The catenin family at a glance. Journal of cell science, 123(Pt 5), 637-42. [PubMed:20164302] [PMC] [WorldCat] [DOI] - ↑
Arikkath, J. (2009).
Regulation of dendrite and spine morphogenesis and plasticity by catenins. Molecular neurobiology, 40(1), 46-54. [PubMed:19401831] [WorldCat] [DOI] - ↑ 4.0 4.1 4.2 4.3
Valenta, T., Hausmann, G., & Basler, K. (2012).
The many faces and functions of β-catenin. The EMBO journal, 31(12), 2714-36. [PubMed:22617422] [PMC] [WorldCat] [DOI] - ↑ 5.0 5.1
Reynolds, A.B. (2007).
p120-catenin: Past and present. Biochimica et biophysica acta, 1773(1), 2-7. [PubMed:17175391] [PMC] [WorldCat] [DOI] - ↑ 6.0 6.1
Maiden, S.L., & Hardin, J. (2011).
The secret life of α-catenin: moonlighting in morphogenesis. The Journal of cell biology, 195(4), 543-52. [PubMed:22084304] [PMC] [WorldCat] [DOI] - ↑
Nagafuchi, A., Takeichi, M., & Tsukita, S. (1991).
The 102 kd cadherin-associated protein: similarity to vinculin and posttranscriptional regulation of expression. Cell, 65(5), 849-57. [PubMed:1904011] [WorldCat] [DOI] - ↑ 8.0 8.1
Ishiyama, N., Tanaka, N., Abe, K., Yang, Y.J., Abbas, Y.M., Umitsu, M., ..., & Ikura, M. (2013).
An autoinhibited structure of α-catenin and its implications for vinculin recruitment to adherens junctions. The Journal of biological chemistry, 288(22), 15913-25. [PubMed:23589308] [PMC] [WorldCat] [DOI] - ↑ 9.0 9.1
Hirano, S., Kimoto, N., Shimoyama, Y., Hirohashi, S., & Takeichi, M. (1992).
Identification of a neural alpha-catenin as a key regulator of cadherin function and multicellular organization. Cell, 70(2), 293-301. [PubMed:1638632] [WorldCat] [DOI] - ↑
Watabe-Uchida, M., Uchida, N., Imamura, Y., Nagafuchi, A., Fujimoto, K., Uemura, T., ..., & Takeichi, M. (1998).
alpha-Catenin-vinculin interaction functions to organize the apical junctional complex in epithelial cells. The Journal of cell biology, 142(3), 847-57. [PubMed:9700171] [PMC] [WorldCat] [DOI] - ↑ 11.0 11.1
Desai, R., Sarpal, R., Ishiyama, N., Pellikka, M., Ikura, M., & Tepass, U. (2013).
Monomeric α-catenin links cadherin to the actin cytoskeleton. Nature cell biology, 15(3), 261-73. [PubMed:23417122] [WorldCat] [DOI] 引用エラー: 無効な<ref>タグ; name "ref11"が異なる内容で複数回定義されています - ↑
Yonemura, S., Wada, Y., Watanabe, T., Nagafuchi, A., & Shibata, M. (2010).
alpha-Catenin as a tension transducer that induces adherens junction development. Nature cell biology, 12(6), 533-42. [PubMed:20453849] [WorldCat] [DOI] - ↑
Robinson, B.S., & Moberg, K.H. (2011).
Cell-cell junctions: α-catenin and E-cadherin help fence in Yap1. Current biology : CB, 21(21), R890-2. [PubMed:22075429] [PMC] [WorldCat] [DOI] - ↑ 14.0 14.1 14.2
Hirano, S., & Takeichi, M. (2012).
Cadherins in brain morphogenesis and wiring. Physiological reviews, 92(2), 597-634. [PubMed:22535893] [WorldCat] [DOI] 引用エラー: 無効な<ref>タグ; name "ref14"が異なる内容で複数回定義されています - ↑
Xing, Y., Takemaru, K., Liu, J., Berndt, J.D., Zheng, J.J., Moon, R.T., & Xu, W. (2008).
Crystal structure of a full-length beta-catenin. Structure (London, England : 1993), 16(3), 478-87. [PubMed:18334222] [PMC] [WorldCat] [DOI] - ↑ 16.0 16.1 16.2
Gooding, J.M., Yap, K.L., & Ikura, M. (2004).
The cadherin-catenin complex as a focal point of cell adhesion and signalling: new insights from three-dimensional structures. BioEssays : news and reviews in molecular, cellular and developmental biology, 26(5), 497-511. [PubMed:15112230] [WorldCat] [DOI] - ↑
Garrod, D., & Chidgey, M. (2008).
Desmosome structure, composition and function. Biochimica et biophysica acta, 1778(3), 572-87. [PubMed:17854763] [WorldCat] [DOI] - ↑
Fukunaga, Y., Liu, H., Shimizu, M., Komiya, S., Kawasuji, M., & Nagafuchi, A. (2005).
Defining the roles of beta-catenin and plakoglobin in cell-cell adhesion: isolation of beta-catenin/plakoglobin-deficient F9 cells. Cell structure and function, 30(2), 25-34. [PubMed:16357441] [WorldCat] [DOI] - ↑
Nagafuchi, A., Ishihara, S., & Tsukita, S. (1994).
The roles of catenins in the cadherin-mediated cell adhesion: functional analysis of E-cadherin-alpha catenin fusion molecules. The Journal of cell biology, 127(1), 235-45. [PubMed:7929566] [PMC] [WorldCat] [DOI] - ↑
Garrod, D.R., Fisher, C., Smith, A., & Nie, Z. (2009).
Pervanadate stabilizes desmosomes. Cell adhesion & migration, 2(3), 161-6. [PubMed:19262118] [PMC] [WorldCat] [DOI] - ↑ Elkouby, Y. M., Frank, D.
Wnt/beta-Catenin Signaling in Vertebrate Posterior Neural Development
Developmental Biology (San Rafael (CA)):2010 - ↑
Wisniewska, M.B. (2013).
Physiological role of β-catenin/TCF signaling in neurons of the adult brain. Neurochemical research, 38(6), 1144-55. [PubMed:23377854] [PMC] [WorldCat] [DOI] - ↑ 23.0 23.1 23.2 23.3
Reynolds, A.B., & Roczniak-Ferguson, A. (2004).
Emerging roles for p120-catenin in cell adhesion and cancer. Oncogene, 23(48), 7947-56. [PubMed:15489912] [WorldCat] [DOI] 引用エラー: 無効な<ref>タグ; name "ref22"が異なる内容で複数回定義されています - ↑
Ishiyama, N., Lee, S.H., Liu, S., Li, G.Y., Smith, M.J., Reichardt, L.F., & Ikura, M. (2010).
Dynamic and static interactions between p120 catenin and E-cadherin regulate the stability of cell-cell adhesion. Cell, 141(1), 117-28. [PubMed:20371349] [WorldCat] [DOI] - ↑
Nanes, B.A., Chiasson-MacKenzie, C., Lowery, A.M., Ishiyama, N., Faundez, V., Ikura, M., ..., & Kowalczyk, A.P. (2012).
p120-catenin binding masks an endocytic signal conserved in classical cadherins. The Journal of cell biology, 199(2), 365-80. [PubMed:23071156] [PMC] [WorldCat] [DOI] - ↑ 26.0 26.1
Aono, S., Nakagawa, S., Reynolds, A.B., & Takeichi, M. (1999).
p120(ctn) acts as an inhibitory regulator of cadherin function in colon carcinoma cells. The Journal of cell biology, 145(3), 551-62. [PubMed:10225956] [PMC] [WorldCat] [DOI] 引用エラー: 無効な<ref>タグ; name "ref25"が異なる内容で複数回定義されています - ↑
Thoreson, M.A., & Reynolds, A.B. (2002).
Altered expression of the catenin p120 in human cancer: implications for tumor progression. Differentiation; research in biological diversity, 70(9-10), 583-9. [PubMed:12492499] [WorldCat] [DOI] - ↑ 28.0 28.1
Castaño, J., Solanas, G., Casagolda, D., Raurell, I., Villagrasa, P., Bustelo, X.R., ..., & Duñach, M. (2007).
Specific phosphorylation of p120-catenin regulatory domain differently modulates its binding to RhoA. Molecular and cellular biology, 27(5), 1745-57. [PubMed:17194753] [PMC] [WorldCat] [DOI] - ↑
Kwiatkowski, A.V., Weis, W.I., & Nelson, W.J. (2007).
Catenins: playing both sides of the synapse. Current opinion in cell biology, 19(5), 551-6. [PubMed:17936606] [PMC] [WorldCat] [DOI] - ↑
Meng, W., Mushika, Y., Ichii, T., & Takeichi, M. (2008).
Anchorage of microtubule minus ends to adherens junctions regulates epithelial cell-cell contacts. Cell, 135(5), 948-59. [PubMed:19041755] [WorldCat] [DOI] - ↑
Kim, S.W., Park, J.I., Spring, C.M., Sater, A.K., Ji, H., Otchere, A.A., ..., & McCrea, P.D. (2004).
Non-canonical Wnt signals are modulated by the Kaiso transcriptional repressor and p120-catenin. Nature cell biology, 6(12), 1212-20. [PubMed:15543138] [WorldCat] [DOI] - ↑
Menke, A., & Giehl, K. (2012).
Regulation of adherens junctions by Rho GTPases and p120-catenin. Archives of biochemistry and biophysics, 524(1), 48-55. [PubMed:22583808] [WorldCat] [DOI] - ↑
Lu, Q., Paredes, M., Medina, M., Zhou, J., Cavallo, R., Peifer, M., ..., & Kosik, K.S. (1999).
delta-catenin, an adhesive junction-associated protein which promotes cell scattering. The Journal of cell biology, 144(3), 519-32. [PubMed:9971746] [PMC] [WorldCat] [DOI] - ↑
Bareiss, S., Kim, K., & Lu, Q. (2010).
Delta-catenin/NPRAP: A new member of the glycogen synthase kinase-3beta signaling complex that promotes beta-catenin turnover in neurons. Journal of neuroscience research, 88(11), 2350-63. [PubMed:20623542] [PMC] [WorldCat] [DOI] - ↑
Kosik, K.S., Donahue, C.P., Israely, I., Liu, X., & Ochiishi, T. (2005).
Delta-catenin at the synaptic-adherens junction. Trends in cell biology, 15(3), 172-8. [PubMed:15752981] [WorldCat] [DOI] - ↑
Park, C., Falls, W., Finger, J.H., Longo-Guess, C.M., & Ackerman, S.L. (2002).
Deletion in Catna2, encoding alpha N-catenin, causes cerebellar and hippocampal lamination defects and impaired startle modulation. Nature genetics, 31(3), 279-84. [PubMed:12089526] [WorldCat] [DOI] - ↑
Ota, S., Ishitani, S., Shimizu, N., Matsumoto, K., Itoh, M., & Ishitani, T. (2012).
NLK positively regulates Wnt/β-catenin signalling by phosphorylating LEF1 in neural progenitor cells. The EMBO journal, 31(8), 1904-15. [PubMed:22373574] [PMC] [WorldCat] [DOI] - ↑
Kuwabara, T., Hsieh, J., Muotri, A., Yeo, G., Warashina, M., Lie, D.C., ..., & Gage, F.H. (2009).
Wnt-mediated activation of NeuroD1 and retro-elements during adult neurogenesis. Nature neuroscience, 12(9), 1097-105. [PubMed:19701198] [PMC] [WorldCat] [DOI] - ↑
Bard, L., Boscher, C., Lambert, M., Mège, R.M., Choquet, D., & Thoumine, O. (2008).
A molecular clutch between the actin flow and N-cadherin adhesions drives growth cone migration. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(23), 5879-90. [PubMed:18524892] [PMC] [WorldCat] [DOI] - ↑ 40.0 40.1
Takeichi, M., & Abe, K. (2005).
Synaptic contact dynamics controlled by cadherin and catenins. Trends in cell biology, 15(4), 216-21. [PubMed:15817378] [WorldCat] [DOI] - ↑
Togashi, H., Abe, K., Mizoguchi, A., Takaoka, K., Chisaka, O., & Takeichi, M. (2002).
Cadherin regulates dendritic spine morphogenesis. Neuron, 35(1), 77-89. [PubMed:12123610] [WorldCat] [DOI] - ↑ 42.0 42.1
Bamji, S.X., Shimazu, K., Kimes, N., Huelsken, J., Birchmeier, W., Lu, B., & Reichardt, L.F. (2003).
Role of beta-catenin in synaptic vesicle localization and presynaptic assembly. Neuron, 40(4), 719-31. [PubMed:14622577] [PMC] [WorldCat] [DOI] - ↑
Abe, K., Chisaka, O., Van Roy, F., & Takeichi, M. (2004).
Stability of dendritic spines and synaptic contacts is controlled by alpha N-catenin. Nature neuroscience, 7(4), 357-63. [PubMed:15034585] [WorldCat] [DOI] - ↑
Abe, K., & Takeichi, M. (2007).
NMDA-receptor activation induces calpain-mediated beta-catenin cleavages for triggering gene expression. Neuron, 53(3), 387-97. [PubMed:17270735] [WorldCat] [DOI] - ↑
Elia, L.P., Yamamoto, M., Zang, K., & Reichardt, L.F. (2006).
p120 catenin regulates dendritic spine and synapse development through Rho-family GTPases and cadherins. Neuron, 51(1), 43-56. [PubMed:16815331] [PMC] [WorldCat] [DOI] - ↑
Lien, W.H., Klezovitch, O., Fernandez, T.E., Delrow, J., & Vasioukhin, V. (2006).
alphaE-catenin controls cerebral cortical size by regulating the hedgehog signaling pathway. Science (New York, N.Y.), 311(5767), 1609-12. [PubMed:16543460] [PMC] [WorldCat] [DOI] - ↑
Zhou, J., Liyanage, U., Medina, M., Ho, C., Simmons, A.D., Lovett, M., & Kosik, K.S. (1997).
Presenilin 1 interaction in the brain with a novel member of the Armadillo family. Neuroreport, 8(6), 1489-94. [PubMed:9172160] [WorldCat] [DOI] - ↑
Arikkath, J., Peng, I.F., Ng, Y.G., Israely, I., Liu, X., Ullian, E.M., & Reichardt, L.F. (2009).
Delta-catenin regulates spine and synapse morphogenesis and function in hippocampal neurons during development. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(17), 5435-42. [PubMed:19403811] [PMC] [WorldCat] [DOI]