「カテニン」の版間の差分
細編集の要約なし |
Hanakohayashi (トーク | 投稿記録) 細 →成長円錐の伸長 |
||
| (3人の利用者による、間の53版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">林 華子、[http://researchmap.jp/read0118149/?lang=japanese 米村 重信]</font><br> | <font size="+1">林 華子、[http://researchmap.jp/read0118149/?lang=japanese 米村 重信]</font><br> | ||
''理化学研究所 発生・再生科学総合研究センター 電子顕微鏡解析室''<br> | ''理化学研究所 発生・再生科学総合研究センター 電子顕微鏡解析室''<br> | ||
DOI XXXX/XXXX 原稿受付日:2012年11月28日 原稿完成日:2013年xx月XX日<br> | |||
担当編集委員:[http://researchmap.jp/ | 担当編集委員:[http://researchmap.jp/Bito/?lang=japanese 尾藤晴彦](東京大学大学院医学系研究科 神経生化学分野)<br> | ||
</div> | </div> | ||
英語名:catenin 独:Catenin | |||
{{box|text= | {{box|text= | ||
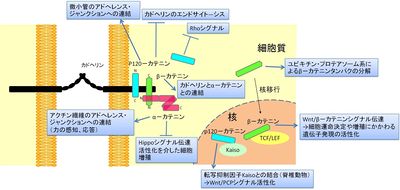
カテニンは、[[細胞間接着]]の必須因子である[[接着分子]][[カドヘリン]]の中の[[クラシックカドヘリン]]と複合体(カドヘリン・カテニン複合体)を形成するタンパク質の総称である<ref name=ref1><pubmed> 2788574 </pubmed></ref>(図1)。カドヘリン・カテニン複合体中のカテニンのうち、α–カテニンは[[細胞骨格]]との連結、β–カテニンはカドヘリンとα–カテニンとの結合を担っており、どちらもカドヘリンによる細胞接着に必須である。p120–カテニンはエンドサイトーシスを介してカドヘリンの発現量の調節を行っている<ref name=ref2><pubmed> 20164302 </pubmed></ref>。細胞接着とは別の働きとして、β–カテニンは[[Wnt]]/β–カテニンシグナルにおいて重要な役割を果たし、[[wikipedia:ja:遺伝子発現|遺伝子発現]]調節を行う。α–カテニンも増殖のシグナルを調節する因子として研究が進んでいる(図2)。カテニンは脳の形態形成、神経細胞の伸長、[[シナプス形成]]などにも重要な働きをしている<ref name=ref3><pubmed> 19401831 </pubmed></ref>(図3)。 | |||
}} | |||
==カテニンとは== | ==カテニンとは== | ||
(イントロダクションを御願い致します) | |||
==種類== | ==種類== | ||
カテニンの主要な種類には、α | カテニンの主要な種類には、α–カテニン、β–カテニン、γ–カテニン/プラコグロビン、δ–カテニンがある。それぞれにサブタイプが存在する。 | ||
{| class="wikitable" style="text-align:center" | {| class="wikitable" style="text-align:center" | ||
|+ | |+ カテニン分子群の遺伝子とタンパク質の基本情報 | ||
|- style="background-color:#ddf" | |- style="background-color:#ddf" | ||
| rowspan="2" | タイプ | | rowspan="2" | タイプ | ||
| rowspan="2" | サブタイプ | | rowspan="2" | サブタイプ | ||
| rowspan="2" | | | rowspan="2" | ヒトにおける遺伝子名 | ||
| colspan="3" | データベース上での遺伝子、タンパク質情報 | | colspan="3" | データベース上での遺伝子、タンパク質情報 | ||
| rowspan="2" | タンパク質立体構造<br>([[w:Protein Data Bank|Protein Data Bank]] Europeより) | | rowspan="2" | タンパク質立体構造<br>([[w:Protein Data Bank|Protein Data Bank]] Europeより) | ||
| rowspan="2" | | | rowspan="2" | 組織におけるタンパク発現([[w:UniGene|UniGene]より) | ||
|- | |- | ||
|- style="background-color:#ddf" | |- style="background-color:#ddf" | ||
| 42行目: | 32行目: | ||
| [http://www.genenames.org/ HUGO] | | [http://www.genenames.org/ HUGO] | ||
|- | |- | ||
| rowspan="3" | '''α | | rowspan="3" | '''α–カテニン''' | ||
| α | | αE–カテニン | ||
| ''CTNNA1'' | | ''CTNNA1'' | ||
| [http://www.ncbi.nlm.nih.gov/nuccore/NM_001903.2 NM_001903] | | [http://www.ncbi.nlm.nih.gov/nuccore/NM_001903.2 NM_001903] | ||
| [http://www.uniprot.org/uniprot/P35221 P35221] | | [http://www.uniprot.org/uniprot/P35221 P35221] | ||
| [http://www.genenames.org/data/hgnc_data.php?hgnc_id=2509 ID2509] | | [http://www.genenames.org/data/hgnc_data.php?hgnc_id=2509 ID2509] | ||
| [http://www.ebi.ac.uk/pdbe/searchResults.html?display=both&term=CTNNA1 CTNNA1] | | [http://www.ebi.ac.uk/pdbe/searchResults.html?display=both&term=CTNNA1 CTNNA1]||全身の多くの組織。扁桃腺での発現は検出されていない。 | ||
| | |||
|- | |- | ||
| α | | αN–カテニン | ||
| ''CTNNA2'' | | ''CTNNA2'' | ||
| [http://www.ncbi.nlm.nih.gov/nuccore/NM_004389 NM_004389] | | [http://www.ncbi.nlm.nih.gov/nuccore/NM_004389 NM_004389] | ||
| [http://www.uniprot.org/uniprot/P26232 P26232] | | [http://www.uniprot.org/uniprot/P26232 P26232] | ||
| [http://www.genenames.org/data/hgnc_data.php?hgnc_id=2510 ID2510] | | [http://www.genenames.org/data/hgnc_data.php?hgnc_id=2510 ID2510] | ||
| [http://www.ebi.ac.uk/pdbe/searchResults.html?display=both&term=%E2%80%98%E2%80%98CTNNA2%E2%80%99%E2%80%99 CTNNA2] | | [http://www.ebi.ac.uk/pdbe/searchResults.html?display=both&term=%E2%80%98%E2%80%98CTNNA2%E2%80%99%E2%80%99 CTNNA2] ||中枢神経系特異的な発現。 | ||
| | |||
|- | |- | ||
| α | | αT–カテニン | ||
| ''CTNNA3'' | | ''CTNNA3'' | ||
| [http://www.ncbi.nlm.nih.gov/nuccore/NM_013266 NM_013266] | | [http://www.ncbi.nlm.nih.gov/nuccore/NM_013266 NM_013266] | ||
| [http://www.uniprot.org/uniprot/Q9UI47 Q9UI47] | | [http://www.uniprot.org/uniprot/Q9UI47 Q9UI47] | ||
| [http://www.genenames.org/data/hgnc_data.php?hgnc_id=2511 ID2511] | | [http://www.genenames.org/data/hgnc_data.php?hgnc_id=2511 ID2511] | ||
| データなし | | データなし||心臓、結合組織や脳において特に発現が高い。 | ||
| | |||
|- | |- | ||
| '''β | | '''β–カテニン''' | ||
| β | | β–カテニン | ||
| ''CTNNB1'' | | ''CTNNB1'' | ||
| [http://www.ncbi.nlm.nih.gov/protein/NP_001091679 NP_001091679] | | [http://www.ncbi.nlm.nih.gov/protein/NP_001091679 NP_001091679] | ||
| [http://www.uniprot.org/uniprot/P35222 P35222] | | [http://www.uniprot.org/uniprot/P35222 P35222] | ||
| [http://www.genenames.org/data/hgnc_data.php?hgnc_id=2514 ID2514] | | [http://www.genenames.org/data/hgnc_data.php?hgnc_id=2514 ID2514] | ||
| [http://www.ebi.ac.uk/pdbe/searchResults.html?display=both&term=P35222%20or%20Q0VCX4%20or%20Q02248%20or%20Q9WU82%20or%20O42486%20or%20Q7ZU14%20or%20P18824%20or%20O44326 CTNNB1] | | [http://www.ebi.ac.uk/pdbe/searchResults.html?display=both&term=P35222%20or%20Q0VCX4%20or%20Q02248%20or%20Q9WU82%20or%20O42486%20or%20Q7ZU14%20or%20P18824%20or%20O44326 CTNNB1]||全身の多くの組織にて発現あり。脂肪組織や副甲状腺、扁桃腺などでは発現は認められていない。 | ||
| | |||
|- | |- | ||
| '''γ | | '''γ–カテニン''' | ||
| γ | | γ–カテニン<br>(プラコグロビン) | ||
| ''JUP'' | | ''JUP'' | ||
| [http://www.ncbi.nlm.nih.gov/nuccore/XM_005257316 XM_005257316] | | [http://www.ncbi.nlm.nih.gov/nuccore/XM_005257316 XM_005257316] | ||
| [http://www.uniprot.org/uniprot/P14923 P14923] | | [http://www.uniprot.org/uniprot/P14923 P14923] | ||
| [http://www.genenames.org/data/hgnc_data.php?hgnc_id=6207 ID6207] | | [http://www.genenames.org/data/hgnc_data.php?hgnc_id=6207 ID6207] | ||
| [http://www.ebi.ac.uk/pdbe/searchResults.html?display=both&term=jup | | [http://www.ebi.ac.uk/pdbe/searchResults.html?display=both&term=jup Jup]||全身の多くの組織にて発現あり。脂肪組織や副甲状腺、扁桃腺などでは発現は認められていない。 | ||
| | |||
|- | |- | ||
| rowspan="2" | ''' | | rowspan="2" | '''p120–カテニン''' | ||
| | | p120–カテニン | ||
| ''CTNND1'' | | ''CTNND1'' | ||
| [http://www.ncbi.nlm.nih.gov/nuccore/NM_001331 NM_001331] | | [http://www.ncbi.nlm.nih.gov/nuccore/NM_001331 NM_001331] | ||
| [http://www.uniprot.org/uniprot/O60716 O60716] | | [http://www.uniprot.org/uniprot/O60716 O60716] | ||
| [http://www.genenames.org/data/hgnc_data.php?hgnc_id=2515 ID2515] | | [http://www.genenames.org/data/hgnc_data.php?hgnc_id=2515 ID2515] | ||
| [http://www.ebi.ac.uk/pdbe/searchResults.html?display=both&term=CTNND1 CTNND1] | | [http://www.ebi.ac.uk/pdbe/searchResults.html?display=both&term=CTNND1 CTNND1]||全身の多くの組織で発現。ただし、脾臓やへその緒などでは発現が認められていない。 | ||
| | |||
|- | |- | ||
| δ | | δ–カテニン | ||
| ''CTNND2'' | | ''CTNND2'' | ||
| [http://www.ncbi.nlm.nih.gov/nuccore/NM_001332 NM_001332] | | [http://www.ncbi.nlm.nih.gov/nuccore/NM_001332 NM_001332] | ||
| [http://www.uniprot.org/uniprot/Q9UQB3 Q9UQB3] | | [http://www.uniprot.org/uniprot/Q9UQB3 Q9UQB3] | ||
| [http://www.genenames.org/data/hgnc_data.php?hgnc_id=2516 ID2516] | | [http://www.genenames.org/data/hgnc_data.php?hgnc_id=2516 ID2516] | ||
| データなし | | データなし||脳組織に特異的な発現。 | ||
| | |||
|} | |} | ||
[[ファイル:fig1hh.jpg|right|thumb|400x256px|'''図1.アドヘレンス・ジャンクションにおけるカドヘリン・カテニン複合体の模式図''']] | |||
[[ファイル:fig2hh.jpg|right|thumb|400x228px|'''図2.カテニン分子群の主な機能''']] | |||
[[ファイル:Fig3_catenin_structure_HH02.jpg|right|thumb|400x228px|'''図3.カテニン分子群のタンパク一次構造''']] | |||
カテニンはカドヘリンの細胞質領域と結合してカドヘリン・カテニン複合体を作るが、カテニンが結合しうるカドヘリンはE–, N–, VE–カドヘリン等のクラッシックカドヘリンのみである。 | |||
==α | ==α–カテニン== | ||
αE–カテニン、αN–カテニン、αT–カテニンがこのグループに属する。 | |||
===構造=== | ===構造=== | ||
===発現=== | ===発現=== | ||
組織全般にはαE–カテニンが発現し、神経系にはαN–カテニン特異的に発現している。発生中の中枢神経系では、[[神経前駆細胞]]にはαE–カテニンが発現しているが、それが神経細胞に[[分化]]するとαE–カテニンの発現は見られなくなり、αN–カテニンが発現するようになる<ref name=ref5><pubmed> 16543460 </pubmed></ref>。 | |||
===機能=== | ===機能=== | ||
α | α–カテニンはβ–カテニンと[[アクチン]]線維とに結合する。カドヘリン接着活性は、α–カテニンによって支えられており、その役割はカドヘリン・カテニン複合体とアクチン線維との結合であると考えられている<ref name=ref4><pubmed> 1638632 </pubmed></ref>。α–カテニンが発現していなければ、カドヘリンが発現していても、接着分子としてのカドヘリンは実質的に機能しない。 | ||
α | α–カテニンはβ–カテニンとはN末端で結合し、C末端ではアクチン線維と結合する。このC末端のアクチン線維結合領域の重要性は、[[ショウジョウバエ]]の形態形成<ref name=ref6><pubmed> 23417122 </pubmed></ref>や[[マウス]]の発生<ref name=ref7><pubmed> 9023354 </pubmed></ref>において示されている。α–カテニンは[[ビンキュリン]]、[[エプリン]]、[[ZO–1]]、[[αアクチニン]]などのアクチン結合タンパク質とも結合するので、それらの結合を介して間接的にアクチン線維を連結している可能性もある<ref name=ref8><pubmed> 22084304 </pubmed></ref>。 | ||
さらに、α | さらに、α–カテニンは、アドヘレンス・ジャンクションにおいて細胞間の張力を感知・伝達する分子であることが示され、動的なアドへレンス・ジャンクション形成に重要であると考えられる<ref name=ref9><pubmed> 20453849 </pubmed></ref>。 | ||
また、α | また、αE–カテニンは、細胞間接着の機能とは別に、[[細胞増殖]]を負に制御することが知られている。細胞増殖の接触阻止に対する調節に重要な[[Hippo]][[シグナル伝達]]においては、転写制御を通じて増殖を抑制する<ref><pubmed> 22075429 </pubmed></ref>。後述するように神経系では、αN–カテニンが神経回路形成を担うシナプス形成や安定性に必要である。[[大脳皮質]]における細胞増殖、神経突起の伸長の制御を行っているという報告もある<ref><pubmed> 22535893 </pubmed></ref>。 | ||
==β–カテニン、γ–カテニン== | |||
β–カテニンとγ–カテニン(プラコグロビンとも呼ばれる)がこのグループに属する。両者は高い相同性(76%以上の相同性)をもつ。 | |||
===構造=== | ===構造=== | ||
===発現=== | ===発現=== | ||
===機能=== | ===機能=== | ||
β | β–カテニンにはカドヘリン・カテニン複合体中のメンバーとしての細胞接着への必須な役割と、Wnt/β–カテニンシグナルの[[転写制御因子]]としての役割とがある。γ–カテニンはプラコグロビンとも呼ばれ、β–カテニンと高い相同性(76%以上の相同性)をもつ。 | ||
細胞間接着におけるβ–カテニンの役割は、カドヘリンとα–カテニンとの連結にある<ref name=ref12><pubmed> 22617422 </pubmed></ref>。β–カテニンのN末端とC末端を除いた大部分は[[アルマジロ反復配列]]であり、ほぼその全体にカドヘリンの細胞質領域の細胞膜より遠い部分が結合する。α–カテニンとは、そのアルマジロ反復配列のもっともN末よりの部分で結合する<ref><pubmed> 15112230 </pubmed></ref>。F9細胞ではβ–カテニンをノックアウトしてもプラコグロビンの発現が増加し、カドヘリンによる細胞接着能は維持されるが、プラコグロビンもあわせてノックアウトするとその接着能は失われることが示されている<ref><pubmed> 16357441 </pubmed></ref>。しかし、カドヘリンが発現していない細胞に、カドヘリンとα–カテニンとを融合したタンパク質を発現させれば、β–カテニンが存在しなくてもカドヘリンの機能は発揮される<ref><pubmed> 7929566 </pubmed></ref>。 | |||
ショウジョウバエの[[アルマジロ]]遺伝子は胚の体節形成に異常を示す変異体のスクリーニングから発見されWntシグナル伝達系の転写制御因子として核内においても機能することが知られていた。のちに[[哺乳類]]のカドヘリン・カテニン複合体中のβ–カテニンがアルマジロ遺伝子のオーソログであることが判明し、[[脊椎動物]]のβ–カテニンにも発生における遺伝子発現において重要な役割があることがわかった。Wntシグナルがない状態では、細胞質のβ–カテニン(カドヘリン・カテニン複合体中のものとは別である)は[[GSK3]]βによりリン酸化され、それを標的とした[[ユビキチン化]]により、[[プロテアソーム]]によるタンパク質分解をうけることで、その量が低く保たれている。WntシグナルがやってくればGSK3βによる[[リン酸化]]が抑制され、β–カテニンは核内へ移行し、[[TCF]]/[[LEF]]と複合体を形成し、[[細胞周期]]関連因子や[[体軸]]決定因子などの標的遺伝子を活性化する<ref name=ref12><pubmed> 22617422 </pubmed></ref>。これは、ウニの発生を初めとし無脊椎動物、脊椎動物両方において報告されている<ref name=ref12><pubmed> 22617422 </pubmed></ref>。神経系においても、シナプス形成と[[可塑性]]や[[神経幹細胞]]の未分化状態の維持など多岐にわたる寄与が報告されている<ref name=ref16>'''Elkouby, Y. M., Frank, D. '''<br>Wnt/beta-Catenin Signaling in Vertebrate Posterior Neural Development<br>''Developmental Biology (San Rafael (CA))'':2010</ref> <ref name=ref17><pubmed> 23377854 </pubmed></ref>。 | |||
==δ–カテニン== | |||
p120–カテニンとδ–カテニンがこのグループに属する。(PSD-95やGRIPとも相互作用すると思います。これらの点についても御願い致します) | |||
===構造=== | ===構造=== | ||
δ–カテニンはそのアルマジロ反復配列で、カドヘリンの細胞膜に近接した細胞質領域と結合する。 | |||
===発現=== | ===発現=== | ||
δ–カテニンは、神経系特異的な発現が特徴で、δ–カテニンの局在は、樹状突起のシナプスに強く観察され、樹状突起の形態変化に寄与する。 | |||
===機能=== | ===機能=== | ||
==== | ====p120–カテニン==== | ||
もともとは、強く[[チロシンリン酸化]]をうける分子として同定された<ref name=ref18><pubmed> 2469003 </pubmed></ref>。p120–カテニンは、カドヘリンとの結合を介してカドヘリンの[[エンドサイトーシス]]を抑制し、細胞膜上のカドヘリン量を維持する。チロシンリン酸化はp120–カテニンのカドヘリンとの結合解除に寄与する。このカドヘリンのp120–カテニン結合領域内には、そのエンドサイトーシスシグナルが存在し、カドヘリンにp120–カテニンが結合することによって、そのシグナルがマスクされ、その結果としてカドヘリンは細胞内に取り込まれないようになっているという機構が近年示されている<ref name=ref19><pubmed> 20371349 </pubmed></ref> <ref name=ref20><pubmed> 23071156 </pubmed></ref>。カドヘリンの接着活性がない[[wikipedia:ja:大腸癌|大腸癌]]由来の[[細胞株]]を用いた解析からは、p120–カテニンはカドヘリンと結合することで接着活性を抑制する結合因子であることが示された<ref name=ref21><pubmed> 10225956 </pubmed></ref>。カドヘリンの発現量の低下は[[wikipedia:ja:悪性腫瘍|悪性腫瘍]]組織でみられる特徴の一つあるが<ref name=ref22><pubmed> 10647931 </pubmed></ref>、そのような腫瘍組織のいくつかの種類では、p120–カテニンが細胞膜に局在できないことによってカドヘリンのエンドサイトーシスが亢進されると解釈される<ref name=ref23><pubmed> 12492499 </pubmed></ref>。また、p120–カテニンは細胞膜直下のアクチン線維動態も制御している。p120–カテニンはアクチン細胞骨格動態の主要な制御因子である[[低分子量Gタンパク質]][[RhoA]]と結合し、RhoAの活性化を抑制し、一方で[[糸状仮足]]や[[葉状仮足]]の発達につながる膜直下のアクチン細胞骨格の再編成に必要な他の低分子量Gタンパク質[[Rac]]や[[Cdc42]]を活性化することで、細胞接着形成の初期段階においてアクチン細胞骨格の再編成を促進すると考えられている<ref name=ref24><pubmed> 17194753 </pubmed></ref>。細胞質におけるRhoAとの結合はp120–カテニンのリン酸化に依存している<ref name=ref24><pubmed>17194753</pubmed></ref>が、先に述べたように、p120–カテニンのリン酸化の増加がカドヘリンの接着活性の低下に働くことを考えあわせると、p120–カテニンのリン酸化の制御は細胞接着と細胞運動の適切な均衡をとるという機構の一つになると考えられる。ラット[[海馬]]由来の培養神経細胞においても、上述したp120–カテニンのRhoA、Rac、そしてCdc42の活性制御を介してアクチン細胞骨格動態を活性化させ、[[神経樹状突起]]伸長の促進やシナプス可塑性の適切な制御に寄与している<ref name=ref25><pubmed> 17936606 </pubmed></ref>。 | |||
p120–カテニンは、[[PLEKHA7]]タンパク質、そして[[微小管]]マイナス端に局在する[[Nezha]]タンパク質を介して[[アドへレンス・ジャンクション]]への微小管を繫ぎとめることが示されている<ref name=ref26><pubmed> 19041755 </pubmed></ref>。また、[[アフリカツメガエル]]胚では、p120–カテニンが核内で転写抑制因子[[Kaiso]]と結合し、脊椎動物の形態形成に必須なWnt/[[PCPシグナル伝達系]](Wnt/β–カテニンシグナル伝達系とは違うWntシグナル)の[[xWnt11]]の遺伝子発現を活性化することが示された<ref name=ref27><pubmed> 15543138 </pubmed></ref>。しかし、p120–カテニンの核移行の分子機構(核移行の生理的な場合のトリガーの同定やp120–カテニンのリン酸化との関連など)やxWnt11以外の標的の遺伝子群についてはわかっていない点が多い<ref name=ref28><pubmed> 22583808 </pubmed></ref>。situ | |||
====神経系特異的な発現を示すδ–カテニン==== | |||
マウスの脳組織における免疫沈降実験から、δ–カテニンは[[N–カドヘリン]]とβ–カテニンと結合することが確認され、シナプスにおいてカドヘリン・カテニン複合体の一員として機能することが予想される<ref name=ref29><pubmed> 9971746 </pubmed></ref>。また、ラット神経組織の初代培養細胞では、δ–カテニンはGSK3β、β–カテニンと複合体を形成し、β–カテニンの分解を促進させる機能も有する<ref name=ref30><pubmed> 20623542 </pubmed></ref>。 | |||
==== | |||
==脳におけるカテニンの機能== | ==脳におけるカテニンの機能== | ||
[[ファイル:fig3hh.jpg|right|thumb|400x283px|''' | [[ファイル:fig3hh.jpg|right|thumb|400x283px|'''図3.中枢神経系におけるカテニンの寄与''']] | ||
===神経発生=== | ===神経発生=== | ||
神経発生時には、[[神経管]]の[[脳室]]側で未分化細胞が分裂し、表層方向へと移動し、適材適所に細胞が多種のニューロンへと分化し、その種類ごとに住みわけるように脳室面から表層方向に層構造を形成する。ニューロンはネットワークを形成し、神経活動を伝達する。αN–カテニンの欠損マウスでは[[小脳]]や[[海馬]]において層構造の形成がうまくいかない<ref><pubmed> 12089526 </pubmed></ref>。[[ゼブラフィッシュ]]の[[中脳]]では、Wnt/β–カテニンシグナル伝達系が中脳[[視蓋]]のサイズの制御に寄与していることが示されている。LEFによる[[wikipedia:ja:転写|転写]]が活性化すると、中脳領域での神経前駆細胞の増殖が促進する。その転写活性の制御が神経前駆細胞の増殖制御を介して中脳視蓋の大きさに影響をもたらすのではないかと考えられている<ref><pubmed> 22373574 </pubmed></ref>。成体の海馬にも、神経幹細胞が存在しており、自己複製する一方で、神経細胞などへ分化することで新たな神経細胞となる。Wnt/β–カテニンシグナル伝達系は、海馬では神経幹細胞が[[神経前駆細胞]]へと分化するために必須であることがマウスや[[ラット]]を用いた解析から示されている<ref><pubmed> 19701198 </pubmed></ref>。海馬の神経幹細胞では、幹細胞から神経細胞への分化を決定する遺伝子の発現を制御するDNA配列があり、転写因子[[Sox2]]がそのDNA配列を認識することによりその下流にある遺伝子発現が抑制され、未分化のままを維持できる。しかし、隣接する[[アストロサイト]]細胞で産生されたWntにより幹細胞のWnt/β–カテニンシグナル伝達系が活性化すると、β–カテニンが核へ移行し、TCF/LEFとの複合体として、Sox2の認識配列とオーバーラップした領域に結合するようになる。その結果として、その下流の遺伝子発現が活性化され、神経前駆細胞へと分化が誘導される。 | |||
===成長円錐の伸長=== | ===成長円錐の伸長=== | ||
[[成長円錐]] | [[成長円錐]]の伸長には、その先端でのアクチン分子の重合の力が利用されている。アクチンの重合が有効に成長円錐の伸長に使われるためには、形成されたアクチン線維が細胞外基質と間接的に連結し、基質に対して動かない必要がある。基質に結合する接着分子とアクチン線維との結合を担う分子をクラッチ分子と呼ぶが(実際にはアクチン線維と接着分子とを強固に結合するのではなく、結合解離を繰り返してアクチン線維は後方へ動くが、そのスピードがアクチン重合よりも遅ければ、成長円錐は伸長できる)、αN–カテニンは[[クラッチ分子]]として働くという報告がある。カドヘリン・カテニン複合体とアクチン線維との連結の適切な調節は成長円錐の伸長にも重要である<ref><pubmed> 18524892 </pubmed></ref>。 | ||
===シナプス形成と可塑性=== | ===シナプス形成と可塑性=== | ||
シナプスは、神経回路内の情報伝達の場である。樹状突起表面にはスパインという突起構造が無数にあり、スパイン上ではシナプスが形成されている。シナプスを介した情報伝達に伴ってスパインの形態変化が見られ、それはシナプス形成やシナプス可塑性に関わると考えられている。スパインを形づくる主要な細胞骨格はアクチン線維であり、そこでのアクチン動態はスパインの運動性や形態を動的に変化させ、複数のアクチン結合タンパク質によってそのアクチン動態が制御されている。α–カテニンはスパインの安定化に働いている。αN–カテニン欠損マウスから得られた海馬の神経培養細胞では、N–カドヘリンやβ–カテニンは他のスパインマーカーとともにスパインに局在するが、スパインの形態やその時間変化に異常がみられ、安定的なシナプス構造が維持できない。一方で、αN–カテニンの過剰発現によって、樹状突起上のスパインの数の増加、さらにはスパインのターンオーバーが低下する。これらには、αN–カテニンのN末とC末の領域が必要であり、ここでもN–カドヘリン・β–カテニン・αN–カテニン、そしてアクチン線維が一連に繋がることが必須であることが示唆されている。 | |||
スパインのシナプス周辺領域では、N–カドヘリン・カテニン複合体による接着構造が形成され、シナプスの安定化に寄与していると考えられる。樹状突起と軸索とがシナプスを形成する際、スパインはもともと動的な糸状仮足様の構造をとっているが、[[軸索]]からの[[活動電位]]が伝わり、[[シナプス後膜]]が興奮性の活動電位を示すようになると、マッシュルーム型の構造へと変化し、安定化する。逆に、[[ナトリウムチャネル]]をブロックすることで、興奮性の活動電位を阻害すると、スパインは安定的な構造から動的な糸状仮足のような構造へと変化する。それと同時に、シナプスからαN–カテニンが消失する。αN–カテニンの過剰発現により、このナトリウムチャネル阻害依存的なスパインの形態変化が緩和される<ref name=ref37><pubmed> 12123610 </pubmed></ref><ref name=ref38><pubmed> 14622577 </pubmed></ref><ref name=ref39><pubmed> 15034585 </pubmed></ref>。このように神経活動によってシナプス接合部においてカドヘリン・カテニン、そして細胞骨格の連結が制御を受け、その結果としてシナプス構造やその安定性の変化、そしてシナプス伝達の制御に寄与しているという考えが提唱されている<ref name=ref40><pubmed> 15817378 </pubmed></ref>。変異型β–カテニンを発現させたマウスの海馬から分離した神経培養細胞では、活性化された[[シナプス前膜]]直下に集積している[[シナプス小胞]]の数の維持にβ–カテニンが重要であることが示された。ここでは、α–カテニンとの結合領域は必要ないので、β–カテニンが細胞接着構造を制御することだけに寄与しているのではないと考えられる<ref name=ref38><pubmed> 14622577 </pubmed></ref>。加えて、[[細胞接着]]やWnt/β–カテニンシグナル伝達経路とは別に、β–カテニンの新たなシグナル伝達経路が神経情報伝達において利用されていることが、[[神経初代培養細胞]]の解析から明らかになった。[[NMDA型グルタミン受容体]]が活性化すると、Wntとは関係なく、β–カテニンが切断され、その後はWnt/β–カテニンシグナル伝達経路と同様に核で機能する<ref name=ref41><pubmed> 17270735 </pubmed></ref>。p120–カテニンによる[[RhoA]]活性の抑制は、樹状突起上のスパインの密度の維持に寄与する<ref name=ref42><pubmed> 16815331 </pubmed></ref>。一方で、N–カドヘリンとp120–カテニンとの複合体の構造解析によって明らかになった両者の結合に重要なアミノ酸残基についての点変異体を発現させた海馬の神経培養細胞では、p120–カテニンがN–カドヘリンと結合できず、スパインの密度やスパインの幅が減少する<ref name=ref19 />。δ–カテニンはスパインのサイズや数、形態の維持に必要である<ref name=ref32 />。 | |||
===大脳皮質のサイズ制御=== | |||
中枢神経系の幹/前駆細胞特異的にαE–カテニンを欠失させると、細胞間接着が形成できず、さらに細胞極性がなくなる。加えて、細胞数の増加、細胞周期の短縮、[[アポトーシス]]の減少がみられ、最終的な大脳皮質の厚みや大きさが増す。このノックアウト細胞では、大脳皮質の発生過程において細胞増殖を促進する[[ヘッジホッグ]]シグナル伝達経路が強く活性化している。以上より、ノックアウト細胞では、細胞接着の崩壊により細胞密度を物理的に感知できなくなり、細胞は低密度であると感じ続け、ヘッジホックシグナル伝達の活性化を介して細胞増殖を促進し、細胞数の増加そして大脳皮質の過形成へとつながると解釈される。正常な場合は、αE–カテニンは発生過程における細胞増殖に関わるシグナル伝達と細胞間接着の制御とをうまく連動させることで、発生時期の大脳皮質の大きさを調節していると示唆される。これは、αE––カテニンの接着構造の制御自体だけでなく、複数のシグナル伝達系を仲介するという新たな機能であると議論されている<ref name=ref5 />。 | |||
==疾患との関わり== | ==疾患との関わり== | ||
(他に特記する事があればご指摘下さい) | |||
もともと、δ–カテニンは[[家族性アルツハイマー病]]の原因遺伝子である[[プレセニリン1]]の相互作用因子の解析から同定された<ref name=ref31><pubmed> 9172160 </pubmed></ref>。染色体上のδ–カテニン遺伝子座を含む領域の欠損は、[[精神発達遅滞]]を起こすヒト遺伝病の一つである[[ネコ鳴き症候群患者]]に多くみられ、その後のδ–カテニンの[[ノックアウトマウス]]の解析から、δ–カテニンはその症候群でみられる精神発達遅滞との関連が示唆された。そのノックアウトマウスでは、[[視覚]]からの刺激に対する[[視覚野]]の応答に障害がみられ、海馬の[[短期増強]]と[[長期増強]]の異常を示す。このノックアウトマウスの発生期のシナプス形成には異常はみられず、生存可能であるが、10週齢になると、大脳皮質のシナプスの密度の減少やシナプスの維持の欠落が見られるようになる。その分子機構はまだ不明であるが、δ–カテニンは、シナプスの[[スパイン]]構造の維持で機能することで、正常な[[認知機能]]やそれに繋がりうる[[精神発達]]に寄与すると示唆されている<ref name=ref32><pubmed> 19403811 </pubmed></ref> 。 | |||
もともと、δ | |||
==関連項目== | ==関連項目== | ||
| 242行目: | 159行目: | ||
*[[細胞骨格]] | *[[細胞骨格]] | ||
*[[Wnt]] | *[[Wnt]] | ||
*[[ | *[[GSK3β]] | ||
==参考文献== | ==参考文献== | ||
<references/> | <references/> | ||
2014年2月2日 (日) 19:35時点における版
林 華子、米村 重信
理化学研究所 発生・再生科学総合研究センター 電子顕微鏡解析室
DOI XXXX/XXXX 原稿受付日:2012年11月28日 原稿完成日:2013年xx月XX日
担当編集委員:尾藤晴彦(東京大学大学院医学系研究科 神経生化学分野)
英語名:catenin 独:Catenin
カテニンは、細胞間接着の必須因子である接着分子カドヘリンの中のクラシックカドヘリンと複合体(カドヘリン・カテニン複合体)を形成するタンパク質の総称である[1](図1)。カドヘリン・カテニン複合体中のカテニンのうち、α–カテニンは細胞骨格との連結、β–カテニンはカドヘリンとα–カテニンとの結合を担っており、どちらもカドヘリンによる細胞接着に必須である。p120–カテニンはエンドサイトーシスを介してカドヘリンの発現量の調節を行っている[2]。細胞接着とは別の働きとして、β–カテニンはWnt/β–カテニンシグナルにおいて重要な役割を果たし、遺伝子発現調節を行う。α–カテニンも増殖のシグナルを調節する因子として研究が進んでいる(図2)。カテニンは脳の形態形成、神経細胞の伸長、シナプス形成などにも重要な働きをしている[3](図3)。
カテニンとは
(イントロダクションを御願い致します)
種類
カテニンの主要な種類には、α–カテニン、β–カテニン、γ–カテニン/プラコグロビン、δ–カテニンがある。それぞれにサブタイプが存在する。
| タイプ | サブタイプ | ヒトにおける遺伝子名 | データベース上での遺伝子、タンパク質情報 | タンパク質立体構造 (Protein Data Bank Europeより) |
組織におけるタンパク発現([[w:UniGene|UniGene]より) | ||
| RefSeq | UniProt | HUGO | |||||
| α–カテニン | αE–カテニン | CTNNA1 | NM_001903 | P35221 | ID2509 | CTNNA1 | 全身の多くの組織。扁桃腺での発現は検出されていない。 |
| αN–カテニン | CTNNA2 | NM_004389 | P26232 | ID2510 | CTNNA2 | 中枢神経系特異的な発現。 | |
| αT–カテニン | CTNNA3 | NM_013266 | Q9UI47 | ID2511 | データなし | 心臓、結合組織や脳において特に発現が高い。 | |
| β–カテニン | β–カテニン | CTNNB1 | NP_001091679 | P35222 | ID2514 | CTNNB1 | 全身の多くの組織にて発現あり。脂肪組織や副甲状腺、扁桃腺などでは発現は認められていない。 |
| γ–カテニン | γ–カテニン (プラコグロビン) |
JUP | XM_005257316 | P14923 | ID6207 | Jup | 全身の多くの組織にて発現あり。脂肪組織や副甲状腺、扁桃腺などでは発現は認められていない。 |
| p120–カテニン | p120–カテニン | CTNND1 | NM_001331 | O60716 | ID2515 | CTNND1 | 全身の多くの組織で発現。ただし、脾臓やへその緒などでは発現が認められていない。 |
| δ–カテニン | CTNND2 | NM_001332 | Q9UQB3 | ID2516 | データなし | 脳組織に特異的な発現。 | |
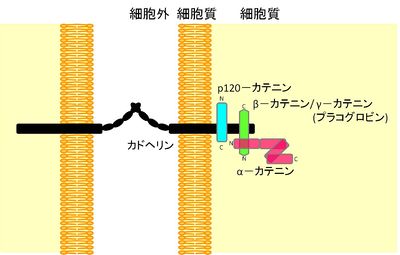
カテニンはカドヘリンの細胞質領域と結合してカドヘリン・カテニン複合体を作るが、カテニンが結合しうるカドヘリンはE–, N–, VE–カドヘリン等のクラッシックカドヘリンのみである。
α–カテニン
αE–カテニン、αN–カテニン、αT–カテニンがこのグループに属する。
構造
発現
組織全般にはαE–カテニンが発現し、神経系にはαN–カテニン特異的に発現している。発生中の中枢神経系では、神経前駆細胞にはαE–カテニンが発現しているが、それが神経細胞に分化するとαE–カテニンの発現は見られなくなり、αN–カテニンが発現するようになる[4]。
機能
α–カテニンはβ–カテニンとアクチン線維とに結合する。カドヘリン接着活性は、α–カテニンによって支えられており、その役割はカドヘリン・カテニン複合体とアクチン線維との結合であると考えられている[5]。α–カテニンが発現していなければ、カドヘリンが発現していても、接着分子としてのカドヘリンは実質的に機能しない。
α–カテニンはβ–カテニンとはN末端で結合し、C末端ではアクチン線維と結合する。このC末端のアクチン線維結合領域の重要性は、ショウジョウバエの形態形成[6]やマウスの発生[7]において示されている。α–カテニンはビンキュリン、エプリン、ZO–1、αアクチニンなどのアクチン結合タンパク質とも結合するので、それらの結合を介して間接的にアクチン線維を連結している可能性もある[8]。
さらに、α–カテニンは、アドヘレンス・ジャンクションにおいて細胞間の張力を感知・伝達する分子であることが示され、動的なアドへレンス・ジャンクション形成に重要であると考えられる[9]。
また、αE–カテニンは、細胞間接着の機能とは別に、細胞増殖を負に制御することが知られている。細胞増殖の接触阻止に対する調節に重要なHippoシグナル伝達においては、転写制御を通じて増殖を抑制する[10]。後述するように神経系では、αN–カテニンが神経回路形成を担うシナプス形成や安定性に必要である。大脳皮質における細胞増殖、神経突起の伸長の制御を行っているという報告もある[11]。
β–カテニン、γ–カテニン
β–カテニンとγ–カテニン(プラコグロビンとも呼ばれる)がこのグループに属する。両者は高い相同性(76%以上の相同性)をもつ。
構造
発現
機能
β–カテニンにはカドヘリン・カテニン複合体中のメンバーとしての細胞接着への必須な役割と、Wnt/β–カテニンシグナルの転写制御因子としての役割とがある。γ–カテニンはプラコグロビンとも呼ばれ、β–カテニンと高い相同性(76%以上の相同性)をもつ。
細胞間接着におけるβ–カテニンの役割は、カドヘリンとα–カテニンとの連結にある[12]。β–カテニンのN末端とC末端を除いた大部分はアルマジロ反復配列であり、ほぼその全体にカドヘリンの細胞質領域の細胞膜より遠い部分が結合する。α–カテニンとは、そのアルマジロ反復配列のもっともN末よりの部分で結合する[13]。F9細胞ではβ–カテニンをノックアウトしてもプラコグロビンの発現が増加し、カドヘリンによる細胞接着能は維持されるが、プラコグロビンもあわせてノックアウトするとその接着能は失われることが示されている[14]。しかし、カドヘリンが発現していない細胞に、カドヘリンとα–カテニンとを融合したタンパク質を発現させれば、β–カテニンが存在しなくてもカドヘリンの機能は発揮される[15]。
ショウジョウバエのアルマジロ遺伝子は胚の体節形成に異常を示す変異体のスクリーニングから発見されWntシグナル伝達系の転写制御因子として核内においても機能することが知られていた。のちに哺乳類のカドヘリン・カテニン複合体中のβ–カテニンがアルマジロ遺伝子のオーソログであることが判明し、脊椎動物のβ–カテニンにも発生における遺伝子発現において重要な役割があることがわかった。Wntシグナルがない状態では、細胞質のβ–カテニン(カドヘリン・カテニン複合体中のものとは別である)はGSK3βによりリン酸化され、それを標的としたユビキチン化により、プロテアソームによるタンパク質分解をうけることで、その量が低く保たれている。WntシグナルがやってくればGSK3βによるリン酸化が抑制され、β–カテニンは核内へ移行し、TCF/LEFと複合体を形成し、細胞周期関連因子や体軸決定因子などの標的遺伝子を活性化する[12]。これは、ウニの発生を初めとし無脊椎動物、脊椎動物両方において報告されている[12]。神経系においても、シナプス形成と可塑性や神経幹細胞の未分化状態の維持など多岐にわたる寄与が報告されている[16] [17]。
δ–カテニン
p120–カテニンとδ–カテニンがこのグループに属する。(PSD-95やGRIPとも相互作用すると思います。これらの点についても御願い致します)
構造
δ–カテニンはそのアルマジロ反復配列で、カドヘリンの細胞膜に近接した細胞質領域と結合する。
発現
δ–カテニンは、神経系特異的な発現が特徴で、δ–カテニンの局在は、樹状突起のシナプスに強く観察され、樹状突起の形態変化に寄与する。
機能
p120–カテニン
もともとは、強くチロシンリン酸化をうける分子として同定された[18]。p120–カテニンは、カドヘリンとの結合を介してカドヘリンのエンドサイトーシスを抑制し、細胞膜上のカドヘリン量を維持する。チロシンリン酸化はp120–カテニンのカドヘリンとの結合解除に寄与する。このカドヘリンのp120–カテニン結合領域内には、そのエンドサイトーシスシグナルが存在し、カドヘリンにp120–カテニンが結合することによって、そのシグナルがマスクされ、その結果としてカドヘリンは細胞内に取り込まれないようになっているという機構が近年示されている[19] [20]。カドヘリンの接着活性がない大腸癌由来の細胞株を用いた解析からは、p120–カテニンはカドヘリンと結合することで接着活性を抑制する結合因子であることが示された[21]。カドヘリンの発現量の低下は悪性腫瘍組織でみられる特徴の一つあるが[22]、そのような腫瘍組織のいくつかの種類では、p120–カテニンが細胞膜に局在できないことによってカドヘリンのエンドサイトーシスが亢進されると解釈される[23]。また、p120–カテニンは細胞膜直下のアクチン線維動態も制御している。p120–カテニンはアクチン細胞骨格動態の主要な制御因子である低分子量Gタンパク質RhoAと結合し、RhoAの活性化を抑制し、一方で糸状仮足や葉状仮足の発達につながる膜直下のアクチン細胞骨格の再編成に必要な他の低分子量Gタンパク質RacやCdc42を活性化することで、細胞接着形成の初期段階においてアクチン細胞骨格の再編成を促進すると考えられている[24]。細胞質におけるRhoAとの結合はp120–カテニンのリン酸化に依存している[24]が、先に述べたように、p120–カテニンのリン酸化の増加がカドヘリンの接着活性の低下に働くことを考えあわせると、p120–カテニンのリン酸化の制御は細胞接着と細胞運動の適切な均衡をとるという機構の一つになると考えられる。ラット海馬由来の培養神経細胞においても、上述したp120–カテニンのRhoA、Rac、そしてCdc42の活性制御を介してアクチン細胞骨格動態を活性化させ、神経樹状突起伸長の促進やシナプス可塑性の適切な制御に寄与している[25]。
p120–カテニンは、PLEKHA7タンパク質、そして微小管マイナス端に局在するNezhaタンパク質を介してアドへレンス・ジャンクションへの微小管を繫ぎとめることが示されている[26]。また、アフリカツメガエル胚では、p120–カテニンが核内で転写抑制因子Kaisoと結合し、脊椎動物の形態形成に必須なWnt/PCPシグナル伝達系(Wnt/β–カテニンシグナル伝達系とは違うWntシグナル)のxWnt11の遺伝子発現を活性化することが示された[27]。しかし、p120–カテニンの核移行の分子機構(核移行の生理的な場合のトリガーの同定やp120–カテニンのリン酸化との関連など)やxWnt11以外の標的の遺伝子群についてはわかっていない点が多い[28]。situ
神経系特異的な発現を示すδ–カテニン
マウスの脳組織における免疫沈降実験から、δ–カテニンはN–カドヘリンとβ–カテニンと結合することが確認され、シナプスにおいてカドヘリン・カテニン複合体の一員として機能することが予想される[29]。また、ラット神経組織の初代培養細胞では、δ–カテニンはGSK3β、β–カテニンと複合体を形成し、β–カテニンの分解を促進させる機能も有する[30]。
脳におけるカテニンの機能
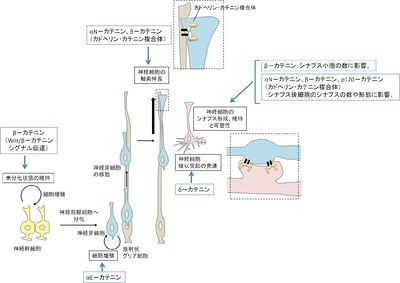
神経発生
神経発生時には、神経管の脳室側で未分化細胞が分裂し、表層方向へと移動し、適材適所に細胞が多種のニューロンへと分化し、その種類ごとに住みわけるように脳室面から表層方向に層構造を形成する。ニューロンはネットワークを形成し、神経活動を伝達する。αN–カテニンの欠損マウスでは小脳や海馬において層構造の形成がうまくいかない[31]。ゼブラフィッシュの中脳では、Wnt/β–カテニンシグナル伝達系が中脳視蓋のサイズの制御に寄与していることが示されている。LEFによる転写が活性化すると、中脳領域での神経前駆細胞の増殖が促進する。その転写活性の制御が神経前駆細胞の増殖制御を介して中脳視蓋の大きさに影響をもたらすのではないかと考えられている[32]。成体の海馬にも、神経幹細胞が存在しており、自己複製する一方で、神経細胞などへ分化することで新たな神経細胞となる。Wnt/β–カテニンシグナル伝達系は、海馬では神経幹細胞が神経前駆細胞へと分化するために必須であることがマウスやラットを用いた解析から示されている[33]。海馬の神経幹細胞では、幹細胞から神経細胞への分化を決定する遺伝子の発現を制御するDNA配列があり、転写因子Sox2がそのDNA配列を認識することによりその下流にある遺伝子発現が抑制され、未分化のままを維持できる。しかし、隣接するアストロサイト細胞で産生されたWntにより幹細胞のWnt/β–カテニンシグナル伝達系が活性化すると、β–カテニンが核へ移行し、TCF/LEFとの複合体として、Sox2の認識配列とオーバーラップした領域に結合するようになる。その結果として、その下流の遺伝子発現が活性化され、神経前駆細胞へと分化が誘導される。
成長円錐の伸長
成長円錐の伸長には、その先端でのアクチン分子の重合の力が利用されている。アクチンの重合が有効に成長円錐の伸長に使われるためには、形成されたアクチン線維が細胞外基質と間接的に連結し、基質に対して動かない必要がある。基質に結合する接着分子とアクチン線維との結合を担う分子をクラッチ分子と呼ぶが(実際にはアクチン線維と接着分子とを強固に結合するのではなく、結合解離を繰り返してアクチン線維は後方へ動くが、そのスピードがアクチン重合よりも遅ければ、成長円錐は伸長できる)、αN–カテニンはクラッチ分子として働くという報告がある。カドヘリン・カテニン複合体とアクチン線維との連結の適切な調節は成長円錐の伸長にも重要である[34]。
シナプス形成と可塑性
シナプスは、神経回路内の情報伝達の場である。樹状突起表面にはスパインという突起構造が無数にあり、スパイン上ではシナプスが形成されている。シナプスを介した情報伝達に伴ってスパインの形態変化が見られ、それはシナプス形成やシナプス可塑性に関わると考えられている。スパインを形づくる主要な細胞骨格はアクチン線維であり、そこでのアクチン動態はスパインの運動性や形態を動的に変化させ、複数のアクチン結合タンパク質によってそのアクチン動態が制御されている。α–カテニンはスパインの安定化に働いている。αN–カテニン欠損マウスから得られた海馬の神経培養細胞では、N–カドヘリンやβ–カテニンは他のスパインマーカーとともにスパインに局在するが、スパインの形態やその時間変化に異常がみられ、安定的なシナプス構造が維持できない。一方で、αN–カテニンの過剰発現によって、樹状突起上のスパインの数の増加、さらにはスパインのターンオーバーが低下する。これらには、αN–カテニンのN末とC末の領域が必要であり、ここでもN–カドヘリン・β–カテニン・αN–カテニン、そしてアクチン線維が一連に繋がることが必須であることが示唆されている。
スパインのシナプス周辺領域では、N–カドヘリン・カテニン複合体による接着構造が形成され、シナプスの安定化に寄与していると考えられる。樹状突起と軸索とがシナプスを形成する際、スパインはもともと動的な糸状仮足様の構造をとっているが、軸索からの活動電位が伝わり、シナプス後膜が興奮性の活動電位を示すようになると、マッシュルーム型の構造へと変化し、安定化する。逆に、ナトリウムチャネルをブロックすることで、興奮性の活動電位を阻害すると、スパインは安定的な構造から動的な糸状仮足のような構造へと変化する。それと同時に、シナプスからαN–カテニンが消失する。αN–カテニンの過剰発現により、このナトリウムチャネル阻害依存的なスパインの形態変化が緩和される[35][36][37]。このように神経活動によってシナプス接合部においてカドヘリン・カテニン、そして細胞骨格の連結が制御を受け、その結果としてシナプス構造やその安定性の変化、そしてシナプス伝達の制御に寄与しているという考えが提唱されている[38]。変異型β–カテニンを発現させたマウスの海馬から分離した神経培養細胞では、活性化されたシナプス前膜直下に集積しているシナプス小胞の数の維持にβ–カテニンが重要であることが示された。ここでは、α–カテニンとの結合領域は必要ないので、β–カテニンが細胞接着構造を制御することだけに寄与しているのではないと考えられる[36]。加えて、細胞接着やWnt/β–カテニンシグナル伝達経路とは別に、β–カテニンの新たなシグナル伝達経路が神経情報伝達において利用されていることが、神経初代培養細胞の解析から明らかになった。NMDA型グルタミン受容体が活性化すると、Wntとは関係なく、β–カテニンが切断され、その後はWnt/β–カテニンシグナル伝達経路と同様に核で機能する[39]。p120–カテニンによるRhoA活性の抑制は、樹状突起上のスパインの密度の維持に寄与する[40]。一方で、N–カドヘリンとp120–カテニンとの複合体の構造解析によって明らかになった両者の結合に重要なアミノ酸残基についての点変異体を発現させた海馬の神経培養細胞では、p120–カテニンがN–カドヘリンと結合できず、スパインの密度やスパインの幅が減少する[19]。δ–カテニンはスパインのサイズや数、形態の維持に必要である[41]。
大脳皮質のサイズ制御
中枢神経系の幹/前駆細胞特異的にαE–カテニンを欠失させると、細胞間接着が形成できず、さらに細胞極性がなくなる。加えて、細胞数の増加、細胞周期の短縮、アポトーシスの減少がみられ、最終的な大脳皮質の厚みや大きさが増す。このノックアウト細胞では、大脳皮質の発生過程において細胞増殖を促進するヘッジホッグシグナル伝達経路が強く活性化している。以上より、ノックアウト細胞では、細胞接着の崩壊により細胞密度を物理的に感知できなくなり、細胞は低密度であると感じ続け、ヘッジホックシグナル伝達の活性化を介して細胞増殖を促進し、細胞数の増加そして大脳皮質の過形成へとつながると解釈される。正常な場合は、αE–カテニンは発生過程における細胞増殖に関わるシグナル伝達と細胞間接着の制御とをうまく連動させることで、発生時期の大脳皮質の大きさを調節していると示唆される。これは、αE––カテニンの接着構造の制御自体だけでなく、複数のシグナル伝達系を仲介するという新たな機能であると議論されている[4]。
疾患との関わり
(他に特記する事があればご指摘下さい) もともと、δ–カテニンは家族性アルツハイマー病の原因遺伝子であるプレセニリン1の相互作用因子の解析から同定された[42]。染色体上のδ–カテニン遺伝子座を含む領域の欠損は、精神発達遅滞を起こすヒト遺伝病の一つであるネコ鳴き症候群患者に多くみられ、その後のδ–カテニンのノックアウトマウスの解析から、δ–カテニンはその症候群でみられる精神発達遅滞との関連が示唆された。そのノックアウトマウスでは、視覚からの刺激に対する視覚野の応答に障害がみられ、海馬の短期増強と長期増強の異常を示す。このノックアウトマウスの発生期のシナプス形成には異常はみられず、生存可能であるが、10週齢になると、大脳皮質のシナプスの密度の減少やシナプスの維持の欠落が見られるようになる。その分子機構はまだ不明であるが、δ–カテニンは、シナプスのスパイン構造の維持で機能することで、正常な認知機能やそれに繋がりうる精神発達に寄与すると示唆されている[41] 。
関連項目
参考文献
- ↑
Ozawa, M., Baribault, H., & Kemler, R. (1989).
The cytoplasmic domain of the cell adhesion molecule uvomorulin associates with three independent proteins structurally related in different species. The EMBO journal, 8(6), 1711-7. [PubMed:2788574] [PMC] [WorldCat] - ↑
McCrea, P.D., & Gu, D. (2010).
The catenin family at a glance. Journal of cell science, 123(Pt 5), 637-42. [PubMed:20164302] [PMC] [WorldCat] [DOI] - ↑
Arikkath, J. (2009).
Regulation of dendrite and spine morphogenesis and plasticity by catenins. Molecular neurobiology, 40(1), 46-54. [PubMed:19401831] [WorldCat] [DOI] - ↑ 4.0 4.1
Lien, W.H., Klezovitch, O., Fernandez, T.E., Delrow, J., & Vasioukhin, V. (2006).
alphaE-catenin controls cerebral cortical size by regulating the hedgehog signaling pathway. Science (New York, N.Y.), 311(5767), 1609-12. [PubMed:16543460] [PMC] [WorldCat] [DOI] - ↑
Hirano, S., Kimoto, N., Shimoyama, Y., Hirohashi, S., & Takeichi, M. (1992).
Identification of a neural alpha-catenin as a key regulator of cadherin function and multicellular organization. Cell, 70(2), 293-301. [PubMed:1638632] [WorldCat] [DOI] - ↑
Desai, R., Sarpal, R., Ishiyama, N., Pellikka, M., Ikura, M., & Tepass, U. (2013).
Monomeric α-catenin links cadherin to the actin cytoskeleton. Nature cell biology, 15(3), 261-73. [PubMed:23417122] [WorldCat] [DOI] - ↑
Torres, M., Stoykova, A., Huber, O., Chowdhury, K., Bonaldo, P., Mansouri, A., ..., & Gruss, P. (1997).
An alpha-E-catenin gene trap mutation defines its function in preimplantation development. Proceedings of the National Academy of Sciences of the United States of America, 94(3), 901-6. [PubMed:9023354] [PMC] [WorldCat] [DOI] - ↑
Maiden, S.L., & Hardin, J. (2011).
The secret life of α-catenin: moonlighting in morphogenesis. The Journal of cell biology, 195(4), 543-52. [PubMed:22084304] [PMC] [WorldCat] [DOI] - ↑
Yonemura, S., Wada, Y., Watanabe, T., Nagafuchi, A., & Shibata, M. (2010).
alpha-Catenin as a tension transducer that induces adherens junction development. Nature cell biology, 12(6), 533-42. [PubMed:20453849] [WorldCat] [DOI] - ↑
Robinson, B.S., & Moberg, K.H. (2011).
Cell-cell junctions: α-catenin and E-cadherin help fence in Yap1. Current biology : CB, 21(21), R890-2. [PubMed:22075429] [PMC] [WorldCat] [DOI] - ↑
Hirano, S., & Takeichi, M. (2012).
Cadherins in brain morphogenesis and wiring. Physiological reviews, 92(2), 597-634. [PubMed:22535893] [WorldCat] [DOI] - ↑ 12.0 12.1 12.2
Valenta, T., Hausmann, G., & Basler, K. (2012).
The many faces and functions of β-catenin. The EMBO journal, 31(12), 2714-36. [PubMed:22617422] [PMC] [WorldCat] [DOI] - ↑
Gooding, J.M., Yap, K.L., & Ikura, M. (2004).
The cadherin-catenin complex as a focal point of cell adhesion and signalling: new insights from three-dimensional structures. BioEssays : news and reviews in molecular, cellular and developmental biology, 26(5), 497-511. [PubMed:15112230] [WorldCat] [DOI] - ↑
Fukunaga, Y., Liu, H., Shimizu, M., Komiya, S., Kawasuji, M., & Nagafuchi, A. (2005).
Defining the roles of beta-catenin and plakoglobin in cell-cell adhesion: isolation of beta-catenin/plakoglobin-deficient F9 cells. Cell structure and function, 30(2), 25-34. [PubMed:16357441] [WorldCat] [DOI] - ↑
Nagafuchi, A., Ishihara, S., & Tsukita, S. (1994).
The roles of catenins in the cadherin-mediated cell adhesion: functional analysis of E-cadherin-alpha catenin fusion molecules. The Journal of cell biology, 127(1), 235-45. [PubMed:7929566] [PMC] [WorldCat] [DOI] - ↑ Elkouby, Y. M., Frank, D.
Wnt/beta-Catenin Signaling in Vertebrate Posterior Neural Development
Developmental Biology (San Rafael (CA)):2010 - ↑
Wisniewska, M.B. (2013).
Physiological role of β-catenin/TCF signaling in neurons of the adult brain. Neurochemical research, 38(6), 1144-55. [PubMed:23377854] [PMC] [WorldCat] [DOI] - ↑
Reynolds, A.B., Roesel, D.J., Kanner, S.B., & Parsons, J.T. (1989).
Transformation-specific tyrosine phosphorylation of a novel cellular protein in chicken cells expressing oncogenic variants of the avian cellular src gene. Molecular and cellular biology, 9(2), 629-38. [PubMed:2469003] [PMC] [WorldCat] [DOI] - ↑ 19.0 19.1
Ishiyama, N., Lee, S.H., Liu, S., Li, G.Y., Smith, M.J., Reichardt, L.F., & Ikura, M. (2010).
Dynamic and static interactions between p120 catenin and E-cadherin regulate the stability of cell-cell adhesion. Cell, 141(1), 117-28. [PubMed:20371349] [WorldCat] [DOI] - ↑
Nanes, B.A., Chiasson-MacKenzie, C., Lowery, A.M., Ishiyama, N., Faundez, V., Ikura, M., ..., & Kowalczyk, A.P. (2012).
p120-catenin binding masks an endocytic signal conserved in classical cadherins. The Journal of cell biology, 199(2), 365-80. [PubMed:23071156] [PMC] [WorldCat] [DOI] - ↑
Aono, S., Nakagawa, S., Reynolds, A.B., & Takeichi, M. (1999).
p120(ctn) acts as an inhibitory regulator of cadherin function in colon carcinoma cells. The Journal of cell biology, 145(3), 551-62. [PubMed:10225956] [PMC] [WorldCat] [DOI] - ↑
Hanahan, D., & Weinberg, R.A. (2000).
The hallmarks of cancer. Cell, 100(1), 57-70. [PubMed:10647931] [WorldCat] [DOI] - ↑
Thoreson, M.A., & Reynolds, A.B. (2002).
Altered expression of the catenin p120 in human cancer: implications for tumor progression. Differentiation; research in biological diversity, 70(9-10), 583-9. [PubMed:12492499] [WorldCat] [DOI] - ↑ 24.0 24.1
Castaño, J., Solanas, G., Casagolda, D., Raurell, I., Villagrasa, P., Bustelo, X.R., ..., & Duñach, M. (2007).
Specific phosphorylation of p120-catenin regulatory domain differently modulates its binding to RhoA. Molecular and cellular biology, 27(5), 1745-57. [PubMed:17194753] [PMC] [WorldCat] [DOI] 引用エラー: 無効な<ref>タグ; name "ref24"が異なる内容で複数回定義されています - ↑
Kwiatkowski, A.V., Weis, W.I., & Nelson, W.J. (2007).
Catenins: playing both sides of the synapse. Current opinion in cell biology, 19(5), 551-6. [PubMed:17936606] [PMC] [WorldCat] [DOI] - ↑
Meng, W., Mushika, Y., Ichii, T., & Takeichi, M. (2008).
Anchorage of microtubule minus ends to adherens junctions regulates epithelial cell-cell contacts. Cell, 135(5), 948-59. [PubMed:19041755] [WorldCat] [DOI] - ↑
Kim, S.W., Park, J.I., Spring, C.M., Sater, A.K., Ji, H., Otchere, A.A., ..., & McCrea, P.D. (2004).
Non-canonical Wnt signals are modulated by the Kaiso transcriptional repressor and p120-catenin. Nature cell biology, 6(12), 1212-20. [PubMed:15543138] [WorldCat] [DOI] - ↑
Menke, A., & Giehl, K. (2012).
Regulation of adherens junctions by Rho GTPases and p120-catenin. Archives of biochemistry and biophysics, 524(1), 48-55. [PubMed:22583808] [WorldCat] [DOI] - ↑
Lu, Q., Paredes, M., Medina, M., Zhou, J., Cavallo, R., Peifer, M., ..., & Kosik, K.S. (1999).
delta-catenin, an adhesive junction-associated protein which promotes cell scattering. The Journal of cell biology, 144(3), 519-32. [PubMed:9971746] [PMC] [WorldCat] [DOI] - ↑
Bareiss, S., Kim, K., & Lu, Q. (2010).
Delta-catenin/NPRAP: A new member of the glycogen synthase kinase-3beta signaling complex that promotes beta-catenin turnover in neurons. Journal of neuroscience research, 88(11), 2350-63. [PubMed:20623542] [PMC] [WorldCat] [DOI] - ↑
Park, C., Falls, W., Finger, J.H., Longo-Guess, C.M., & Ackerman, S.L. (2002).
Deletion in Catna2, encoding alpha N-catenin, causes cerebellar and hippocampal lamination defects and impaired startle modulation. Nature genetics, 31(3), 279-84. [PubMed:12089526] [WorldCat] [DOI] - ↑
Ota, S., Ishitani, S., Shimizu, N., Matsumoto, K., Itoh, M., & Ishitani, T. (2012).
NLK positively regulates Wnt/β-catenin signalling by phosphorylating LEF1 in neural progenitor cells. The EMBO journal, 31(8), 1904-15. [PubMed:22373574] [PMC] [WorldCat] [DOI] - ↑
Kuwabara, T., Hsieh, J., Muotri, A., Yeo, G., Warashina, M., Lie, D.C., ..., & Gage, F.H. (2009).
Wnt-mediated activation of NeuroD1 and retro-elements during adult neurogenesis. Nature neuroscience, 12(9), 1097-105. [PubMed:19701198] [PMC] [WorldCat] [DOI] - ↑
Bard, L., Boscher, C., Lambert, M., Mège, R.M., Choquet, D., & Thoumine, O. (2008).
A molecular clutch between the actin flow and N-cadherin adhesions drives growth cone migration. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(23), 5879-90. [PubMed:18524892] [PMC] [WorldCat] [DOI] - ↑
Togashi, H., Abe, K., Mizoguchi, A., Takaoka, K., Chisaka, O., & Takeichi, M. (2002).
Cadherin regulates dendritic spine morphogenesis. Neuron, 35(1), 77-89. [PubMed:12123610] [WorldCat] [DOI] - ↑ 36.0 36.1
Bamji, S.X., Shimazu, K., Kimes, N., Huelsken, J., Birchmeier, W., Lu, B., & Reichardt, L.F. (2003).
Role of beta-catenin in synaptic vesicle localization and presynaptic assembly. Neuron, 40(4), 719-31. [PubMed:14622577] [PMC] [WorldCat] [DOI] - ↑
Abe, K., Chisaka, O., Van Roy, F., & Takeichi, M. (2004).
Stability of dendritic spines and synaptic contacts is controlled by alpha N-catenin. Nature neuroscience, 7(4), 357-63. [PubMed:15034585] [WorldCat] [DOI] - ↑
Takeichi, M., & Abe, K. (2005).
Synaptic contact dynamics controlled by cadherin and catenins. Trends in cell biology, 15(4), 216-21. [PubMed:15817378] [WorldCat] [DOI] - ↑
Abe, K., & Takeichi, M. (2007).
NMDA-receptor activation induces calpain-mediated beta-catenin cleavages for triggering gene expression. Neuron, 53(3), 387-97. [PubMed:17270735] [WorldCat] [DOI] - ↑
Elia, L.P., Yamamoto, M., Zang, K., & Reichardt, L.F. (2006).
p120 catenin regulates dendritic spine and synapse development through Rho-family GTPases and cadherins. Neuron, 51(1), 43-56. [PubMed:16815331] [PMC] [WorldCat] [DOI] - ↑ 41.0 41.1
Arikkath, J., Peng, I.F., Ng, Y.G., Israely, I., Liu, X., Ullian, E.M., & Reichardt, L.F. (2009).
Delta-catenin regulates spine and synapse morphogenesis and function in hippocampal neurons during development. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(17), 5435-42. [PubMed:19403811] [PMC] [WorldCat] [DOI] - ↑
Zhou, J., Liyanage, U., Medina, M., Ho, C., Simmons, A.D., Lovett, M., & Kosik, K.S. (1997).
Presenilin 1 interaction in the brain with a novel member of the Armadillo family. Neuroreport, 8(6), 1489-94. [PubMed:9172160] [WorldCat] [DOI]